Benson-Methode
Die Benson-Methode ist eine Methode zur Abschätzung der Bildungsenthalpie, Bildungsentropie und Wärmekapazität von Stoffen in der idealen Gasphase. Die Methode wurde von dem amerikanischen Chemiker Sidney Benson (1918–2011)[1] im Jahr 1958 entwickelt,[2] später mit modernen Rechenprogrammen weiter optimiert und für andere Aggregatzustände modifiziert.[3] Bereits 1976 fand die Methode Eingang in moderne Lehrbücher.[4]
Prinzip
Die Methode basiert auf der Annahme, dass jedes Atom eines Moleküls einen spezifischen Beitrag zu den thermodynamischen Eigenschaften eines Moleküls beiträgt. Die Bindungstypen aller Atome müssen hierfür prinzipiell bekannt sein, räumliche Geometrien (strukturelle Isomere, Konformere/Rotamere und Symmetrien) führen nur zu kleineren Sonderbeiträgen bei der Kumulation der Inkremente (Einzelbeiträge).[3]
Systematik am Beispiel Methanol
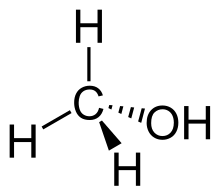
Methanol besteht aus einer Methylgruppe sowie einer Hydroxygruppe, die hierfür zu verwendenden Inkremente werden C-(H3)(O) und O-(H)(C) bezeichnet.[5]
- Zur Berechnung der Bildungsenthalpie in der Gasphase (298 K) sind die zwei Inkremente −42,26 und −159,33 kJ/mol zu verwenden (Methanol ber. −201,59; exp. −201,10 kJ/mol).
- Zur Berechnung der molaren Wärmekapazität Cp werden die Inkremente 25,73 und 18,16 J/mol K verwendet (Methanol ber. 43,89, exp. 43,89 J/mol K)
- Zur Berechnung der Entropie muss neben den Inkrementen 127,32 und 121,50 noch ein Symmetriebeitrag von −9,13 J/mol K berücksichtigt werden (Methanol ber. 239,69, exp. 239,70 J/mol K).
Die Arbeit von Domalski (1993) erlaubt mit anderen Inkrement-Sätzen auch die Berechnung thermodynamischer Daten für den flüssigen und festen Aggregatzustand.
Anwendung
Der eigentliche Nutzen liegt darin, für jedes beliebige Moleküle diese thermodynamischen Größen berechnen zu können. Reaktionswärmen (endotherm/exotherm) bei chemischen Reaktionen lassen sich aus den Differenzen der Bildungsenthalpien aller Reaktanten vorzüglich abschätzen, zum Beispiel bei der Oxidation des Methanols. Bei durchgängiger Benutzung von Daten für den gasförmigen bzw. den flüssigen Zustand werden rechnerisch vergleichbare Reaktionsenthalpien erhalten (Hess’scher Wärmesatz[6]) >>Not only is the method fairly easy to apply, but it usually can estimate properties with an uncertainty no larger than typical experimental uncertainties.<< (N. Cohen 1996)
Referenzdaten für Standard-Bildungsenthalpien finden sich im CRC Handbook of Chemistry and Physics im Kapitel 5.4.[7] Werte für den Gaszustand und flüssigen Zustand unterscheiden sich definitionsgemäß um den Betrag der Standard-Verdampfungsenthalpie (25 °C).
Reaktionsenthalpie Oxidation von Methanol
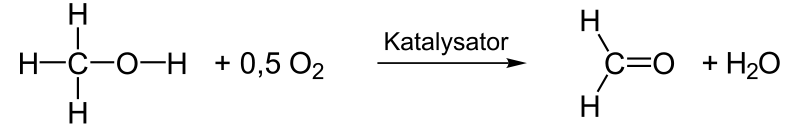
Die Bildungsenthalpie von Methanol ist −201,6 kJ/mol. Bei der Oxidation bilden sich Formaldehyd (= −108,6 kJ/mol) und Wasser (= −241,5 kJ/mol), der Prozess in der Gasphase ist stark exotherm (ber. −148 kJ/mol).[8]
Reaktionsenthalpie Hydratation von Formaldehyd
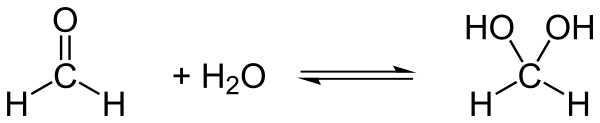
Leitet man das Formaldehydgas (= −108,6 kJ/mol) in Wasser (= −241,5 kJ/mol), so bildet sich das Hydrat (ber. = −380,9 kJ/mol). Diese Hydratisierung ist schwach exotherm, das Gleichgewicht liegt fast vollständig auf der Seite des Aldehydhydrats.
Reaktionsenthalpie Dehydrierung von Methylcyclohexan
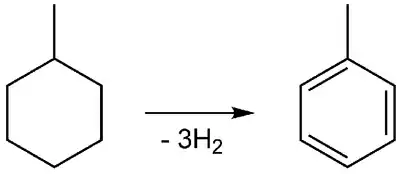
Das Erhitzen von Methylcyclohexan (ber. = −149,2 kJ/mol) mit Hydrier/Dehydrierkatalysatoren ergibt unter Wasserstoff-Abspaltung Toluol (ber. = +50,4 kJ/mol). Die Reaktion ist stark endotherm (ber. +200 kJ/mol).[9]
Die Umkehrung dieser Reaktion, die Hydrierung von aromatischen Kohlenwasserstoffen, setzt hohe Wärmemengen frei. Dies ist bedeutsam bei Prüfung von Dibenzyltoluol auf Eignung als flüssiger organischer Wasserstoffträger.
Reaktionsenthalpie Hydrolyse von Ethylenoxid

Bei der Addition von Wasser (= −241,5 kJ/mol) an Ethylenoxid (ber. = −52,6 kJ/mol) bei 200 °C oder unter Säurekatalyse in Wasser, so bildet sich u. a. Ethylenglycol (ber. = −384,5 kJ/mol). Die Reaktion ist wie beim homologen Propylenoxid stark exotherm (ber. −90 kJ/mol).[10]
Die Ringöffnungsreaktionen mit Aminen (z. B. "Epoxy-Amin-Additionen" bei 2K-Klebern) sind vergleichbar exotherm.
Reaktionsenthalpie Hydrolyse von Bernsteinsäureanhydrid
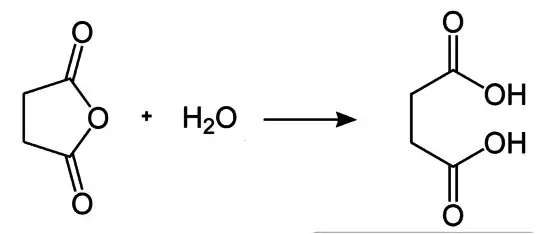
Bei der Addition von Wasser (= −241,5 kJ/mol) an Bernsteinsäureanhydrid (ber. = −527,9 kJ/mol) bildet sich Bernsteinsäure (ber. = −826,8 kJ/mol). Die Reaktion ist exotherm (ber. −57 kJ/mol).[11] Für die Hydrolyse von Maleinsäureanhydrid wird mit −53 kJ/mol eine vergleichbare Wärmetönung wie für Acetanhydrid oder Phthalsäureanhydrid berechnet.
Carbonatisierung von Ethylenoxid und Hydrolyse des Ethylencarbonats (OMEGA-Prozess)
Bei der Addition von Kohlendioxid (= −393,5 kJ/mol) an Ethylenoxid (ber. = −52,6 kJ/mol) bildet sich Ethylencarbonat (= −508,5 kJ/mol).
Dieser Teilschritt ist mit −62 kJ/mol exotherm.
.svg.png.webp)
Im 2. Schritt wird hieran Wasser (= −241,5 kJ/mol) addiert und unter Abspaltung von Kohlendioxid entsteht das Ethylenglycol (= −384,5 kJ/mol).
Der 2. Teilschritt ist mit −28 kJ/mol deutlich schwächer exotherm.
Weiterentwicklungen
Die Benson-Methode wurde in der Folge auch vor dem Hintergrund leistungsfähiger Computersysteme von mehreren Physikochemikern weiterentwickelt.
- 1993 gelang es Domalski, auch die Bildungsenthalpien von Stoffen in der flüssigen oder festen Phase vorherzusagen. Bei der Berechnung der Entropie in der flüssigen oder festen Phase entfällt die Berücksichtigung von Konformeren.[12]
- 1996 wurden von Cohen Werte für die Berechnung der Enthalpie in allen drei Phasen publiziert, welche die Genauigkeit der Werte von Domalski teilweise übersteigen.[13]
- Salmon und Dalmazzone veröffentlichten ab 2006 Gruppenbeiträge für die Bildungsenthalpie von Feststoffen.[14]
Weblinks
- NIST-Literaturübersicht zu "Bildungsenthalpien". – N. Cohen (1996) erhielt von NIST den Auftrag zur Validierung und Optimierung der Inkremente sowie Benennung von Referenzwerten.
Einzelnachweise
- Sidney William Benson (26. September 1918 – 30. Dezember 2011)
- Sidney W. Benson and Jerry H. Buss: Additivity Rules for the Estimation of Molecular Properties. Thermodynamic Properties. In: J. Chem. Phys.. 29, S. 546–572 (1958). doi:10.1063/1.1744539.
- B. E. Poling, J. M. Prausnitz, J. P. O. Connell; „The Properties of Gases and Liquids“, Fifth Edition, Mc-Graw-Hill International Editions
- T. H. Lowry and K. Schueller Richardson, Mechanism and Theory in Organic Chemistry, Verlag Harper & Row, 1. Aufl. 1976, dort Seite 71 ff (Thermochemistry).
- E. S. Domalski, E. D. Hearing; Estimation of the Thermodynamic Properties of C-H-N-O-S-X Compounds at 298K. In: J Phys Chem Ref Data, Vol. 22, 805–1159 (1993), Beispiel Methanol Seite 909.
- Hess’scher Wärmesatz zur Berechnung von Reaktionswärmen aus Bildungsenthalpien.
- STANDARD THERMODYNAMIC PROPERTIES OF CHEMICAL SUBSTANCES (Memento vom 26. April 2015 im Internet Archive), Kapitel 5.4 aus CRC Handbook 90. Auflage (2009–2010).
- Bildungsenthalpien Methanol und Formaldehyd siehe Domalski 1993, Seiten 935 und 909, Ber. aus Inkremente und exp. Werte.
- Bildungsenthalpien Methylcyclohexan und Toluol siehe Domalski 1993, Seiten 863 und 896, Ber. aus Inkremente und exp. Werte.
- Bildungsenthalpien Ethylenoxid und Ethylenglycol siehe Domalski 1993, Seiten 932 und 917, Ber. aus Inkremente und exp. Werte.
- Bildungsenthalpien Bernsteinsäureanhydrid und Bernsteinsäure siehe Domalski 1993, Seiten 964 und 951, Ber. aus Inkremente und exp. Werte.
- E. S. Domalski, E. D. Hearing; "Estimation of the Thermodynamic Properties of C-H-N-O-S-X Compounds at 298K", J. Phys. Chem. Ref. Data, Vol. 22, 805–1159 (1993)
- N. Cohen; "Revised Group Additivity Values for Enthalpies of Formation (at 298 K) of C-H and C-H-O Compounds", J. Phys. Chem. Ref. Data, Vol. 25, 1411–1481 (1996)
-
- "Prediction of Enthalpy of Formation in the Solid Phase (at 298 K) using Second-Order Group Contributions – Part I
- C-H and C-H-O Compounds", J. Phys. Chem. Ref. Data, Vol. 35, 1443–1457 (2006). – A. Salmon, D. Dalmazzone (Memento des Originals vom 29. März 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.; "Prediction of Enthalpy of Formation in the Solid State (at 298 K) Using Second-Order Group Contributions — Part II: C-H, C-H-O, and C-H-N-O Compounds", J. Phys. Chem. Ref. Data, Vol. 36, 19–58 (2007)