Tetramethylbutan
Tetramethylbutan ist das am stärksten verzweigte Isomer der Octane. Der hohe Verzweigungsgrad führt im Vergleich zu den eher kettenförmigen Isomeren zu abweichenden physikalischen Eigenschaften, wie z. B. einem signifikant höheren Schmelzpunkt, so dass die Verbindung als einziges der Octanisomere bei Raumtemperatur als Feststoff vorliegt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
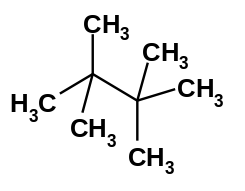 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetramethylbutan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H18 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 114,22 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
0,82 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
107 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung und Gewinnung
Die Synthese von Tetramethylbutan gelingt durch die Verknüpfung zweier tert.-Butylfunktionen. Bei einer frühen Darstellungsvariante wird tert.-Butylmagnesiumchlorid mit tert.-Butylchlorid umgesetzt.[5] Die Grignardverbindung kann in einer Eintopfvariante in situ bei der Umsetzung von tert.-Butylchlorid mit Magnesium gebildet und umgesetzt werden.[6]
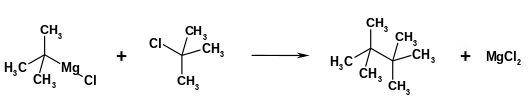
Die Dimerisierung von tert.-Butylbromid oder tert.-Butyliodid kann auch in Gegenwart von aktiviertem Kupfer erfolgen.[7] Eine weitere Darstellungsvariante ist die Umsetzung von tert.-Butyltrichlorsilan mit tert.-Butyllithium.[8]
Eigenschaften
Tetramethylbutan ist bei Raumtemperatur eine feste Substanz, die in zwei polymorphen Kristallformen auftritt.[3] Bei Raumtemperatur liegt die Kristallform I vor, die bei 100,8 °C in die flüssige Phase übergeht.[3] Bei −120,6 °C wird ein Phasenübergang von der Kristallform II zur Form I beobachtet. Hier erfolgt der Übergang von der kristallinen zu einer plastisch kristallinen Form.[3] Das bedeutet, die Verbindung liegt oberhalb dieser Temperatur bis zum Schmelzpunkt und somit auch bei Raumtemperatur in einem mesomorphen Zustand vor. Das Verhalten ist analog zu ähnlichen "kugelförmigen" Molekülen wie Cuban oder Adamantan, die ähnliche Mesophasen bilden. Der Siedepunkt der Verbindung liegt schon bei 107 °C, so dass die flüssige Phase bei Normaldruck nur in einem Temperaturbereich von etwa 6 K existiert.[3] Die Sublimationsdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,08335, B = 1724,764 und C = −38,383 im Temperaturbereich von 273 K bis 338 K.[3] Die Umwandlungsenthalpien betragen für den Übergang von Kristallform II zu I ΔtrH = 2,00 kJ·mol−1[3][9], für die Schmelze ΔmH = 7,54 kJ·mol−1[3][9] und die Verdampfung ΔbH = 42,91 kJ·mol−1.[10]
Einzelnachweise
- Datenblatt 2,2,3,3-Tetramethylbutane, ≥94% bei Sigma-Aldrich, abgerufen am 16. März 2013 (PDF).
- Eintrag zu 2,2,3,3-Tetramethylbutan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- D. W. Scott, D. R. Douslin, M. E. Gross, G. D. Oliver, H. M. Huffman: 2,2,3,3-Tetramethylbutane: Heat capacity, heats of transition, fusion and sublimation, vapor pressure, entropy and thermodynamic functions, in: J. Am. Chem. Soc., 1952, 74 (4), S. 883–887; doi:10.1021/ja01124a007.
- Eintrag zu 2,2,3,3-tetramethylbutane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Russell E. Marker, Thomas S. Oakwood: Hexamethylethane and Tetraalkylmethanes, in: J. Am. Chem. Soc., 1938, 60 (11), S. 2598; doi:10.1021/ja01278a011.
- Donal T. Flood, George Calingaert: Hexamethylethane, in: J. Am. Chem. Soc., 1934, 56 (5), S. 1211–1212; doi:10.1021/ja01320a067.
- Francis O. Ginah, Thomas A. Donovan Jr., Scott D. Suchan, Deborah R. Pfennig, Greg W. Ebert: Homocoupling of alkyl halides and cyclization of α,ω-dihaloalkanes via activated copper, in: J. Org. Chem., 1990, 55 (2), S. 584–589; doi:10.1021/jo00289a037.
- Michael P. Doyle, Charles T. West: Hindered organosilicon compounds. Synthesis and properties of di-tert-butyl-, di-tert-butylmethyl-, and tri-tert-butylsilanes, in: J. Am. Chem. Soc., 1975, 97 (13), S. 3777–3782; doi:10.1021/ja00846a037.
- E. S. Domalski, E. D. Hearing: Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III, in: J. Phys. Chem. Ref. Data, 1996, 25, S. 1–525; doi:10.1063/1.555985.
- Osborne, N.S.; Ginnings, D.C.: Measurements of heat of vaporization and heat capacity of a number of hydrocarbons in J. Res. NBS, 1947, 39, 453-477.



