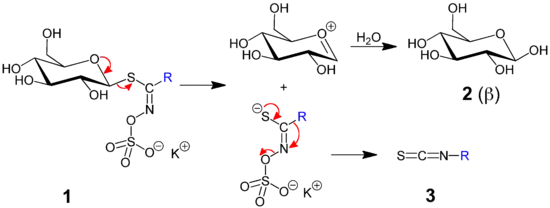
Senfölglycoside
Die Senfölglycoside, auch Glucosinolate, gehören zur Stoffgruppe der Glycoside. Da das Aglycon über ein Schwefelatom an den Zuckerteil (Glycon) gebunden ist, spricht man genauer von einem Thioglycosid.
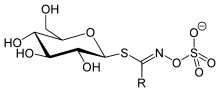
Senfölglycoside sind schwefel- und stickstoffhaltige chemische Verbindungen, die aus Aminosäuren gebildet werden. Diese sekundären Pflanzenstoffe geben Vertretern aus der Familie der Kreuzblütler wie Rettich, Meerrettich, Senf, Kresse und Kohl den etwas scharfen und bitteren Geschmack und sind in den daraus hergestellten Senfölen enthalten. Auch weitere Pflanzen aus der Ordnung der Kreuzblütlerartigen wie die Kapuzinerkressen enthalten zum Teil Senfölglycoside in nennenswerten Mengen.
Stoffgruppe
Es gibt rund 120 verschiedene Glucosinolate, die sich nur im Aglycon-Rest unterscheiden. Als Zucker tritt immer Glucose auf. Das Spaltungsenzym der Glucosinolate ist die Myrosinase, dieses liegt räumlich getrennt in den Zellen vor. Bei Verletzung der Zellen (Kauen oder Schneiden) kommen Myrosinase und Senfölglycoside zusammen, die hierbei zu Senfölen hydrolysiert werden. Senföle sind entweder nicht flüchtig und schmecken scharf oder sie sind flüchtig und riechen stechend.
Da Senfölglycoside als konstitutive Abwehrstoffe (Phytoanticipine) gegen Tierfraß wirken, kann im Rahmen der Evolutionstheorie angenommen werden, dass diese Stoffgruppe insofern einen Selektionsvorteil bewirkte.[1] Nach neueren Erkenntnissen beugen diese Geschmackstoffe Infektionen vor und unterstützen die Krebsprävention, wie Sulforaphan oder Iberin.[2] Senfölglycoside aus Kapuzinerkressenkraut und Meerrettichwurzel werden kombiniert in der Medizin als Phytotherapeutikum zur Behandlung und Prophylaxe von Atemwegs- und Harnwegsinfekten eingesetzt.
Unter bestimmten Bedingungen können sich aus Senfölglycosiden auch Thiocyanate bilden. Diese können bei hoher Konzentration oder bei hoher Aufnahme, insbesondere nach Verzehr großer Mengen von Kohl (mit dem Glucosinolat Glucobrassicin), wie dies in Notzeiten vorkommt, zur Kropfbildung bei Mensch und Tier führen (strumigene Substanz). Dabei verdrängen die Ionen des Pseudohalogenids Thiocyanat Iodid-Ionen aus dem Schilddrüsengewebe, sodass dadurch weniger Iod für die Synthese des Schilddrüsenhormons Thyroxin zur Verfügung steht.
Für Glucosinolate und ihre Hydrolyseprodukte sowie Metaboliten wurden chemoprotektive Effekte gegen verschiedene Karzinogene nachgewiesen.[3] Sie blockieren die Tumorentstehung in einer Anzahl von Geweben und Organen wie etwa der Leber, dem Grimmdarm, den Milchdrüsen, der Bauchspeicheldrüse und anderen.[2]
Verwendung in der Medizin
Senföle (z. B. Allylsenföl) werden therapeutisch als örtlich wirkende Hautreizmittel (Rubefacientia) eingesetzt. Sie wirken teilweise stark antibakteriell.
Zubereitungen aus senfölhaltigen Pflanzen werden ebenfalls heilkundlich verwendet. Kapuzinerkresse etwa wirkt aufgrund ihres Gehaltes an Benzylsenföl bakteriostatisch (bei grampositiven und gramnegativen Bakterien sowie in vitro gegen multiresistente Staphylokokken), virustatisch (in vitro auch 90 Prozent Reduktion bei H1N1-Viren), antimykotisch und hyperämisierend.[4]
Wissenschaftlich belegt ist auch die antimikrobielle Wirkung der Senföle im Meerrettich (insbesondere gegenüber Bacillus subtilis, Escherichia coli und Staphylococcus aureus) sowie eine hyperämisierende Wirkung. Das ätherische Öl enthält Allylsenföl (ca. 90 %) und 2-Phenylethylensenföl.[4] Je nach Dosis wirkt der Meerrettich in vitro bakteriostatisch bzw. bakterizid.[5] Das Allylsenföl aus der Meerrettichwurzel zeigt eine gute Wirksamkeit im gramnegativen Spektrum, während das 2-Phenylethylsenföl aus der Meerrettichwurzel ein erweitertes Wirkspektrum im grampositiven Bereich aufweist.[6][7]
Senfölglycoside aus Kapuzinerkressenkraut und Meerrettichwurzel werden kombiniert in der Praxis als Phytotherapeutikum zur Behandlung und Prophylaxe von Atemwegs- und Harnwegsinfekten eingesetzt.
Zahlreiche In-vitro-Studien belegen, dass die Pflanzenstoffe bereits in einer geringen Dosierung eine Vielzahl von klinisch relevanten Krankheitserregern – darunter die häufigsten Erreger von Harnwegs- sowie bakteriellen Atemwegsinfektionen – bekämpfen[6][7][8][9] und auch entzündungshemmend wirken.[10][11][12] In der 2017 aktualisierten S3-Leitlinie zur Therapie von unkomplizierten Harnwegsinfektionen wird der Einsatz von Arzneimitteln mit Kapuzinerkresse und Meerrettich als pflanzliche Behandlungsmöglichkeit bei häufig wiederkehrenden Blasenentzündungen empfohlen.[13]
Untersuchungen am Institut für Medizinische Virologie der Universität Gießen haben 2010 ergeben, dass Senföle aus Kapuzinerkresse und Meerrettich die Vermehrung von Grippeviren vom Typ H1N1 hemmen können. Die Vermehrung wurde im In-vitro-Modell mit menschlichen Lungenzellen um etwa 90 Prozent gehemmt.[14] Schon 1958 wurde in wissenschaftlichen Untersuchungen am exembryonierten Hühnerei unter dem Einfluss der Senföle aus Kapuzinerkresse und Meerrettich eine starke Hemmung der Vermehrung von Influenza-Viren nachgewiesen.[15]
Vorkommen und biochemische Charakteristika

Senfölglycoside kommen in Mitteleuropa ausnahmslos in Kreuzblütlern vor. Ansonsten sind sie bei den Kaperngewächsen verbreitet, sporadisch kommen sie bei Kapuzinerkressengewächsen, Wolfsmilchgewächsen und anderen Pflanzensippen vor. Glycosinolate werden durch die Myrosinase zu Glukose, Hydrogensulfat HSO4− und einem der folgenden Aglycone gespalten: Isothiocyanat, Thiocyanat, Nitril, oder auch Oxazolidin-2-thion. Diese können in (meist nur) höheren Konzentrationen Vergiftungserscheinungen verursachen:
- Isothiocyanate (chemisch: R–N=C=S) reizen die Schleimhaut, werden jedoch meist in so geringen Mengen aufgenommen, dass keine weiteren Schäden verursacht werden. Wenn Glycosinolate aufgenommen und im Darm zu Isothiocyanaten abgebaut werden, können sie einen negativen Einfluss auf die Produktion der Schilddrüsenhormone haben.
- Oxazolidine-2-thione entstehen aus Isothiocyanaten von Glucosinolaten mit 2-Hydroxy-Seitengruppen, z. B. dem Glucosinolat Progoitrin über die Zwischenstufe des Goitrin. Oxazolidine-2-thione stören das Wachstum und erhöhen die Wahrscheinlichkeit der Kropf-Bildung (engl. 'goiter'). Sie blockieren die Schilddrüsenfunktion durch die Hemmung der Iod-Aufnahme in Thyroxin-Vorläufer und durch die Hemmung der Thyroxin-Sekretion aus der Schilddrüse.
- Nitrile (R–C=N) stören das Wachstum, verursachen Leber- und Nierenschäden, und führen in schwerwiegenden Fällen zu Lebernekrosen.
- Thiocyanate (R–S–C=N) verhindern die Iodaufnahme in die Schilddrüse, dadurch verringerte Tyrosin-Iodierung und verringerte Thyroxin-Synthese.
| Senfölglycosid | R = chemischer Rest | biosynthetisiert aus | Senföl und andere Abbauprodukte | Vorkommen |
|---|---|---|---|---|
| Sinigrin | 2-Propenyl, Allyl (CH2=CH–CH2–) | Methionin | Allylisothiocyanat | Schwarzer Senf, Meerrettich, Knoblauchsrauke, Wasabi, Broccoli, Rosenkohl, Kohl |
| Glucosinalbin | 4-Hydroxybenzyl, p-Hydroxybenzyl | Tyrosin, Phenylalanin? | 4-Hydroxybenzylisothiocyanat, 4-Hydroxybenzylnitril | Brassica-Samen[22] |
| Sinalbin | Sinapin-Salz des Glucosinalbins | Tyrosin, Phenylalanin? | 4-Hydroxybenzylisothiocyanat, 4-Hydroxybenzylnitril | Weißer Senf[22] |
| Glucotropaeolin (GTL) | Benzyl | Tyrosin, Phenylalanin? | Benzylisothiocyanat, Tropaeolin | Kapuzinerkresse, Gartenkresse, Knoblauchsrauke, Meerrettichbaum, Maca |
| Gluconasturtiin (GNAST, GST) | 2-Phenethyl, 2-Phenylethyl | Tyrosin, Phenylalanin? | Phenylethylisothiocyanat (PEITC), Nasturtiin (NAS) | Meerrettich, Brunnenkresse, Winterkresse, Broccoli, |
| Gluconapin (GNA) | 3-Butenyl (CH=CH–CH2–CH2–) | Methionin | 3-Butenylisothiocyanat, Napin | Raps, Rübsen, Chinakohl, Kohl, Hirtentäschel[22], Lesquerella fendleri[22], Lobularia maritima[22] |
| Glucoraphenin | 4-Methylsulfinyl-3-butenyl (CH3–SO–CH=CH–CH2–CH2–) | Methionin | Sulforaphen, Sulforaphennitril | Garten-Rettich, Radieschen, Matthiola longipetala[22] |
| Glucoraphanin | 4-Methylsulfinylbutyl (CH3–SO–(CH2)4–) | Methionin | Sulforaphan, Sulforaphannitril | Broccoli, Rettich, Weißkohl, Blumenkohl, Kohl, Erysimum allionii[22], Rucola[23] |
| Glucobrassicin | 3-Indolylmethyl | Tryptophan | Indol-3-carbinol, 3-Indolylmethyl-isothiocyanat, Brassicin | Kohl, Broccoli, Färberwaid, Palmkohl, (besonders roter) Blumenkohl |
| Glucocochlearin (1MP) | 1-Methylpropyl (CH3–CH2–(CH3)CH–) | Isoleucin | sec-Butyl-Isothiocyanat, Cochlearin | Echtes Löffelkraut, Wiesenschaumkraut, Wasabi, Boechera holboellii[24] |
| Glucobrassicanapin (GBN) | 4-Pentenyl (CH2=CH2–CH2–CH2–CH2–) | Methionin | Brassicanapin | Chinakohl |
| Progoitrin | (2R) -2-Hydroxy-3-butenyl (CH2=CH–CHOH–CH2–) | Methionin | Goitrin | Broccoli, Kohl, Raps, Rucola[23] |
| Epiprogoitrin | (2S)-2-Hydroxy-3-butenyl (CH2=CH–CHOH–CH2– | Methionin | Goitrin | Broccoli, Kohl, Raps, Rucola[23] |
| Gluconapoleiferin | 2-Hydroxy-4-pentenyl (CH2=CH2–CH2–CHOH–CH2–) | Methionin | Napoleiferin | |
| Glucoiberin | 3-Methylsulfinylpropyl (CH3–SO–CH2–CH2–CH2–) | Methionin | Iberin (IBN) | Schleifenblumen, Broccoli, Kohl, Lesquerella fendleri[22] |
| Glucoibeverin, Glucoiberverin (GIV) | 3-Methylthiopropyl (CH2–S–CH2–CH2–CH2–) | Methionin | Ibe(r)verin | Kohl |
| Glucocheirolin | 3-Methylsulfonylpropyl (CH3–SO2–CH2–CH2–CH2–) | Methionin | Cheirolin | Erysimum allionii, Erysimum cheiri[22] |
| Neoglucobrassicin (NGBS) | 1-Methoxy-3-indolylmethyl | Tryptophan | Winterkresse, Kohl | |
| Glucocapparin | Methyl (CH3–) | Methionin | Methyl-isothiocyanat, Capparin | Kapern, Boscia senegalensis |
| Glucolepidin | Ethyl (CH3–CH2–) | Methionin | Lepidin | Gartenkresse |
| Glucopurtanjivin, Glucoputranjivin ? | Isopropyl, 2-Propyl (CH3–(CH3)CH–) | Methionin | Purtanjivin, Putranjivin ? | Sisymbrium officinale, Tovaria[25] |
| Glucojiaputin | 2-Methylbutyl (CH3–CH2–(CH3)CH–CH2–) | Methionin | Jiaputin | |
| Glucobarbarin (BAR) | (S)-2-Hydroxy-2-phenylethyl | Tyrosin, Phenylalanin? | Barbarin | Winterkresse |
| Glucoaubrietin | p-Methoxybenzyl | Tyrosin, Phenylalanin? | Aubrietin | Aubrietia spec. |
| Glucolimnanthin | m-Methoxybenzyl | Tyrosin, Phenylalanin? | Limnanthin, 2-(3-methoxyphenyl)acetamid, 2-(3-methoxymethyl)ethanthioamid, 3-methoxyphenylacetonitril)[26] | Limnanthes alba (Limnanthaceae) |
| Glucoerucin (GER) | 4-Methylthiobutyl, 4-methylsulfanylbutyl (CH3–S–CH2–CH2–CH2–CH2–) | Methionin | Erucin, Erucinnitril | Rucola (Eruca sativa)[22], Erysimum allionii[22], Rutabaga, Kohl |
| Glucoraphasatin (Glucodehydroerucin)[27] | 4-Methylthiobut-3-enyl; 4-Methylsulfanyl-3-butenyl; vinyl-sulfid (CH3–S–CH=CH–CH2–CH2–) | Methionin | Raphasatin | Rettich |
| Glucoberteroin | 5-Methylthiopentyl (CH3–S–(CH2)5–) | Methionin | Berteroin | |
| Glucolesquerellin | 6-Methylthiohexyl (CH3–S–(CH2)6–) | Methionin | Lesquerellin | Lesquerella spec., Lobularia maritima[22] |
| Glucojirsutin, Glucoarabishirsuin | 8-Methylthiooctyl (CH3–S–(CH2)8–) | Methionin | Jirsutin | Arabis spec. |
| Glucoarabin | 9-Methylthiononyl (CH3–S–(CH2)9–) | Methionin | Arabin | Arabis spec. |
| Glucoerysolin | 4-(Methylsulfonyl)butyl (CH3–SO2–(CH2)4–) | Methionin | Erysolin | Erysimum allionii[22] |
| N-acetyl-3-indolylmethyl-GLS | N-acetyl-3-indolylmethyl | Tryptophan | Tovaria[25] | |
| Glucoalyssin | Methylsulfinylpentyl (CH3–SO–(CH2)5–) | Methionin | Alyssin | Raps, Pak Choi, Rucola[23] |
| 4-Hydroxy-Glucobrassicin | 4-OH-3-indolylmethyl | Tryptophan | 4-Hydroxy-Brassicin | Kohl |
| 4-Methoxy-Glucobrassicin | 4-Methoxy-3-indolylmethyl | Tryptophan | 4-Methoxy-Brassicin | Kohl |
| 3-(Hydroxymethyl)pentyl (CH3–CH2–(CHOH)CH–CH2–CH2–) | Methionin | Wiesenschaumkraut[28] | ||
| Glucosativin (Dimer) | 4-Mercaptobutyl | Methionin | Sativin | Rucola[23] |
| Glucohesperin | 6-Methylsulfinylhexyl | Methionin | 6-Methylsulfinylhexyl Isothiocyanat (6-MSITC) | Wasabi[29] |
| Glucoputranjivin | 1-Methylethyl (CH3–(CH3)CH–) | Valin | Boechera holboellii[24] | |
| (2MP) | 2-Methylpropyl (CH3–(CH3)CH2–CH2–) | Leucin | Boechera holboellii[24] | |
| Glucoarabidopsithalianain | 4-Hydroxybutyl | Methionin | Arabidopsithalianain | Arabidopsis thaliana, Raps |
| Glucoarabishirsutain | 7-Methylthioheptyl | Methionin | Arabishirsutain | Meerrettich |
| Glucocleomin | 2-Hydroxy-2-methylbutyl | Methionin | Cleomin | Spinnenblume |
| Glucoconringiin | 2-Hydroxy-2-methylpropyl | Methionin | Conringiin | Conringia orientalis |
| Glucoerysimumhieracifolium | 3-Hydroxypropyl | Methionin | Erysimumhieracifolium | Ruten-Schöterich |
| Glucohirsutin | 8-Methylsulfinyloctyl | Methionin | Hirsutin | Arabidopsis thaliana |
| Glucomalcomiin | 3-Benzoyloxypropyl | Methionin | Malcomiin | Carrichtera annua |
| Glucosisymbrin | 2-Hydroxy-1-methylethyl | Methionin | Sisymbrin | Sisymbrium austriacum |
Einzelnachweise
- The genetic basis of a plant–insect coevolutionarykey innovation Christopher W. Wheat et al. PNAS 18. Dezember 2007, Vol. 104 (51) Seiten20427-20431; https://doi.org/10.1073/pnas.0706229104 abgerufen am 22. Mai 2019.
- Srinibas Das, Amrish Kumar Tyagi, Harjit Kaur: Cancer modulation by glucosinolates: A review. (PDF; 67 kB) Current Science, Vol. 79, No. 12, 25. Dezember 2000, 1665–1671. Abgerufen am 11. November 2020.
- Eintrag zu Glucosinolate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 18. Juni 2013.
- Heinz Schilcher (Hrsg.): Leitfaden Phytotherapie, Verlag Urban & Fischer, München 2016, S. 178–180; 220–221.
- A. Winter: Antibiotische Therapie mit Arzneipflanzen. In: Planta Medica. Band 3, Nr. 01, 15. Januar 1955, S. 1–16, doi:10.1055/s-0028-1101750.
- Andreas Conrad, Teena Kolberg, Inge Engels, Uwe Frank: In-vitro-Untersuchungen zur antibakteriellen Wirksamkeit einer Kombination aus Kapuzinerkressenkraut (Tropaeoli majoris herba) und Meerrettichwurzel (Armoraciae rusticanae radix). In: Arzneimittel-Forschung. Band 56, Nr. 12, S. 842–849.
- A Conrad, H Richter, D Bauer, T Nobis, I Engels, U Frank: Breite antibakterielle Wirkung einer Mischung von Senfölen in vitro. In: Zeitschrift für Phytotherapie. Band 29, S 1, 2008, doi:10.1055/s-2008-1047852.
- V. Dufour et al.: The antibacterial properties of isothiocyanates. In: Microbiology 161: 229–243 (2015).
- A. Borges et al.: Antibacterial activity and mode of action of selected glucosinolates hydrolysis products against bacterial pathogens. In: J Food Sci Technol 52 (8): 4737–4748 (2015).
- A. Marzocco et al.: Anti-inflammatory activity of horseradisch (Armoracia rusticana) root extracts in LPS-stimulated macrophages. In: Food Func. 6 (12): 3778-88 (2015)
- H. Tran et al.: Nasturtium (Indian cress, Tropaeolum majus nanum) dually blocks the COX an LOX pathway in primary human immune cells. In: Phytomedicine 23: 611–620 (2016).
- M. L. Lee et al.: Benzyl isothiocyanate exhibits anti-inflammatory effects in murine macrophages and in mouse skin. In: J Mol Med 87: 1251–1261 (2009).
- S3-Leitlinie unkomplizierte Harnwegsinfektion – Update 2017 (Interdisziplinäre S3 Leitlinie „Epidemiologie, Diagnostik, Therapie, Prävention und Management unkomplizierter, bakterieller, ambulant erworbener Harnwegsinfektionen bei erwachsenen Patienten“, AWMF-Register-Nr. 043/044).
- Werner Stingl: Influenza-Viren mit Phytotherapie bekämpfen. In: Ärzte Zeitung, 16. Dezember 2010.
- Winter, A.G., Willeke, L.: Untersuchungen über den Einfluss von Senfölen auf die Vermehrung des Influenza-Virus im exembryonierten Hühnerei, Arch. Mikrobiol. 31, S. 311–318 (1958).
- Jihad Attieh Biochemical characterization of a novel halide/bisulfide methyltransferase purified from Brassica oleracea
- Genyi Li, Carlos F. Quiros: Genetic Analysis, Expression and Molecular Characterization of BoGSL-ELONG, a Major Gene Involved in the Aliphatic Glucosinolate Pathway of Brassica Species. In: Genetics. Band 162, Nr. 4, 1. Dezember 2002, S. 1937–1943.
- Patent US6716827: Complexes for immobilizing isothiocyanate natural precursors in cyclodextrins, preparation and use.
- Complexes Isothiocyanates from Cruciferous Vegetables: Kinetics, Biomarkers and Effects.
- Patrick Kabouw, Arjen Biere, Wim H. van der Putten, Nicole M. van Dam: Intra-specific Differences in Root and Shoot Glucosinolate Profiles among White Cabbage (Brassica oleracea var. capitata) Cultivars. In: Journal of Agricultural and Food Chemistry. Band 58, Nr. 1, 13. Januar 2010, S. 411–417, doi:10.1021/jf902835k.
- Barbara Kusznierewicz, Renato Iori, Anna Piekarska, Jacek Namieśnik, Agnieszka Bartoszek: Convenient identification of desulfoglucosinolates on the basis of mass spectra obtained during liquid chromatography–diode array–electrospray ionisation mass spectrometry analysis: Method verification for sprouts of different Brassicaceae species extracts. In: Journal of Chromatography A. Band 1278, 22. Februar 2013, S. 108–115, doi:10.1016/j.chroma.2012.12.075.
- Steven F. Vaughn, Mark A. Berhow: Glucosinolate hydrolysis products from various plant sources: pH effects, isolation, and purification. In: Industrial Crops and Products. Band 21, Nr. 2, März 2005, S. 193–202, doi:10.1016/j.indcrop.2004.03.004.
- Federica Pasini, Vito Verardo, Lorenzo Cerretani, Maria Fiorenza Caboni, Luigi Filippo D’Antuono: Rocket salad (Diplotaxis and Eruca spp.) sensory analysis and relation with glucosinolate and phenolic content. In: Journal of the Science of Food and Agriculture. Band 91, Nr. 15, Dezember 2011, S. 2858–2864, doi:10.1002/jsfa.4535.
- Aaron J. Windsor u. a.: Geographic and evolutionary diversification of glucosinolates among near relatives of Arabidopsis thaliana (Brassicaceae). In: Phytochemistry. Band 66, Nr. 11, Juni 2005, S. 1321–1333, doi:10.1016/j.phytochem.2005.04.016.
- Flowering plants, Dicotyledons: Malvales, Capparales, and non-betalain Caryophyllales. In: The Families and genera of vascular plants. Springer, Berlin ; New York 2003, ISBN 3-540-42873-9 (eingeschränkte Vorschau in der Google-Buchsuche).
- Inga A. Zasada, Jerry E. Weiland, Ralph L. Reed, Jan F. Stevens: Activity of Meadowfoam (Limnanthes alba) Seed Meal Glucolimnanthin Degradation Products against Soilborne Pathogens. In: Journal of Agricultural and Food Chemistry. Band 60, Nr. 1, 11. Januar 2012, S. 339–345, doi:10.1021/jf203913p.
- Sabine Montaut, Jessica Barillari, Renato Iori, Patrick Rollin: Glucoraphasatin: Chemistry, occurrence, and biological properties. In: Phytochemistry. Band 71, Nr. 1, Januar 2010, S. 6–12, doi:10.1016/j.phytochem.2009.09.021.
- Niels Agerbirk, Carl Erik Olsen, Frances S. Chew, Marian Ørgaard: Variable Glucosinolate Profiles of Cardamine pratensis (Brassicaceae) with Equal Chromosome Numbers. In: Journal of Agricultural and Food Chemistry. Band 58, Nr. 8, 28. April 2010, S. 4693–4700, doi:10.1021/jf904362m.
- De-Xing Hou u. a.: Dynamics of Nrf2 and Keap1 in ARE-Mediated NQO1 Expression by Wasabi 6-(Methylsulfinyl)hexyl Isothiocyanate. In: Journal of Agricultural and Food Chemistry. Band 59, Nr. 22, 23. November 2011, S. 11975–11982, doi:10.1021/jf2032439.
Literatur
- W. Franke: Nutzpflanzenkunde. Thieme, Stuttgart 1997.
- D. Frohne u. U. Jensen: Systematik des Pflanzenreichs. Fischer, Stuttgart 1985.
- O. Gessner u. G. Orzechowski: Gift- und Arzneipflanzen von Mitteleuropa. Winter, Heidelberg 1974.
- Lexikon der Biologie. Herder, Freiburg 1994.
- F. Hoffmann: Senföle, in: Chemie in unserer Zeit 1978, 12, 182–188; doi:10.1002/ciuz.19780120603.