Selenoaldehyde
Selenoaldehyde sind organische, chemische Verbindungen. Sie stellen die Selen-Analoga von Aldehyden und Thioaldehyden dar und gehören zu den Selenocarbonylverbindungen.[1]
| Selenoaldehyde |
|---|
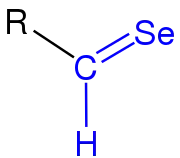 |
| Die Selenocarbonylgruppe ist blau markiert. R = H, organischer Rest (Alkyl, Aryl o. ä.). |
In ihrer funktionellen Gruppe ist das Sauerstoffatom durch ein Selenatom ersetzt. Dieses ist durch eine Doppelbindung an das Kohlenstoff gebunden, welches zusätzlich ein Wasserstoffatom bindet. Selenoaldehyde sind reaktiv und ähneln in ihren Eigenschaften den Thioaldehyden, sind jedoch instabiler. Sie können jedoch thermodynamisch oder kinetisch stabilisiert werden.[2] Selenhaltige, organische Verbindungen sind oft toxisch, wodurch ihre Erforschung erschwert wurde. Die praktische Bedeutung von Selenoaldehyden ist gering, allerdings werden sie aufgrund ihrer Reaktivität als Intermediate in organischen Synthesen eingesetzt.[3]
Eigenschaften
Analog zu Thioaldehyden polymerisieren und trimerisieren Selenoaldehyde leicht zu 1,3,5-Triselanen. Das Trimer von Selenoacetaldehyd kann in der α-Form oder in der β-Form auftreten:
| Isomerie von Triselanen (hier 2,4,6-Trimethyl-1,3,5-triselanen) | |
|---|---|
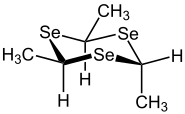 α-Form | 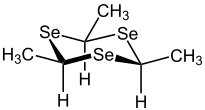 β-Form |
Die α-Form wird aus sterischen Gründen bevorzugt gebildet, kann jedoch durch eine Umsätzug mit Silbernitrat und Ammoniak in die β-Form überführt werden. Monomere Selenoaldehyde können durch heteroaromatische Substituenten oder durch konjugierte, mesomere Systeme stabilisiert werden, wobei das Selenatom durch Mesomerie in die Ringstruktur einbezogen werden kann.[1]
Synthese
Selenoaldehyde können aus Aldehyden gewonnen werden. Wenn z. B. Acetaldehyd mit Selenwasserstoff und Salzsäure zur Reaktion gebracht wird, entsteht unter Wasserabspaltung Selenoacetaldehyd.[4] Dieses ist instabil und kann z. B. als Diels-Alder-Addukt mit Cyclopentadien isoliert werden.[5][6]
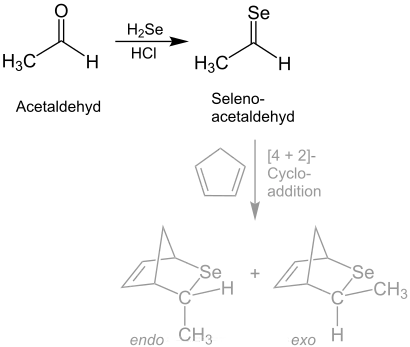
Die daraus resultierenden Heterocyclen sind sehr reaktiv. Sie werden z. B. zur Einführung von Selenatomen in organische Moleküle eingesetzt.[7] Cycloadditionen von substituierten Selenoaldehyden können regioselektiv gesteuert werden.[8] Cycloadditionen dieser Art können ebenfalls intramolekular erfolgen.[9] Die Wittig-Reaktion mit elementarem Selen führt ebenfalls zu Selenoaldehyden.[10] Heteroaromatische Selenoaldehyde können durch die Vilsmeier-Haack-Reaktion und anschließender Behandlung mit Natriumselenid synthetisiert werden.[1] Aktuelle Arbeiten formulieren die Synthese von Selenoaldehyden (2) durch die Eigenkondensation von sterisch anspruchsvollen Selenanaloga von arylsubstituierten Sulfensäuren (1), welche autokatalytisch abläuft:[11]
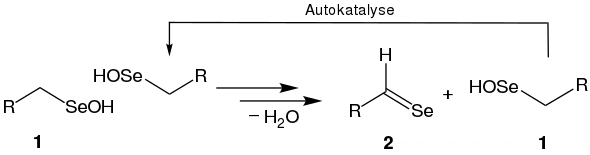
Darüber hinaus lassen sich Selenocarbonylverbindungen mit dem Woollins’ Reagenz herstellen, welches die selenhaltige, analoge Verbindung zum Lawessons Reagenz darstellt.[12]
Reaktionen
Selenoaldehyde reagieren als Dienophile in Diels-Alder-Reaktionen.[13] Darüber hinaus können sie als Edukte in der Diselenidsynthese fungieren.[1] Selenoaldehyde reagieren aufgrund ihrer Reaktivität zu Trimeren sowie zu Polymeren.[3][14]

Siehe auch
Einzelnachweise
- Paulmier, C. (1986): Selenium Reagents and Intermediates in Organic Synthesis. 4. Band. Oxford: Pergamon Books. S. 58–63, ISBN 0-08-032484-3.
- Okazaki, R., Kumon, N. & Inamoto, N.: 2, 4, 6-Tri-tert-butylselenobenzaldehyde, the first stable seleno aldehyde. Journal of the American Chemical Society, 1989, 111(15), S. 5949–5951, .
- Guzirc, F.S. (1987): The Chemistry of Selencarbonylcompounds. In Liotta, D. (Ed.): Organoselenium Chemistry. New York: Wiley. S. 277–324, ISBN 0-471-88867-2.
- Schönberg, A. & Wagner, A. (1955): Methoden zur Herstellung und Umwandlung von Thioaldehyden und Thioketonen. In Müller, E. (Hrsg.): Methoden der Organischen Chemie. Band IX: Schwefel-, Selen-, Tellurverbindungen. Stuttgart: Thieme Verlag. S. 1195–1199.
- Meinke, P. T., & Krafft, G. A.: Synthesis and cycloaddition reactivity of selenoaldehydes. Journal of the American Chemical Society, 1988, 110(26), S. 8671–8679, doi:10.1021/ja00234a015.
- Mikolajczyk, M., Drabowicz, J. & Kiełasiński, P. (1995): Formation of C-Se and C-Te Bonds. In Helmchen, G. et al. (Herausgeber.): Methods of Organic Chemistry: Stereoselective Synthesis. Band E21e, Stuttgart: Thieme, S. 5083–5132, ISBN 3-13-100124-0.
- Degl'Innocenti, A. et al.: Silicon-Mediated Synthesis of Selenoaldehydes and Selenoacylsilanes and Their Hetero Diels–Alder Reactions. Phosphorus, Sulfur, and Silicon and the Related Elements, 2009, 184(6), S. 1621–1626, doi:10.1080/10426500902947989.
- Meinke, P. T., & Krafft, G. A.: Regiochemical preferences in selenoaldehyde cycloadditions. Tetrahedron, 1987, 28(43), S. 5121–5124, doi:10.1016/S0040-4039(00)95607-7.
- Segi, M. et al.: Intramolecular Diels-Alder reaction of selenoaldehydes. Tetrahedron, 1988, 29(52), S. 6965–6968, doi:10.1016/S0040-4039(00)88488-9.
- Okuma, K. et al.: The Reaction of Wittig Reagents with Selenium. Formation of Selenoaldehydes. Bulletin of the Chemical Society of Japan, 1990, 63(6), S. 1653–1657, doi:10.1246/bcsj.63.1653.
- Sase, S., Kakimoto, R. & Goto, K.: Synthesis of a Stable Selenoaldehyde by Self‐Catalyzed Thermal Dehydration of a Primary‐Alkyl‐Substituted Selenenic Acid, Angewandte Chemie International Edition, 2015, 54(3), S. 901–904, doi:10.1002/anie.201409485.
- Hua, G., & Woollins, J. D.: Synthese und Reaktivität von Phosphor‐Selen‐Ringen. Angewandte Chemie, 2009, 121(8), S. 1394–1403, doi:10.1002/ange.200800572.
- Li, G. M., Segi, M., & Nakajima, T.: α, β-Unsaturated selenoaldehydes and selenoketones the reaction behavior as a heterodiene and/or a dienophile. Tetrahedron, 1992, 33(24), S. 3515–3518, doi:10.1016/S0040-4039(00)92677-7.
- Krafft, G. A., & Meinke, P. T.: Selenoaldehydes: preparation and dienophilic reactivity. Journal of the American Chemical Society, 1986, 108(6), S. 1314–1315, doi:10.1021/ja00266a041.