Coproporphyrinogen-Oxidase
Coproporphyrinogen-Oxidase (CPOX) ist das Enzym, das die Oxidation von Coproporphyrinogen III zu Protoporphyrinogen IX katalysiert, eine Teilreaktion bei der Biosynthese der Porphyrine, die in allen Lebewesen stattfindet. In Eukaryoten wird vorher das Substrat aus dem Zytosol in den Raum zwischen der inneren und äußeren Membran der Mitochondrien transportiert, der beteiligte Transporter ist noch unbekannt. Beim Menschen können Mutationen am CPOX-Gen zu CPOX-Mangel und damit zu hereditärer Koproporphyrie führen.[1][2]
| Coproporphyrinogen-Oxidase | ||
|---|---|---|
 | ||
|
Vorhandene Strukturdaten: 2aex | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 344 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Bezeichner | ||
| Gen-Namen | CPOX CPO; CPX; HCP | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.3.3.3, Oxidoreduktase | |
| Reaktionsart | Oxidative Decarboxylierung | |
| Substrat | Coproporphyrinogen III + O2 + 2 H+ | |
| Produkte | Protoporphyrinogen IX + 2 CO2 + 2 H2O | |
| Vorkommen | ||
| Homologie-Familie | CPOX | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 1371 | 12892 |
| Ensembl | ENSG00000080819 | ENSMUSG00000022742 |
| UniProt | P36551 | P36552 |
| Refseq (mRNA) | NM_000097 | NM_007757 |
| Refseq (Protein) | NP_000088 | NP_031783 |
| Genlocus | Chr 3: 98.52 – 98.59 Mb | Chr 16: 58.67 – 58.68 Mb |
| PubMed-Suche | 1371 | 12892 |
Katalysierte Reaktion
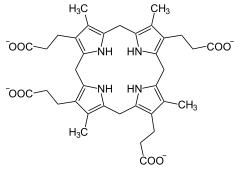 + O2 + 2 H+ ⇒
+ O2 + 2 H+ ⇒
⇒  + 2 CO2 + 2 H2O
+ 2 CO2 + 2 H2O
Coproporphyrinogen III wird zu Protoporphyrinogen IX oxidiert, mit gleichzeitiger Kohlenstoffdioxid-Abspaltung. Es finden hintereinander zwei oxidative Decarboxylierungen statt. Das Enzym benötigt beim Menschen keine Metallionen als Cofaktor.[3][4][5]
Weblinks
- OMA: CPOX Homologe
- Jassal, D'Eustachio / reactome: Conversion of coproporphyrinogen III to protoporphyrinogen IX
Einzelnachweise
- UniProt P36551
- Jassal, D'Eustachio / reactome: Translocation of coproporphyrinogen III from the cytosol to the mitochondrial intermembrane space
- Martásek P, Camadro JM, Raman CS, et al.: Human coproporphyrinogen oxidase. Biochemical characterization of recombinant normal and R231W mutated enzymes expressed in E. coli as soluble, catalytically active homodimers. In: Cell. Mol. Biol. (Noisy-le-grand). 43, Nr. 1, Februar 1997, S. 47–58. PMID 9074788.
- Medlock AE, Dailey HA: Human coproporphyrinogen oxidase is not a metalloprotein. In: J. Biol. Chem.. 271, Nr. 51, Dezember 1996, S. 32507–10. PMID 8955072.
- Stephenson JR, Stacey JA, Morgenthaler JB, Friesen JA, Lash TD, Jones MA: Role of aspartate 400, arginine 262, and arginine 401 in the catalytic mechanism of human coproporphyrinogen oxidase. In: Protein Sci.. 16, Nr. 3, März 2007, S. 401–10. doi:10.1110/ps.062636907. PMID 17242372. PMC 2203308 (freier Volltext).