Meisenheimer-Komplex
Als Meisenheimer-Komplexe werden in der organischen Chemie im engeren Sinn Addukte aromatischer Nitroverbindungen mit Nukleophilen bezeichnet. Man nennt sie auch Meisenheimer-Salze.
Entdeckung
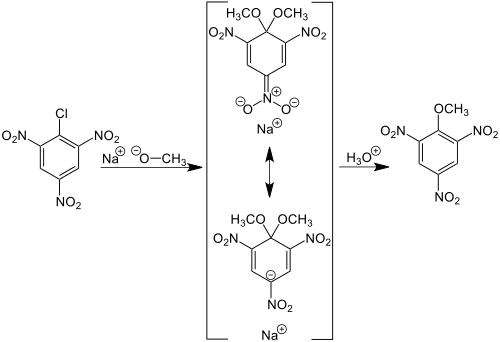
Charles Loring Jackson und W. F. Boos (Harvard College; USA) entdeckten Ende des 19. Jahrhunderts, dass bei der Einwirkung von Natriumalkoholaten auf das fast farblose 2,4,6-Trinitrochlorbenzol (Pikrylchlorid) rote Salze entstehen. Mit Natriummethanolat/Methanol erhielten sie eine Verbindung, für welche sie die in der Mitte des Formelschemas gezeigte Konstitutionsformel vorschlugen.[1][2] Ihr deutscher Name sollte 3.5-Dinitro-4.4-dimethoxy-chinolnitrosaures Natrium sein.[3] Versetzte man das Salz mit verdünnter Mineralsäure, wurde 2,4,6-Trinitroanisol (rechte Formel) gebildet:
Vermutlich hatten die Forscher erwartet, dass durch Austausch des Chlorsubstituenten des Pikrylchlorids gegen den Methoxyrest gleich 2,4,6-Trinitroanisol („Methylpikrat“) entstehen würde.
Im Chemischen Laboratorium der Königlichen Akademie der Wissenschaften zu München untersuchte Jakob Meisenheimer zu Beginn des 20. Jahrhunderts Reaktionen aromatischer Nitroverbindungen. Unter anderem stellte er die vermuteten Alkylpikrate her, indem er Alkyliodide mit dem Silbersalz der Pikrinsäure reagieren ließ. Im Jahre 1902 teilte er mit, dass bei der Umsetzung von Alkylpikraten mit „alkoholischem Kali“ Salze entstehen, die durch ihre tiefrote Farbe auffallen.[4] Meisenheimer konnte die noch jetzt gültige Konstitution bestätigen. In heutiger Sprache sind Alkylpikrate 1-Alkoxy-2,4,6-trinitrobenzole, „alkoholisches Kali“ eine Lösung von Kaliumhydroxid in dem entsprechenden Alkohol.
Für diese Erkenntnis war entscheidend, dass dasselbe Salz sowohl aus Methylpikrat und Kaliumethoxid als auch aus Ethylpikrat und Kaliummethoxid entstand:
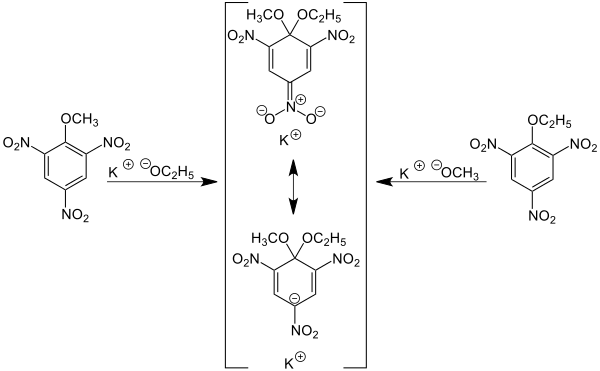 Ein Meisenheimer-Salz
Ein Meisenheimer-Salz
Die „Meisenheimer-Salze“ zersetzten sich, wenn man verdünnte wässrige Schwefelsäure zugab. Dabei entstand aus dem „Ethoxy-methoxy-Salz“ sowohl Ethylpikrat als auch Methylpikrat, in Einklang mit Meisenheimers bzw. Jacksons Konstitutionsformel.
Struktur
Was die Struktur der Salze betrifft, kam der Vorschlag von Jackson und Meisenheimer der Realität sehr nahe. Zwar erwarten wir heute, dass die negative Ladung delokalisiert ist (Formel unten links), Meisenheimer wählte jedoch die Formel eines Nitronats. Eine Röntgenstrukturanalyse des „1,1-Dimethoxy-Komplexes“ zeigte, dass die Bindung C-4/NO2 gegenüber C-2 bzw. C-6 und dem Nitrostickstoff deutlich verkürzt ist.[5]
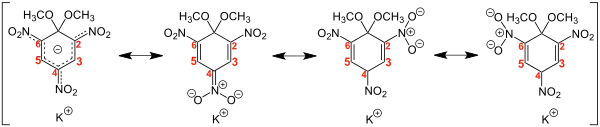 Meisenheimer-Salz – mesomere Grenzstrukturen
Meisenheimer-Salz – mesomere Grenzstrukturen
Die Bindung zwischen C-2 und C-3 bzw. C-5 und C-6 sind kürzer als die Bindungen C-3/C-4 bzw. C-4/C-5. Dies zeigt, dass die Nitrogruppe in der Position 4 am Ring den größten Teil der negativen Ladung übernimmt, im Sinne der zweiten Grenzstrukturformel von links in der obigen Abbildung. Quantenchemische Rechnungen (SCF-Methode) stimmen mit dem Ergebnis der Röntgenstrukturanalyse gut überein.[6]
Die beim SNAr-Mechanismus auftretenden Zwischenstufen (Intermediate) mit tetragonalem (sp3-hybridisierten) Kohlenstoffatom werden bisweilen als Meisenheimer-Komplexe im weiteren Sinn bezeichnet. Nach der Entdeckungsgeschichte wäre es gerechtfertigt, auch den amerikanischen Chemiker zu nennen, d. h. von Jackson-Meisenheimer-Komplexen zu sprechen.[7]
Bedeutung
Die Entdeckung regte weitere Untersuchungen an benzoiden Verbindungen mit Akzeptor-Substituenten an. Sie gipfelten schließlich in der Erkenntnis, dass Verbindungen dieses Typs nach einem nukleophilen Assoziations/Dissoziations-Mechanismus (auch Additions-Eliminierungs-Mechanismus – SNAr genannt) reagieren können, wie im Artikel Nukleophile aromatische Substitution abgehandelt wird. So lässt sich z. B. 2,4,6-Trinitrochlorbenzol mit zahlreichen Nukleophilen umsetzen.
Janovsky-Reaktion
Bei der Janovsky-Reaktion handelt es sich um eine Nachweisreaktion für Nitroaromate, bei der durch Zugabe von Aldehyden oder Ketonen ein farbiger Komplex entsteht. Sie wurde 1886 von Jaroslav Janovsky und L. Erb entdeckt und erwähnt.[8] Durch eine starke Base (z. B. Kalilauge) wird das Keton deprotoniert. Nun greift das freie Elektronenpaar am 1,3-Dinitroaromaten an.
Die Abbildung zeigt den postulierten Ablauf der Reaktion am Beispiel von Aceton und 1,3-Dinitrobenzol:[8]
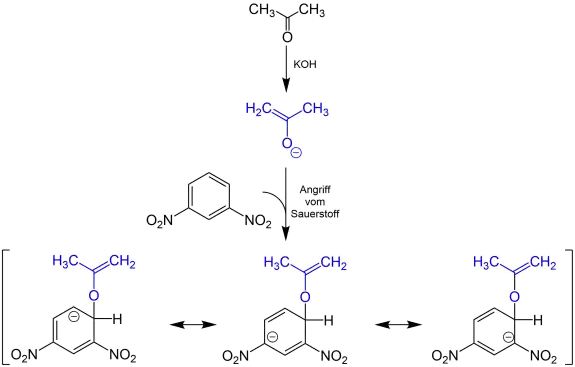 Bei −40 °C und kälter greift hauptsächlich das Sauerstoffatom des Enolats an.
Bei −40 °C und kälter greift hauptsächlich das Sauerstoffatom des Enolats an.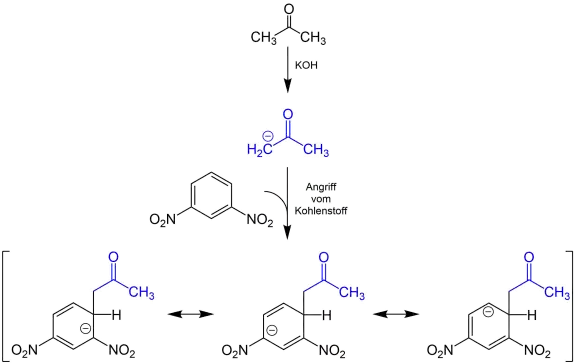 Ab −20 °C und wärmer greift hauptsächlich das Kohlenstoffatom des Enolats an.
Ab −20 °C und wärmer greift hauptsächlich das Kohlenstoffatom des Enolats an.
Einzelnachweise
- C. L. Jackson und W. F. Boos, American Chemical Journal 20, S. 444–447 (1898).
- C. Loring Jackson and W. F. Boos, On the Colored Compounds Obtained from Sodic Alcoholates and Picrylchloride, Proceedings of the American Academy of Arts and Sciences Vol. 33, No. 10 (Jan., 1898), S. 173–182. JSTOR 20020770
- Beilsteins Handbuch der Organischen Chemie, Hauptwerk, Bd. 5, S. 273.
- Jakob Meisenheimer: Ueber Reactionen aromatischer Nitrokörper. In: Justus Liebigs Annalen der Chemie. Band 323, Nr. 2, 1902, S. 205–246, doi:10.1002/jlac.19023230205. insbesondere S. 241–246.
- H. Ueda, N. Sakabe, J. Tanaka, A. Furusaki, Bull. Chem. Soc. Japan 41, 2866 (1968).
- H. Hosoya, S. Hosoya, S. Nagakura, Theoret. Chim. Acta 12, 117 (1968).
- Siegfried Hauptmann, Organische Chemie, 1. Aufl., S. 302, Verlag Harri Deutsch, Thun-Frankfurt a. M., 1985. ISBN 3-87144-902-4.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 1442–1445.