Parabaseester
Parabaseester oder 2-[(4-Aminophenyl)sulfonyl]ethylhydrogensulfat (IUPAC) ist ein industrielles Zwischenprodukt zur Synthese von organischen, wasserlöslichen Reaktivfarbstoffen. Das Anilin-Derivat enthält mit dem Sulfonylethylhydrogensulfat-Substituenten eine funktionelle Gruppe, die unter alkalischen Färbebedingungen Schwefelsäure abspaltet. Die dadurch gebildete reaktionsfähige Vinylsulfongruppe (VS-Gruppe) geht mit den funktionellen Gruppen der Cellulosefasern eine kovalente Bindung ein. Parabaseester ist das mengenmäßig bedeutendste Zwischenprodukt für Reaktivfarbstoffe mit diesem Reaktionsprinzip (Vinylsulfonfarbstoffe, bzw. VS-Farbstoffe).[4]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
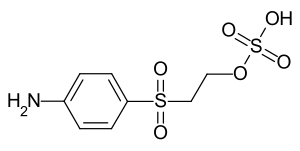 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Parabaseester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H11NO6S2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser bis hellgrauer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 281,3 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt |
> 248 °C (Zersetzung)[1] | ||||||||||||||||||
| Löslichkeit |
wenig löslich in DMSO und heißen Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Herstellung
Ausgehend von Anilin ist Parabaseester (6) in einer fünfstufigen Synthese zugänglich:
.svg.png.webp)
Zum Schutz der Aminogruppe wird zunächst Anilin (1) mit Acetanhydrid in das Acetanilid (2) überführt. Anschließend wird durch eine Chlorsulfonierung mit Chlorschwefelsäure und Thionylchlorid eine Chlorsufonylgruppe eingeführt (3). Durch Reduktion mit Natriumsulfit erhält man das p-Acetanilidsulfinat (4). Im nächsten Schritt wird durch eine Ethoxylierung das Sulfinat in 2-[(4-Aminophenyl)sulfonyl]ethanol (5) (N-Acetyl-Parabase) überführt. Dann wird mit Schwefelsäure verestert, wobei gleichzeitig die Acetyl-Schutzgruppe abgespalten wird.[5][6]
Bei einem alternativen Syntheseverfahren wird 4-Chlornitrobenzol (1) mit Mercaptoethanol (2) und Natriumhydroxid zu einem Thioether (3) umgesetzt, der anschließend mit Wasserstoffperoxid in Gegenwart von Natriumwolframat zu 2-[(4-Nitrophenyl)sulfonyl]ethanol (4) oxidiert wird. Anschließend wird die Nitrogruppe katalytisch zur Aminogruppe hydriert und das 2-[(4-Aminophenyl)sulfonyl]ethanol[7] (5) wird im letzten Schritt mit Schwefelsäure zur Zielverbindung (6) verestert.[8]
.svg.png.webp)
Verwendung
Parabaseester wird als Diazokomponente bei der Herstellung verschiedener Azofarbstoffe eingesetzt. Bei dem weltweit mengenmäßig größten Reaktivfarbstoff C.I. Reactive Black 5 erfolgt dabei die Umsetzung mit der Kupplungskomponente H-Säure.
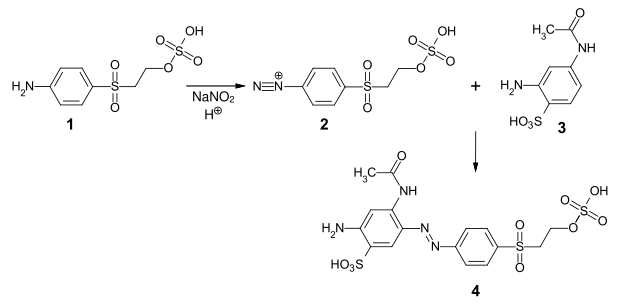
Ein weiteres Beispiel ist die Herstellung des Reaktivfarbstoffs Reactive Orange 107 (4) durch Diazotierung von Parabaseester (2) und Kupplung mit 4-Acetamido-2-aminobenzolsulfonsäure[9] (3):[10]
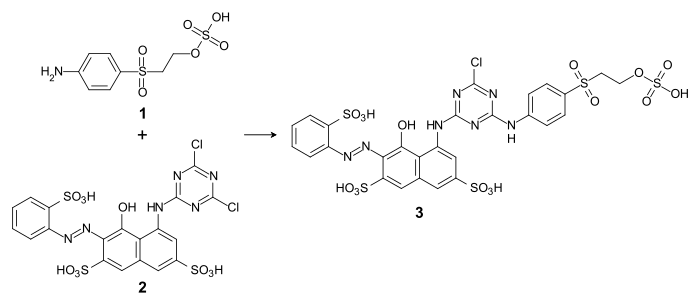
Als aromatisches Amin reagiert Parabaseester mit Halogentriazin-Derivaten (Cyanurchlorid oder Cyanurfluorid, bzw. den entsprechenden Dichlor- oder Difluor-Verbindungen) unter Substitution des Halogens. So erhält man beispielsweise durch Umsetzung von Parabaseester (1) mit dem Dichlortriazinylfarbstoff C.I. Reactive Red 1 (2), den bifunktionellen Reaktivfarbstoff C.I. Reactive Red 227[11] (3):[12]
Einzelnachweise
- Eintrag zu 4-(Ethylsulfurate Sulfonyl)aniline bei Toronto Research Chemicals, abgerufen am 19. Januar 2022 (PDF).
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 2-[(p-aminophenyl)sulphonyl]ethyl hydrogensulphate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 20. Oktober 2018.
- Registrierungsdossier zu 2-[(p-aminophenyl)sulphonyl]ethyl hydrogensulphate (Abschnitt GHS) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 22. Oktober 2018.
- E. Siegel: Reactive Dyes: Reactive Groups. In: K. Venkataraman (Hrsg.): The Chemistry of Synthetic Dyes. Volume VI. Academic Press, New York and London 1972, S. 36 ff.
- Astrid Rehorek, Alexander Plum, Marion Senholdt, Barbara Gornacka, Csilla Györgyicze, Betül Yildiz, Johannes Malov: Forschungsprojekt zur Verbesserung des Abbaus von Textilabwässern in einem anaerob/aeroben Reaktor zur Vorbehandlung von Abwasserkonzentraten. Fachhochschule Köln, Köln 2006, ISBN 978-3-00-019432-0, S. 113 (nrw.de [PDF]).
- Patent DE19540544: Verfahren zur Herstellung von p-chloranilinfreiem Parabaseester. Angemeldet am 31. Oktober 1995, veröffentlicht am 7. Mai 1997, Anmelder: Dystar Textilfarben GmbH and Co Deutschland KG, Erfinder: Klaus Saitmacher.
- Externe Identifikatoren von bzw. Datenbank-Links zu 2-[(4-Aminophenyl)sulfonyl]ethanol: CAS-Nummer: 5246-58-2, EG-Nummer: 226-047-9, ECHA-InfoCard: 100.023.680, PubChem: 78906, ChemSpider: 71241, Wikidata: Q83073565.
- Patent US4612394: Process for producing aminophenyl-β-hydroxyethylsulfone. Angemeldet am 21. März 1983, veröffentlicht am 16. September 1986, Anmelder: Sumitomo Chemical Co, Erfinder: Goto Kunihisa, Kaneoya Tatsuo, Kotera Norio, Masaki Shinzaburo, Tada Kazuhiro.
- Externe Identifikatoren von bzw. Datenbank-Links zu 4-Acetamido-2-aminobenzolsulfonsäure: CAS-Nummer: 88-64-2, EG-Nummer: 201-847-0, ECHA-InfoCard: 100.001.679, GESTIS-Stoffdatenbank: 25180, PubChem: 6939, ChemSpider: 6673, Wikidata: Q72433978.
- Patent DE10005550: Production of azo dyes and pigments. Angemeldet am 23. August 2001, Anmelder: Clariant Produkte (Deutschland) GmbH., Beispiel 3 (Wasserlösliche Reaktivfarbstoffe/Reactive Orange 107).
- Externe Identifikatoren von bzw. Datenbank-Links zu Reactive Red 227: CAS-Nummer: 23354-53-2, EG-Nummer: 607-222-2, ECHA-InfoCard: 100.133.397, PubChem: 101609332, ChemSpider: 58177966, Wikidata: Q73383968.
- Heinrich Zollinger: Color Chemistry. 3., überarbeitete Auflage. Wiley-VCH, Weinheim 2003, ISBN 3-906390-23-3, S. 225 ff.
