Nintedanib
Nintedanib (Handelsnamen: Vargatef, Ofev) ist ein Tyrosinkinase-Inhibitor und Angiokinasehemmer, der die Rezeptoren für den Vascular Endothelial Growth Factor (VEGF), den Fibroblasten-Wachstumsfaktor (FGF) und den Platelet-Derived Growth Factor (PDGF) blockiert. Der Wirkstoff hemmt die Bildung neuer Blutgefäße bei der Versorgung von Tumoren (Tumorangiogenese).[4][5] Nintedanib wurde bei Boehringer Ingelheim entwickelt und 2004 zum Patent angemeldet.[6]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
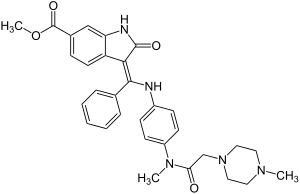 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Nintedanib | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C31H33N5O4 | |||||||||||||||||||||
| Kurzbeschreibung |
gelber Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
löslich in DMSO[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Eigenschaften
Nintedanib ist wirksam gegen Bronchialkarzinome und Lungenfibrosen. Die EU-weite Arzneimittelzulassung zur Behandlung des fortgeschrittenen nichtkleinzelligen Bronchialkarzinoms (NSCLC) in Kombination mit Docetaxel wurde im Oktober 2013[7] und zur Behandlung der idiopathischen pulmonalen Fibrose im Juni 2014[8] beantragt.
Mittlerweile hat die Europäische Kommission Nintedanib zur Behandlung einer interstitiellen Lungenerkrankung bei Erwachsenen mit systemischer Sklerose (SSc-ILD) zugelassen. Für diese Indikation ist es aktuell (08/2020) das einzige zugelassene Medikament.[9]
Des Weiteren besteht zusätzlich die Zulassung für andere chronische progredient fibrosierende interstitielle Lungenerkrankungen (ILDs) z. B. Überempfindlichkeitspneumonitis (exogen-allergische Alveolitis), autoimmune ILDs wie ILD bei rheumatoider Arthritis und idiopathische unspezifische interstitielle Pneumonie.[10]
Das Ethansulfonsäuresalz des Nintedanibs (Nintedanibesilat) ist ein gelber, kristalliner Feststoff mit einem Schmelzpunkt von 244 bis 251 °C, das in Wasser sehr schlecht und in DMSO wenig löslich (25 g·l−1) ist.[11]
Im Zuge der Anwendung bei fortgeschrittenem nicht-kleinzelligen Lungenkarzinom wird an den Tagen 2 bis 21 eines 21-tägigen Standardbehandlungszyklus mit Docetaxel eine Dosis von 200 mg Nintedanib zweimal täglich im Abstand von ca. 12 Stunden empfohlen. Die Einnahme der Vargatef-Weichkapseln soll oral, unzerkaut, zur Mahlzeit und mit Wasser erfolgen. Die empfohlene maximale Tagesdosis beträgt 400 mg und sollte nicht überschritten werden. Patienten können die Therapie mit Nintedanib nach Absetzen von Docetaxel fortsetzen, solange ein klinischer Nutzen beobachtet wird oder bis eine inakzeptable Toxizität auftritt.[12]
Im Rahmen einer Anwendung bei idiopathischer Lungenfibrose werden zweimal täglich 150 mg Ofev-Kapseln, unzerkaut mit reichlich Wasser empfohlen. Die Einnahmen sollen mit 12-stündigem Abstand zueinander und mit dem Essen erfolgen.[13]
Gegenanzeigen (Kontraindikationen)
Liegt eine Überempfindlichkeit gegen den Wirkstoff selbst oder Bestandteile seiner Darreichungsform (Kapsel- und/oder Füllmaterial) vor, sollte von der Behandlung abgesehen werden.[14]
Wechselwirkungen mit anderen Medikamenten
Nintedanib verursacht eine schwache Inhibition von OCT-1, BCRP und P-gp, dies ist klinisch jedoch kaum relevant. Als Substrat des P-gp kann der Plasmaspiegel des Nintedanib jedoch durch gleichzeitige Gabe von starken P-gp-Inhibitoren wie z. B. Ketoconazol oder Erythromycin erhöht werden, sodass je nach Verträglichkeit eine Dosisreduktion erwogen werden muss. Die gleichzeitige Gabe von starken P-gp-Induktoren wie z. B. Rifampicin, Carbamazepin, Phenytoin und Johanniskraut verringert die Plasmakonzentration des Nintedanibs. Hier empfiehlt sich eine sorgfältige Prüfung des Nutzens einer gleichzeitiger Einnahme. Durch den Arzneistoff oder seine Metabolite tritt keine Inhibition oder Induktion von CYP-Enzymen auf.[15][16]
Anwendung während Schwangerschaft und Stillzeit
Nintedanib ist teratogen, fetotoxisch und milchgängig, weshalb es während der Schwangerschaft und Stillzeit nicht eingenommen werden sollte. Frauen im gebärfähigen Alter sollten bei Behandlung mit diesem Arzneistoff eine konsequente Empfängnisverhütung anwenden bzw. im Falle einer Schwangerschaft mit dem Arzt eine Nutzenabwägung der Behandlung mit Ofev bzw. Vargatef durchführen.[16][17]
Besondere Patientengruppen[18][19]
- Kinder und Jugendliche (0–18 Jahre):
Effektivität und Sicherheit sind nicht nachgewiesen (es liegen keine Daten vor).
- ältere Patienten (über 65 Jahre):
Die Anfangsdosis muss nicht reduziert werden. Effektivität und Sicherheit des Arzneimittels unterscheiden sich nicht im Vergleich mit Patienten mittleren Alters.
- Nierenfunktionsstörungen:
Da der Arzneistoff nur zu einem sehr geringen Teil (weniger als 1 %) über die Niere ausgeschieden wird, ist keine Dosisanpassung bei leichter bis mittelschwerer Niereninsuffizienz erforderlich. Für die Therapie von Patienten mit schwerer Niereninsuffizienz liegen keine klinischen Daten vor.
- Leberfunktionsstörungen:
Nintedanib wird hauptsächlich biliär/fäkal ausgeschieden, jedoch ist bei Patienten mit leichter Leberinsuffizienz (Child Pugh A) keine Dosisanpassung nötig, eine engmaschige Überwachung der Leberwerte wird dennoch empfohlen. Patienten mit mittelschwerer bis schwerer Leberinsuffizienz (Child Pugh B bzw. C) sollten nicht mit dem Arzneistoff behandelt werden.
- Raucher:
Durch Rauchen verringert sich die Plasmakonzentration des Arzneistoffs um 21 %. Patienten sollten dazu angehalten werden, während der Therapie auf den Genuss von Zigaretten u. ä. zu verzichten.
Unerwünschte Wirkungen (Nebenwirkungen)
Sehr häufige UAW:[20]
- Durchfall
- Übelkeit, Erbrechen
- Bauchschmerzen
- Erhöhung der Leberenzyme
- erhöhte Blutungswahrscheinlichkeit (aufgrund der VEGF-Inhibition)
- verminderter Appetit
- Gewichtsabnahme
- Kopfschmerzen
Häufige UAW:
- Hypertonie
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Nintedanib ist ein niedermolekularer Rezeptor-Tyrosinkinase-Inhibitor. Der Arzneistoff blockiert die vaskulären endothelialen Wachstumsfaktorrezeptoren (vascular endothelial growth factor receptor) VEGFR 1 bis 3, die Kinaseaktivität von Fibroblasten-Wachstumsfaktorrezeptoren (fibroblast growth factor receptor) FGFR 1 bis 3 und die von Thrombozyten abgeleiteten Wachstumsfaktorrezeptoren (platelet-derived growth factor receptor) PDGFR α und ß. Man bezeichnet ihn deshalb auch als 3-fach zielgerichteten Angiokinase-Hemmer. Des Weiteren werden durch Nintedanib die nicht-Rezeptor-Tyrosinkinasen (nRTKs) lymphozytenspezifische Tyrosinproteinkinase (Lck), Fms-artige Tyrosinproteinkinase (Flt) 3 und proto-onkogene Tyrosinproteinkinase (Src) inhibiert. Durch die kompetitive Bindung des Nintedanibs an die Adenosintriphosphat-Bindungstasche der oben genannten Rezeptoren wird die intrazelluläre Signalübertragung und damit die Proliferation und das Überleben von Endothelzellen sowie perivaskulären Zellen (Perizyten und vaskuläre glatte Muskelzellen) entscheidend beeinflusst.[21]
Bedeutung für die Behandlung
- von fortgeschrittenem nicht kleinzelligem Lungenkarzinom:
Nintedanib wirkt direkt „antitumorös“ durch Hemmung der Blutversorgung des Tumors, unterbindet aber auch weitere Escape-Mechanismen durch simultane Inhibition mehrerer Rezeptorklassen. Außerdem wird durch Hemmung der Tumorangiogenese eine Normalisierung der Gefäßstruktur bewirkt und damit bessere Erreichbarkeit des Tumors für andere Chemotherapeutika gewährleistet.[22]
- von idiopathischer Lungenfibrose:
Fibroblasten sind für den bei IPF charakteristischen narbigen Umbau der Lunge verantwortlich. Durch Hemmung der Signaltransduktion der Wachstumsfaktoren VEGF, FGF und PDGF wird Einfluss auf die Proliferation, Migration und Transformation von Fibroblasten genommen und damit die weitere Vernarbung der Lunge vermindert.[23]
Es gibt Hinweise, dass Nintedanib die Verschlechterung der Lungenfunktion bei Systemischer Sklerose verlangsamt.[24]
Aufnahme und Verteilung im Körper (Pharmakokinetik)[25]
- Absorption: max. Plasmakonzentration wird nach 2 bis 4h (oral, Weichgelatinekapseln) erreicht; Bioverfügbarkeit 4,7 % (Gesunde, 100mg Ofev); Resorption und Bioverfügbarkeit werden durch Transporter-Effekte (Substrat des P-gp) und First-Pass-Metabolismus verringert.
Bei der Einnahme zu einer Mahlzeit ist die aufgenommene Nintedanib-Menge etwa 20 % höher als im Nüchternzustand.
- Distribution: hohe Plasmaproteinbindung (97,8 %, hauptsächlich an Albumin), bevorzugte Verteilung via Plasma (Blut-Plasma-Ratio 0,87). Das Verteilungsvolumen ist mit 1050 Liter sehr groß.
- Elimination: Halbwertszeit 9,5 h (IPF-Patienten), renale unveränderte Ausscheidung nach 48 h 0,05 % (oral) bzw. 1,4 % (i.v.), renale Clearance 20 ml/min. Die totale Plasmaclearance nach i.v.-Applikation ist mit 1390 ml/min sehr hoch.
- Metabolismus: 25 % Esterspaltung (Esterasen) zu freier Säure (BIBF 1202), dann Glukuronidierung durch UGT-Enzyme (1A1, 1A7, 1A8, 1A10); nur 5 % CYP-abhängiger (überwiegend 3A4) Metabolismus
- Ausscheidung: 93,4 % biliär als BIBF 1202; 0,65 % renal; nach 4 Tagen sind über 90 % der Dosis wieder ausgeschieden
Toxikologie
Nintedanib ist teratogen, fetotoxisch und milchgängig.[26] Die akute letale Dosis beläuft sich bei Ratten und Mäusen bei oraler Aufnahme auf mehr als 2000 mg/kg. Bei wiederholter Exposition über 13 Wochen erweisen sich 3 mg/kg Körpergewicht oral bei Affen als tödlich. Der Ames-Test an Salmonella typhimurium ist negativ, sodass keine Mutagenität vorliegt.
Chemische Merkmale
Stereochemie
-Nintedanib_Structural_Formula_V.1.svg.png.webp)
Nintedanib weist eine (E-/Z)-Isomerie zwischen C20 und C21 auf, wobei das (Z)-Isomer im Arzneistoff Anwendung findet. Es finden sich keine Stereozentren im Molekül.
Synthese
Die Synthese von Nintedanib besteht aus mehreren Teilschritten:[27]
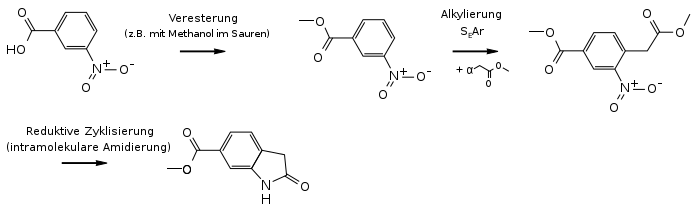
Veresterung von 3-Nitrobenzoesäure (z. B. mit Methanol im Sauren) zu 3-Nitrobenzoesäuremethylester, anschließende elektrophile Substitution am Aromaten durch Chloressigsäuremethylester zu 4-Methoxycarbonyl-methyl-3-nitrobenzoesäuremethylester. Reduktive Cyclisierung (intramolekulare Amidierung) liefert 6-Methoxycarbonyl-2-oxindol.
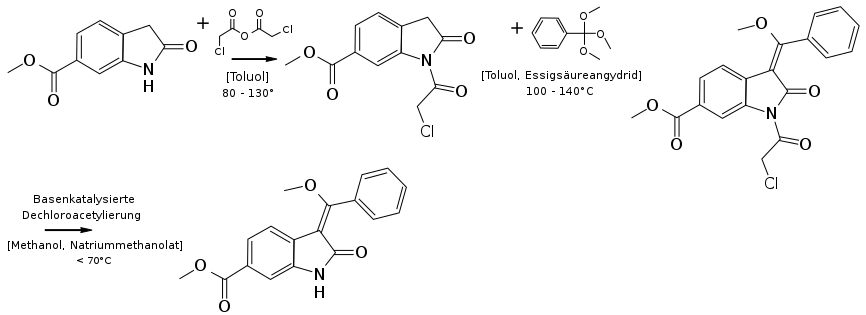
Das 6-Methoxycarbonyl-2-oxindol reagiert mit Chloressigsäureanhydrid zum „Chlorimid“ (Methyl-1-(chloracetyl)-2-oxoindolin-6-carboxylat):
Diese Umsetzung von 6-Methoxycarbonyl-2-oxindol mit Chloressigsäureanhydrid oder einem entsprechend aktivierten Chloressigsäurederivat (beispielsweise Chloracetylchlorid) sollte vorzugsweise in einem hochsiedenden und aprotischen Lösungsmittel, zum Beispiel Toluol, Xylol oder Butylacetat, bei einer Temperatur von 80 °C bis etwa 130 °C erfolgen. Es handelt sich um eine N-Alkylierung (SN2-Reaktion). Die Kristallisation des Produkts wird durch Zugabe eines nicht-polaren Lösungsmittels (zum Beispiel Cyclohexan oder Methylcyclohexan) bei einer Temperatur von etwa 80 bis 100 °C initiiert und ist bei einer Temperatur von etwa −5 °C bis Raumtemperatur abgeschlossen. Der Feststoff wird gesammelt, gewaschen (vorzugsweise mit polaren Lösungsmitteln, wie Alkoholen – besonders bevorzugt Methanol), und getrocknet, um die „Chlorimid“-Verbindung zu erhalten.
Die Reaktion des „Chlorimids“ mit Trimethylorthobenzoat liefert das „Chlorenol“ (Methyl-1-(chloracetyl)-3-[methoxy(phenyl)methylen]-2-oxoindolin-6-carboxylat). Diese Umsetzung erfolgt in einem hochsiedenden und aprotischen Lösungsmittel, wie Butylacetat, N,N-Dimethylformamid, Xylol oder vorzugsweise Toluol, bei Temperaturen von etwa 100 bis etwa 140 °C. Die Reaktion wird von „Methanol-Fänger“ wie Essigsäureanhydrid vermittelt.
Dabei hydrolisiert der Orthoester zum Diacylcarbeniumion, einem Elektrophil, und Methanol. Es findet eine elektrophile Substitution am Indol in Position 3 statt, wodurch ein Acetal gebildet wird. Dieses wird anschließend hydrolisiert. Die Kristallisation des Produkts kann beim Erreichen von Raumtemperatur bis etwa −10 °C als beendet betrachtet werden. Der Feststoff wird gesammelt und gewaschen, vorzugsweise mit Lösungsmitteln wie Toluol, Xylol und/oder Ethylacetat ist. Nach dem Trocknen erhält man die „Chlorenol“-Verbindung.
Das „Chlorenol“ reagiert mit Basen, sodass das „Enolindol“ (Methyl-3-[methoxy(phenyl)methylen]-2-oxoindolin-6-carboxylat) erhalten wird:
Die basenkatalysierte Dechloracetylierung von Methyl-1-(chloracetyl)-3-[methoxy(phenyl)methylen]-2-oxoindolin-6-carboxylat wird in protischen Lösungsmitteln wie Alkoholen (Isopropanol oder vorzugsweise Methanol) bei Temperaturen von etwa 70 °C bis Raumtemperatur durchgeführt. Dabei werden anorganische Basen wie Alkalihydroxide oder organische Basen wie Natriummethanolat als Katalysator verwendet. Die Kristallisation wird bei Raumtemperatur bis etwa −10 °C als beendet verstanden. Der Feststoff wird gesammelt und gewaschen, vorzugsweise mit Alkoholen, am meisten bevorzugt Methanol. Nach dem Trocknen wird das „Enolindol“ erhalten.
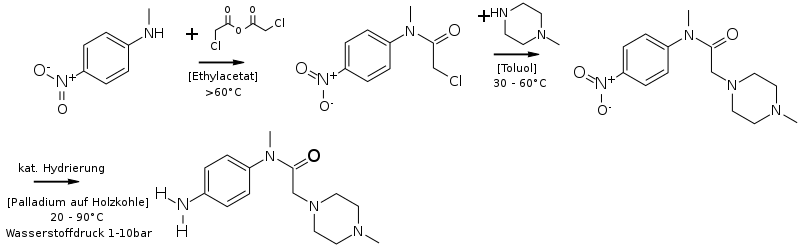
Die Umsetzung von N-Methyl-4-nitroanilin mit Chloressigsäureanhydrid liefert das „Chloracetyl“ (N-(4-nitroanilin)-N-methyl-2-chlor-acetamid):
Die Chloracetylierung von N-Methyl-4-nitroanilin findet in aprotischen Lösungsmitteln, wie Toluol, oder Estern, vorzugsweise Ethylacetat, bei Temperaturen von nicht weniger als 60 °C. Als Alkylierungsmittel können aktivierte Derivate von Chloressigsäure wie Chloressigsäurechlorid, oder bevorzugt Chloressigsäureanhydrid, verwendet werden. Die Kristallisation wird durch Zusatz von unpolaren Lösungsmitteln, vorzugsweise Cyclohexan oder Methylcyclohexan bei Temperaturen von etwa 60 °C bis etwa 80 °C eingeleitet und bei Raumtemperatur bis etwa −10 °C abgeschlossen. Der Feststoff wird gesammelt und gewaschen, vorzugsweise mit unpolaren Lösungsmitteln, wie Methylcyclohexan. Nach dem Trocknen wird die „Chloracetyl“-Verbindung erhalten.
Durch Reaktion des „Chloracetyls“ mit 1-Methylpiperazin erhält man das „Nitroanilin“ (N-(4-nitrophenyl)-N-methyl-2-(4-Methylpiperazin-1-yl)-acetamid) und durch anschließender Hydrierung das „Anilin“ (N-(4-Aminophenyl)-N-methyl-2-(4-methylpiperazin-1-yl)acetamid):
Die anfängliche Reaktion von N-(4-Nitroanilino)-N-methyl-2-chlor-acetamid mit 1-Methylpiperazin erfolgt in aprotischen Lösungsmitteln wie Estern (z. B. Butylacetat), Ketonen (z. B. Methylisobutylketon) oder aromatischen Lösungsmitteln, vorzugsweise Toluol, bei Temperaturen von etwa 30 °C bis etwa 60 °C. Anschließend werden die organischen Salze durch Extraktion mit Wasser entfernt oder mit wässrigen Lösungen von anorganischen Salzen, beispielsweise Kochsalzlösung verdünnt. Das verbleibende Reaktionsgemisch wird mit einem Alkohol, vorzugsweise Isopropanol, verdünnt und bei Temperaturen von etwa 20 °C bis etwa 90 °C hydrierte, bei Wasserstoffdrucken von etwa 1 bar bis 10 bar, unter Verwendung von heterogenen Hydrierkatalysatoren wie Palladium auf Holzkohle. Nach Entfernen des Katalysators wird die Mehrzahl der Lösungsmittel bei vermindertem Druck und bei Temperaturen von etwa 40 °C bis etwa 80 °C abdestilliert. Der Rückstand wird in Toluol oder in einem Gemisch aus Toluol und einem Ester, vorzugsweise Ethylacetat bei etwa 70 bis 90 °C gelöst und dann durch Absenken der Temperatur auf etwa 10 °C bis −10 °C auskristallisiert. Die Kristalle werden abgetrennt und mit einem nicht-polaren Lösungsmittel, vorzugsweise mit Toluol gewaschen und getrocknet, um die „Anilin“ Verbindung zu erhalten.

Durch Reaktion des „Anilin“ mit dem „Enolindol“ entsteht das „Anilino“-Verbindung (3-Z-[1-(4-(N-((4-Methyl-piperazin-1-yl)-methylcarbonyl)-N-methyl-amino)anilino)-1-phenyl-methylen]-6-methoxycarbonyl-2-indolinon). Diese Reaktion ist stereospezifisch in Bezug auf die Z- und E-Isomere und liefert die Z-Isoform:
Die Umsetzung von Methyl-3-[methoxy(phenyl)methylen]-2-oxoindolin-6-carboxylat und N-(4-Aminophenyl)-N-methyl-2-(4-Methylpiperazin-1-yl)acetamid wird in protische Lösungsmittel, wie Alkohole, beispielsweise Ethanol oder vorzugsweise Methanol, oder aromatische Lösungsmittel, wie Toluol, oder in Gemischen dieser Lösungsmittel mit stark polaren Lösungsmitteln wie N,N-Dimethylacetamid oder vorzugsweise N,N-Dimethylformamid, bei einer Temperatur von nicht weniger als 50 °C unter Rückflussbedingungen durchgeführt. Nach vollständigem Umsatz (ca. 8 h) wird die Kristallisation bei einer Temperatur von mindestens Umgebungstemperatur eingeleitet. Der Feststoff wird gesammelt und anschließend mit einem protischen Lösungsmittel, wie Ethanol oder vorzugsweise Methanol, oder mit aromatischen Lösungsmitteln wie Toluol gewaschen. Nach dem Trocknen wird die „Anilino“-Verbindung, Nintedanib genannt, in Form gelber Kristalle isoliert.
Analytik
Instrumentelle Analytik
- 1H-NMR (500 MHz, DMSO-d6,ppm)
δ: 11,00 (s, 1 H, 23-H); 12,23 (s, 19-H); 7,61 (t; J = 7,1 Hz, 1 H, 33-H); 7,57 (t, J = 7,5 Hz, 2 H, 32-H + 34-H); 7,50 (d, J = 7,7 Hz, 2 H, 31-H + 35-H); 7,43 (d, J = 1,6 Hz, 1 H, 29-H); 7,20 (dd, J = 8,3; 1,6 Hz, 1 H, 27-H); 7,13 (d, J = 8,3 Hz, 2 H, 14-H + 18-H); 6,89 (d, 8,3 Hz, 2 H, 15-H + 17-H); 5,84 (d, J = 8,3 Hz, 1 H, 26-H); 3,77 (s, 3 H, 40-H3); 3,06 (m, 3 H, 12-H3); 2,70 (m, 2 H, 8-H2); 2,19 (m, 8 H, 2-H2, 3-H2, 5-H2, 6-H2); 2,11 (s, 3 H, 7-H3)[28]
- 13C-NMR (126 MHz, DMSO-d6)
δ: 54,5 (C-2 + C-6); 52,2 (C-3 + C-5); 45,6 (C-7); 59,1 (C-8); 168,5 (C-9); 36,6 (C-12); 140,1 (C-13); 127,6 (C-14 + C-18); 123,8 (C-17 + C-15); 137,0 (C-16); 158,3 (C-20); 97,5 (C-21 ); 170,1 (C-22); 136,2 (C-24); 128,9 (C-25); 117,2 (C-26); 121,4 (C-27); 124,0(C-28); 109,4 (C-29); 131,9 (C-30); 128,4 (C-31 + C-35); 129,4 (C-32 + C-34); 130,4 (C-33); 166,3 (C-37); 51,7 (C-40)[28]
- IR
1610 cm−1 (Indolinon), 1655 cm−1 (Amid), 1711 cm−1 (Ester)[29]
- MS (ESI-MS)
Molekülpeak bei m/z = 540 [M + H]+[30]
Organische Reaktivitätsanalytik
Der Arzneistoff Nintedanib kann nasschemisch durch verschiedene Nachweisreaktionen identifiziert werden, z. B. per Hydroxamsäure-Reaktion mit Hydroxylamin und Eisen(III)-chlorid-Reagenz zum Nachweis des Carbonsäureesters oder durch den Nachweis von tertiären Aminen durch Versetzen mit Citronensäure und Acetaldehyd, sodass ein rotblauer Farbstoff entsteht, dessen Struktur noch nicht voll aufgeklärt ist.
Literatur
- Beipackzettel „Ofev – 150mg Kapseln“ Boehringer Ingelheim Prescribing Information about Ofev.
- Europäische Kommission „Gesundheit und Verbraucher“: Zusammenfassung der Merkmale des Arzneimittels Vargatef., Anhang 1 zum Durchführungsbeschluss der Europäischen Kommission „Gesundheit und Verbraucher“ über die Erteilung einer Zulassung für das Humanarzneimittel „Vargatef – Nintedanib“ gemäß der Verordnung (EG) Nr. 726/2004 des Europäischen Parlaments und des Rates vom 21. November 2014.
Einzelnachweise
- BIBF1120 (Vargatef, Nintedanib) – VEGFR/PDGFR/FGFR inhibitor, abgerufen am 27. Dezember 2019.
- Patentanmeldung EP1473043 A1 Pharmaceutical combination for the treatment of diseases involving cell proliferation, migration or apotosis of myeloma cells, or angiogenesis. Angemeldet am 29. April 2003, veröffentlicht am 3. November 2004, Anmelder: Boehringer Ingelheim Pharma GmbH & Co. KG, Erfinder: Dr. Martin Stefanic, Dr. Gerd Munzert, Dr. Frank Hilberg
- fluorochem: Safety Data Sheet, abgerufen am 27. Dezember 2019.
- Boehringer-Ingelheim Jahresbericht 2006, S. 132 (Memento des Originals vom 22. November 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 7,4 MB).
- F. Hilberg, G. J. Roth, M. Krssak, S. Kautschitsch, W. Sommergruber, U. Tontsch-Grunt, P. Garin-Chesa, G. Bader, A. Zoephel, J. Quant, A. Heckel, W. J. Rettig: BIBF 1120: triple angiokinase inhibitor with sustained receptor blockade and good antitumor efficacy. In: Cancer Res. 68, Nr. 12, 2008, S. 4774–4782. doi:10.1158/0008-5472.CAN-07-6307. PMID 18559524.
- Patentanmeldung EP1473043 A1 Pharmaceutical combination for the treatment of diseases involving cell proliferation, migration or apotosis of myeloma cells, or angiogenesis. Angemeldet am 29. April 2003, veröffentlicht am 3. November 2004, Anmelder: Boehringer Ingelheim Pharma GmbH & Co. KG, Erfinder: Dr. Martin Stefanic, Dr. Gerd Munzert, Dr. Frank Hilberg
- Boehringer Ingelheim submits nintedanib*, a novel oncology compound, for European approval. Pressemitteilung vom 14. Oktober 2013.
- EMA accepts marketing authorisation application for nintedanib in IPF. Pressemitteilung vom 5. Juni 2014.
- EMA: Ofev Produktinformation. Abgerufen am 5. August 2020.
- Boehringer Ingelheim: Gebrauchsinformation: Information für Patienten Ofev® 150 mg Weichkapseln Nintedanib.
- Deutsches Sicherheitsdatenblatt (Memento vom 13. November 2013 im Internet Archive) bei LC Laboratories.
- Europäische Kommission „Gesundheit und Verbraucher“: Zusammenfassung der Merkmale des Arzneimittels Vargatef, S. 2.
- Beipackzettel, S. 2.
- Europäische Kommission „Gesundheit und Verbraucher“: Zusammenfassung der Merkmale des Arzneimittels Vargatef, S. 5.
- Europäische Kommission „Gesundheit und Verbraucher“: Zusammenfassung der Merkmale des Arzneimittels Vargatef, S. 7–8.
- Beipackzettel, S. 6.
- Europäische Kommission „Gesundheit und Verbraucher“: Zusammenfassung der Merkmale des Arzneimittels Vargatef, S. 8–9.
- Beipackzettel, S. 7.
- Europäische Kommission „Gesundheit und Verbraucher“: Zusammenfassung der Merkmale des Arzneimittels Vargatef, S. 23.
- Beipackzettel, S. 4.
- Fortgeschrittenes nicht-kleinzelliges Lungenkarzinom – Nintedanib*: Angiokinase-Hemmer mit erweitertem Wirkmechanismus in der fortgeschrittenen klinischen Entwicklung PharmaForum in Onkologie 36, Oktober 2013, S. Karger Verlag für Medizin und Naturwissenschaften GmbH.
- Europäische Kommission „Gesundheit und Verbraucher“: Zusammenfassung der Merkmale des Arzneimittels Vargatef, S. 11.
- Deutsches Ärzteblatt Idiopathische Lungenfibrose: Nintedanib und Pirfenidon bremsen Krankheitsprogression Artikel vom 19. Mai 2014, Ärzte-Verlag GmbH.
- https://www.aerzteblatt.de/nachrichten/103274/Systemische-Sklerose-Nintedanib-verlangsamt-Verschlechterung-der-Lungenfunktion?rt=677d4218b2f333a120d562938b62b910
- Beipackzettel, S. 9.
- Boehringer Ingelheim MSDS: Ofev (Memento des Originals vom 4. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Patentanmeldung WO 2009/071523 A1 PROCESS FOR THE MANUFACTURE OF AN INDOLINONE DERIVATIVE. Angemeldet am 2. Dezember 2008, veröffentlicht am 11. Juni 2009, Anmelder: Boehringer Ingelheim International GmbH, Erfinder: Jörn Merten.
- Patentanmeldung WO2009071524 (A2) INDOLINONE DERIVATIVES AND PROCESS FOR THEIR MANUFACTURE. Angemeldet am 2. Dezember 2008, veröffentlicht am 11. Juni 2009, Anmelder: Boehringer Ingelheim International GmbH, Erfinder: Jörn Merten.
- Patentanmeldung EP1473043 A1 Pharmaceutical combination for the treatment of diseases involving cell proliferation, migration or apotosis of myeloma cells, or angiogenesis. Angemeldet am 29. April 2003, veröffentlicht am 3. November 2004, Anmelder: Boehringer Ingelheim Pharma GmbH & Co. KG, Erfinder: Dr. Martin Stefanic.
- Patentanmeldung WO2004013099 (A1) 3-Z-[1-(4-(N-((4-METHYL-PIPERAZIN-1-YL)-METHYLCARBONYL)-N-METHYL-AMINO)-ANILINO)-1-PHENYL-METHYLENE-6-METHOXYCARBONYL-2-INDOLINONE-MONOETHANESULPHONATE AND THE USE THEREOF AS A PHARMACEUTICAL COMPOSITION.] Angemeldet am 18. Juli 2003, veröffentlicht am 12. Februar 2004, Anmelder: Boehringer Ingelheim Pharma GmbH & Co. KG, Erfinder: Gerald Jürgen Roth.