Neuroanatomie
Die Neuroanatomie ist eine Wissenschaft, die den Aufbau des Nervensystems untersucht. Sie ist ein Teilgebiet der Neurobiologie sowie ein Spezialgebiet der systematischen Anatomie und hat in der Neurophysiologie und in der Neurochemie Schwesterdisziplinen. Eng mit der Neuroanatomie verbunden ist auch die Neuropathologie, die die strukturellen Veränderungen des Nervensystems bei krankhaften Prozessen untersucht.
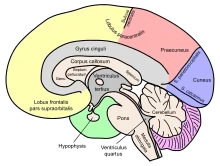
Die Neuroanatomie beschäftigt sich mit der Größe, Lage, Benennung und Struktur des Nervensystems von Menschen und Tieren. Die Teildisziplin der vergleichenden Neuroanatomie stellt Beziehungen zwischen Gehirn- oder Rückenmarksstrukturen von verschiedenen Tiergruppen auf und kann so Aussagen über die Evolution des Nervensystems treffen.
Geschichte der Neuroanatomie
Die Rolle des Nervensystems für die Übertragung von Informationen wurde von griechischen Philosophen und Ärzten der Antike eher erahnt als gewusst. In den Konzepten des Altertums wurden die Nerven meist für hohle Leitröhren für das Pneuma, eine Art lebenspendende Substanz, die im Gehirn aus dem Blut gebildet werden sollte, gehalten. Das Gehirn selbst wurde sehr unterschiedlich bewertet: mal galt es als Zentrum des Verstandes und Sitz der Seele, mal sollte es lediglich dazu dienen, das Blut zu kühlen oder Phlegma zu produzieren. Erst um das 3. Jahrhundert v. Chr. kamen mit der Alexandrinischen Schule Anatomen wie Herophilos von Chalkedon und Erasistratos zum Zuge, die durch zahlreiche Sektionen auch an Menschen die Grundlagen einer wissenschaftlich-beobachtenden Neuroanatomie legten. Recht dezidierte Erkenntnisse – auch über physiologische Zusammenhänge – wurden vor allem von Erasistratos gewonnen, der sich hierbei auf die Vivisektion von Tieren stützte. Er erkannte bereits die Unterschiede zwischen motorischen und sensiblen Nerven und gliederte das Gehirn in seine makroanatomischen Anteile. Galenos, ein griechischer Arzt der hohen römischen Kaiserzeit, trug das Wissen seiner Zeit zusammen und führte auch selbst Sektionen durch, allerdings nur an Tieren, wodurch sich viele Fehlschlüsse in seine Schriften verirrten. Da er für fast 1.300 Jahre als die unangefochtene Autorität auf dem Gebiet der Anatomie galt, blieben diese Irrtümer solange unentdeckt. Erst in der Renaissance wurden die antiken Erkenntnisse überprüft und teilweise korrigiert.
Gegenstand
Der behandelte Gegenstand ist das Nervensystem, seine geweblichen und zellulären Strukturen. Eine morphologische Besonderheit dieses Systems ist die Konnektivität, also das Prinzip, dass die einzelnen Zellen untereinander vielfache Verbindungen eingehen, die deren Zusammenspiel ermöglichen und definieren. Die kleinste funktionelle Einheit, die Nervenzelle (auch Neuron), bildet Ausläufer (Dendrite und Axone), durch die sie mit anderen Nervenzellen über Synapsen Kontakt aufnehmen und Informationen als elektrische Potentiale weiterleiten können. Neurone haben ein besonders leicht modulierbares Membranpotential und sind daher schnell und wiederholt reizbar. Über die Synapse selbst wird die Erregung durch Botenstoffe, sogenannte Neurotransmitter weitergeleitet.
Man unterscheidet zwischen dem zentralen (Gehirn und Rückenmark) und dem peripheren Anteil (Nerven) des Nervensystems. Weiterhin wird zwischen dem somatischen (Willkür-)Nervensystem und dem autonomen Nervensystem unterschieden. Diese Einteilungen dienen mehr der Systematik, da die beschriebenen Untersysteme keine wirklich voneinander unabhängige Einheiten darstellen. Das Nervengewebe höherer Tiere wird in zellreiche graue Substanz und faser(zellfortsatz-)reiche weiße Substanz unterteilt. Die zelluläre Zusammensetzung, die sogenannte Zytoarchitektur unterscheidet sich dabei in verschiedenen Anteilen des Nervensystems erheblich und widerspiegelt die jeweilige Funktion.
Embryonal entstehen alle Bestandteile des Nervensystems aus dem äußeren Keimblatt, dem Ektoderm. Nur ein Teil der Vorläuferzellen differenziert sich zu Nervenzellen aus, andere werden zu spezialisiertem Stützgewebe, der Glia.
Besonders wichtig zum Verständnis der neuroanatomischen Verhältnisse sind die räumlichen (topischen) Beziehungen einzelner Abschnitte zueinander. Damit ist der definierte Verlauf (die Projektion) der Bahnen von einer Zellpopulation zu einer anderen gemeint. Diese verlaufen nicht beliebig, sondern unterliegen einer klaren Struktur, bei der sich aus den Fortsätzen vieler Nervenzellen gebildete Nervenbahnen (Tractus, Fasciculi, Lemnisci etc.) unterscheiden lassen. Über die genetisch vorgegebene Grundstruktur hinaus verfügt das Nervensystem jedoch über eine hohe Plastizität, wodurch die Ausbildung der anatomischen Feinstrukturen nicht zuletzt von Prägung und Lernen bestimmt wird.
Methoden der anatomischen Datengewinnung
Um den Verlauf von Verbindungen innerhalb des zentralen Nervensystems (ZNS) zu erfassen, kommt eine Vielzahl von Methoden zum Einsatz, deren wichtigste Vertreter nachfolgend aufgelistet sind:
Klinische Beobachtung
Auch heute noch sind viele grundlegende Erkenntnisse über das Gehirn und seine Eigenheiten aus klinischen Erfahrungen abgeleitet. Bereits Hippokrates bemerkte, dass eine linksseitige Wunde am Kopf einen rechtsseitigen Ausfall der Motorik zur Folge hat.[1] Dass die kontralaterale Beziehung von Körper und Gehirn ein wirkliches Charakteristikum des menschlichen Organismus ist, wurde zuerst von Antonio Maria Valsalva (1666–1723) und seinem Schüler Giovanni Battista Morgagni (1682–1771) erkannt und nachträglich mit dem wenig gebräuchlichen Begriff „Valsalva-Doktrin“ belegt.[2] Die bis dahin vorherrschenden hippokratischen/galenischen Konzepte, die keinerlei Zusammenhang zwischen Gehirn und Motorik, respektive Sensorik, sahen, erklären diesen recht späten Zeitpunkt der Schlussfolgerung in der Menschheitsgeschichte.[3] Ein weiteres bekanntes Beispiel ist das Brown-Séquard-Syndrom, welches nach halbseitiger Durchtrennung des Rückenmarks vorliegt.
Präparation
Die Präparation der Fasertrakte innerhalb des ZNS ist dem besseren Verständnis des Verlaufs großer Trakte enorm zuträglich. Kleinere Verbindungen lassen sich so jedoch kaum darstellen. Den Ort der Kreuzung des Traktus corticospinalis konnten François Pourfour du Petit und Domenico Mistichelli bereits 1710 durch Präparation auf den unteren Teil der Medulla oblongata, die Pyramiden, festlegen und Franz Joseph Gall (1758–1828) und Johann Spurzheim (1776–1832) gelang einhundert Jahre später eine Darstellung der Faserbahnen von der Pyramide zum Cortex (Hirnrinde).
Axonaler Transport
Axonales Tracing macht sich die Transportmechanismen innerhalb der Neurone zu Nutze, durch welche für gewöhnlich reger Stoffaustausch zwischen Synapse und Zellkörper gewährleistet werden. Daran beteiligt sind insbesondere die Mikrotubuli als Bestandteile des Cytoskeletts, sowie die Transportproteine Dynein und Kynesin.[4]
Diffusions-Tensor-Bildgebung
Die Diffusions-Tensor-Bildgebung ist die wohl detailreichste nichtinvasive Darstellung von Fasertrakten im Gehirn. Über die Messung der Wasserdiffusion entlang der Nervenbahnen können ebendiese sehr detailgetreu dargestellt werden.[5] Jedoch bestehen noch einige Probleme bei der realitätsgetreuen Darstellung. Beispielsweise können kleine von größeren Trakten manchmal schlecht abgegrenzt werden, was insbesondere bei kleinen kreuzenden und großen ipsilateral verlaufenden Trakten der Fall ist.[6] Mit Hilfe dieses Verfahrens werden derzeit auch im Rahmen des Human Connector Project versucht den Verlauf aller Nervenfasern im Gehirn zu kartieren.[7]
Degenerationsmethoden
Bis in die 1970er Jahre wurde der Verlauf und das Ziel von Bahnen hauptsächlich mit Degenerationsmethoden bestimmt. Als Beispiel zu nennen wäre hier die sogenannte Wallersche Degeneration, die den Untergang eines Nervenanteils distal einer Schädigung des Nerven bezeichnet. So lässt sich der Verlauf der geschädigten Axone weiterverfolgen.
Transkraniale magnetische Stimulation
Hierbei werden die Trakte über kurze magnetische Stimulation der entsprechenden Hirnregion stimuliert. An der innervierten Muskulatur lassen sich die erzeugten Signale messen.
Anatomie des Zentralen Nervensystems
Das Zentrale Nervensystem wird unterschieden in das Rückenmark (Medulla spinalis) und das Gehirn (Encephalon), welches entwicklungsbiologisch, drei primären Hirnbläschen entsprechend, unterteilt wird in die Hauptabschnitte von Vorderhirn (Prosencephalon), Mittelhirn (Mesencephalon) und Rautenhirn (Rhombencephalon).
Das Vorderhirn besteht aus dem Endhirn (Telencephalon), zu dem auch die Großhirnrinde (Cortex cerebri) gehört, und dem Zwischenhirn (Diencephalon), zu dem unter anderem der Thalamus zählt.
Das Mittelhirn enthält im Mittelhirndach die Vierhügelplatte, der die paarigen oberen Hügel (Colliculi superiores) und unteren Hügel (Colliculi inferiores) zugehören.
Das Rautenhirn wird unterteilt in das Hinterhirn (Metencephalon), wozu neben der Brücke (Pons) auch das Kleinhirn (Cerebellum) zählt, und das Markhirn (Myelencephalon), auch verlängertes Mark (Medulla oblongata) genannt.
Als Hirnstamm werden Mittelhirn und Rautenhirn ohne Kleinhirn zusammengefasst, also Mes-, Met- und Myelencephalon mit Ausnahme des Cerebellums.
Der mit dem Ausdruck Stammhirn bezeichnete Begriff dagegen umfasst neben dem Hirnstamm das Zwischenhirn sowie darüber hinaus gelegentlich auch das Kleinhirn und Teile des Endhirns als dessen Stammganglien (Basalganglien).
Das Rückenmark wird in Segmente unterschieden, die je dem Halsmark, dem Brustmark, dem Lendenmark, dem Kreuzmark oder dem Steißmark bzw. Schwanzmark zugeordnet werden.
Motorische Bahnen
Hauptmotorikbahnen von Wirbeltieren, die nicht den Säugetieren angehören, sind die reticulo- und vestibulo- und rubrospinalen Trakte.[1]
Pyramidales System
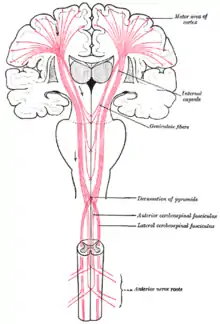
Der Hauptteil des pyramidalen Systems ist die Pyramidenbahn (Tractus corticospinalis). Sie ist beidseits an der Unterseite der Medulla oblongata (Myelencephalon) als seichter Längswulst (Pyramis, Pyramide) sichtbar. In der Pyramidenkreuzung (Decussatio pyramidum), am Übergang zwischen Nachhirn und Rückenmark, kreuzen 70 bis 90 Prozent der Neuriten als Tractus corticospinalis lateralis auf die jeweils andere Seite (kontralateral), die restlichen laufen als Tractus corticospinalis anterior paramedian im Vorderstrang des Rückenmarks und kreuzen segmental ins Vorderhorn der kontralateralen Seite des Rückenmarks. Einige Bahnen kreuzen überhaupt nicht, sondern verbleiben ipsilateral. Das Ausmaß der Kreuzung ist bei den einzelnen Säugern unterschiedlich. Beim Menschen und beim Hund kreuzt die Mehrzahl der Fasern. Bei Huftieren kreuzt nur etwa die Hälfte der Bahnen.
Tractus reticulospinalis medialis & lateralis
Die Tractus reticulospinalis medialis & laterales sind In allen bis 2007 untersuchten Spezies der Wirbeltiere vorzufinden und stellen damit wohl die ersten motorischen Faserbahnen dar.[8] Es werden insbesondere körpernahe Muskelgruppen kontrahiert.[1]
Tractus rubrospinalis
Alle bis dato 2007 untersuchten Säugetiere und Vögel besitzen einen Tractus rubrospinalis, wohingegen er unter Fischen, Amphibien und Reptilien in einigen, aber nicht allen Arten vorkommt.[8] Seine Entstehung geht einher mit der beginnenden Entwicklung von kieferbesitzenden Wirbeltieren.[8] Er ist insbesondere bei Tieren mit Extremitäten (bzw. Pseudoextremitäten wie beispielsweise Rochen) zu finden.[8] Beim Menschen ist der Tractus rubrospinalis nur als Anlage entwickelt.[9] Von der Qualität her liegt er zwischen vestibulo-/reticulospinalis und dem Tractus corticospinalis.[1]
Tractus corticospinalis
Der Trakt konnte bisher ausschließlich bei Säugetieren nachgewiesen werden.[1] Alle bisher untersuchten Säugetiere besitzen diesen Trakt und seine Entstehung fällt mit der Ausbreitung der Säugetiere und der Entwicklung des Neocortex zusammen. Zurückverfolgen lässt er sich jedoch nur innerhalb einer Säugetierart, was vermuten lässt, dass er in jeder Säugetierart unabhängig voneinander entstanden ist. Dies würde auch die Variabilität im Verlauf erklären[8] und die teils starken zwischenmenschlichen Variationen.[1] Man vermutet, dass sich die corticospinalen Fasern aus den corticobulbären entwickelt haben.[8] In der Regel kreuzen bei allen Säugetieren fast alle Fasern, doch die Lamina der Verschaltung im Rückenmark variiert stark zwischen Säugetierarten. Bei Igeln und Schliefern verläuft der Trakt generell ipsilateral.[8] Die Kreuzungsstelle kann aber auch beispielsweise im Pons wie beim Elefanten liegen.[1] Phylogenetisch haben sich zuerst die Fasern aus dem parietalen Cortex entwickelt. Präzise Steuerung der Extremitäten.[9]
Die Basalganglien, sowie die Substantia nigra sind in allen Wirbeltierklassen und im Stamm der Kieferlosen nachgewiesen.[10]
Sensorische Bahnen
Aus evolutionären Betrachtungen wird man eine Reihenfolge der Entstehung der sensorischen Bahnen nicht sicher ableiten können. Denn alle noch lebenden Tierarten verfügen über alle Sinne (in unterschiedlichem Ausmaß, was aber als Zeichen der anschließenden Differenzierung gedeutet wird). Die Ereignisse liegen zudem zu weit in der Vergangenheit, als dass Fossilien Aufschluss darüber geben könnten. Alternativ könnte man die Embryologie bemühen: Die Reihenfolge, in welcher sich die Sinne embryonal entwickeln, entspricht auch der phylogenetischen Reihenfolge. Anhand der motorischen Bahnen lässt sich dieses Vorgehen rechtfertigen (siehe oben). Die Fähigkeit zur Nozizeption konnte in allen Stämmen des Tierreichs nachgewiesen werden, sogar bei Nesseltieren, die kein ausgebildetes Gehirn besitzen[11].
Assoziierte Erkrankungen
Die Analyse von Erkrankungen lässt oft Rückschlüsse auf die Sinnhaftigkeit betroffener Strukturen zu. Das Maus-Knock-Out-Modell arbeitet genau nach diesem Prinzip. Es gibt eine Reihe von Krankheiten, bei welchen zum Beispiel die Pyramidenbahn entweder eine abnormale Kreuzung oder sogar gar keine Kreuzung aufweist. Problematisch ist, dass viele der Erkrankungen in der Regel mit weiteren tiefgreifenden Veränderungen des ZNS einhergehen (z. B. Corpus-callosum-Agenesie).
Äußere Gewalteinwirkungen
Bei traumatische Gewalteinwirkungen auf das Gehirn sind in der Regel Körperfunktionen der kontralaterale Extremität von eventuellen Ausfällen betroffen. Die wenigen Fälle in der Literatur, wo eine ipsilaterale Paralyse nach Gewalteinwirkung auftrat, wurden genauer analysiert. Auch bei solche Patienten kreuzten die Bahnen, nur wurden durch gewissen Umstände (beispielsweise durch blutungsbedingten Druck auf die Hirngegenseite) ipsilaterale motorische wie sensorische Ausfälle erzeugt.[2] Bei einseitiger Schädigung der motorischen oder sensorischen Trakte ist der ipsilaterale (nicht geschädigte) Cortex häufig in der Lage den Ausfall zu kompensieren, insbesondere bei jungen Kindern. Hierzu werden ipsilateralen Efferenzen, sowie komplexe polysynaptische Verschaltungen (corticorecticulospinal) aktiviert.[1]
HGPPS
Patienten mit progressiver externer Ophthalmoplegie und Skoliose (HGPPS) weisen keine Kreuzung der Pyramidenbahn, der superioren cerebellären Pedunkel und keine Kreuzungen der Hinterstrangbahnen auf, was durch Magnetresonanztomographie erfasst und durch Diffusions-Tensor-Bildgebung transkraniale magnetische Stimulation und intraoperative Stimulation bestätigt wurde.[12] Fasern des Corpus Callosum, sowie corticopontine Fasern.[13] die des Tractus spinothalamicus und das Chiasma opticum bleiben hingegen von den Mutationen unbeeinflusst.[1] Die fehlende Kreuzung macht sich beim Tractus corticospinalis sogar als ausgeprägtere Schmetterlingsform des Rückenmark bemerkbar[14] Verantwortlich für die Symptome ist eine Mutation im Robo3QGen[14][1][2] Es wurde bereits durch Deletion des kodierenden Gens bei Mäusen nachgewiesen, dass das Protein Robo3 essentiell für die Kreuzung der Trakte ist: Es fand keine Kreuzung der Trakte im gesamten Rückenmark oder Hirnstamm mehr statt.[14] Die Mäuse starben kurz nach Geburt, ein komplettes Fehlen des mutierten Protein ist also letal.
Für das Verständnis der kreuzenden Fasertrakte im ZNS ist folgende Beobachtung wegweisend: Bei keinem der von HGPPS betroffenen Patienten wurden sensorische oder motorische Beeinträchtigungen wie Taubheit, Muskelschwäche oder mangelhafte Koordination festgestellt, obgleich die Bahnen wie oben beschrieben ipsilateral verlaufen.[14] Dies bedeutet, dass ein ipsilateraler Aufbau des ZNS keine wesentlichen Nachteile der Motorik oder Sensorik mit sich bringt. Als Grundlage der Augenlähmung diskutiert man Veränderungen des Nucleus abducens oder der paramedianen pontinen Formatio reticulatio[14] Andere sehen in der schlechten Koordination der autochthonen Rückenmuskulatur eine mögliche Herkunft der Skoliose.[2]
In diesem Zusammenhang sind zwei Untersuchungen über den Nervus trochlearis sehr aufschlussreich, welcher bekannterweise kreuzt, dorsal aus dem Hirnstamm austritt und den kontralateralen Musculus obliquus superior innerviert. Durch Unterdrückung der für die Kreuzung von Axonen wichtigen Netrin-Rezeptoren bei Mäusen konnte eine teilweise oder vollständige ipsilaterale Innervation des M. obliquus superior durch den N. Trochlearis erreicht werden.[15] Hierbei sind keinerlei funktionelle Nachteile einer ipsilateralen Innervation aufgefallen. In einem anderen Experiment wurde der N. Trochlearis bei Froschembryonen durchtrennt. Der Nerv regenerierte, versorgte nun aber den ipsilateralen M. Obliquus superior ebenfalls ohne Verhaltensauffälligkeiten.[16] Diese Untersuchungen bestätigen ebenfalls, dass die Funktionalität bei einer Kreuzung nicht im Vordergrund stehen muss.[17]
Literatur
- Axel Karenberg: Neuroanatomie. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1035 f.
Weblinks
Einzelnachweise
- S. Vulliemoz, O. Raineteau, D. Jabaudon: Reaching beyond the midline: why are human brains cross wired? In: The Lancet. Neurology. Band 4, Nummer 2, Februar 2005, S. 87–99, doi:10.1016/S1474-4422(05)00990-7, PMID 15664541 (Review).
- H. S. Schutta, K. K. Abu-Amero, T. M. Bosley: Exceptions to the Valsalva doctrine. In: Neurology. Band 74, Nummer 4, Januar 2010, S. 329–335, doi:10.1212/WNL.0b013e3181cbcd84, PMID 20101039 (Review).
- E. D. Louis: Contralateral control: evolving concepts of the brain-body relationship from Hippocrates to Morgagni. In: Neurology. Band 44, Nummer 12, Dezember 1994, S. 2398–2400, PMID 7991135.
- U. Matzner, R. Lüllmann-Rauch u. a.: Enzyme replacement improves ataxic gait and central nervous system histopathology in a mouse model of metachromatic leukodystrophy. In: Molecular therapy: the journal of the American Society of Gene Therapy. Band 17, Nummer 4, April 2009, S. 600–606, doi:10.1038/mt.2008.305, PMID 19174759, PMC 2835113 (freier Volltext).
- Mori, S., & Zhang, J., Diffusion Tensor Imaging (DTI). In Encyclopedia of Neuroscience, 2009, S. 531–538, ISBN 978-0-08-045046-9
- A. Narayana, J. Chang, S. Thakur, W. Huang, S. Karimi, B. Hou, A. Kowalski, G. Perera, A. Holodny, P. H. Gutin: Use of MR spectroscopy and functional imaging in the treatment planning of gliomas. In: The British journal of radiology. Band 80, Nummer 953, Mai 2007, S. 347–354, doi:10.1259/bjr/65349468, PMID 17068012.
- Human Connector Project
- R. J. Nudo, S. B. Frost: The Evolution of Motor Cortex and Motor Systems. In: J. H. Kaas: Evolution of Nervous Systems. Band 3. Elsevier, 2007, ISBN 978-0-12-370878-6, S. 373–395.
- A. R. Crossman: Neuroanatomy. In S. Standring: Gray’s Anatomie, 7, The Anatomical Basis of Clinical Practice. Elsevier, 2008, ISBN 0-443-06684-1, S. 225–392.
- Nieuwenhuys, R., Donkelaar, H. J., Nicholson, C., Smeets, W. J. A. J., and Wicht, H. (1998). The central nervous system of vertebrates. Springer, New York.
- Walter, E. T. (2008). Evolutionary Aspects of Pain. In B. e. al, The Senses: A Comprehensive Reference 7 Volume 5 (S. 175–184). Academic Press. ISBN 978-0-12-370880-9, doi:10.1016/B978-012370880-9.00155-9
- J. C. Jen: Effects of failure of development of crossing brainstem pathways on ocular motor control. In: Progress in brain research. Band 171, 2008, S. 137–141, doi:10.1016/S0079-6123(08)00618-3, PMID 18718292.
- A. Avadhani, V. Ilayaraja u. a.: Diffusion tensor imaging in horizontal gaze palsy with progressive scoliosis. In: Magnetic resonance imaging. Band 28, Nummer 2, Februar 2010, S. 212–216, doi:10.1016/j.mri.2009.10.004, PMID 20071118.
- J. C. Jen, W. M. Chan u. a.: Mutations in a human ROBO gene disrupt hindbrain axon pathway crossing and morphogenesis. In: Science. Band 304, Nummer 5676, Juni 2004, S. 1509–1513, doi:10.1126/science.1096437, PMID 15105459, PMC 1618874 (freier Volltext).
- R. W. Burgess: Motor Axon Guidance of the Mammalian Trochlear and Phrenic Nerves: Dependence on the Netrin Receptor Unc5c and Modifier Loci. In: Journal of Neuroscience. 26, 2006, S. 5756, doi:10.1523/JNEUROSCI.0736-06.2006.
- B. Fritzsch, R. Sonntag: Oculomotor (N III) motoneurons can innervate the superior oblique muscle of Xenopus after larval trochlear (N IV) nerve surgery. In: Neuroscience letters. Band 114, Nummer 2, Juli 1990, S. 129–134, PMID 2395527.
- M. H. E. de Lussanet, J. W. M. Osse: An ancestral axial twist explains the contralateral forebain and the optic chiasm in vertebrates. In: Animal Biology, 62, 2012, S. 193–216, arxiv:1003.1872, doi:10.1163/157075611X617102