Mayenit-Obergruppe
Die Mayenit-Obergruppe ist eine Gruppe nanoporöser Minerale aus der Klasse der Oxide und der Silikate, die alle den gleichen strukturellen Aufbau haben. Ihre Zusammensetzung gehorcht der allgemeinen Formel:
- X12{IVT18-xVIT'1x}IVT26O124O28-x(O2aH)3×[W6-x].
Für die Definition der einzelnen Minerale dieser Gruppe wird die vereinfachte Formel
- X12T14O32-x(OH)3×[W6-x] zugrunde gelegt.
In dieser Strukturformel repräsentieren die Großbuchstaben X, T (T1, T'1, T2), O (O1, O2) und W unterschiedliche Positionen in der Mayenitstruktur, mit
- X: Ca2+
- T: Al3+, Fe3+, Si4+, Mg2+
- O: O2-
- W: Cl-, F-, (OH)-, O2-, H2O, □ (Leerstelle)
Die Minerale dieser Gruppe bilden meist unscheinbare, rundliche Körnchen oder Kristalle mit den Flächen des Triakistetraeders {211}, die selten größer als 0,1 mm werden. Je nach Zusammensetzung sind sie farblos, blass grün, limonengelb oder grau bis schwarz mit gläsernem Glanz. Sie zeigen keine Spaltbarkeit und sind mit einer Mohsschen Härte von 5–6 ungefähr so hart wie Fensterglas.
Alle Minerale dieser Gruppe sind sehr selten und einige nur von einem Fundort bekannt. Sie kommen in kalkreichen Gesteinen vor, die bei niedrigem Druck und sehr hohen Temperaturen von chlor- und fluorhaltigen Gasen verändert worden sind. Dies sind vor allem Skarne und Kalksteineinschlüsse in basaltischen Magmen oder Ignimbriten.
Synthetische Verbindungen dieser Gruppe haben große technische und industrielle Bedeutung. Die Verbindung Ca12Al14O32[O □5] (Mayenit) ist ein Bestandteil der Zementklinker von Tonerdezementen – das sind korrosionsbeständige und schnell härtende Spezialzemente.
Mayenite, die statt O2− zwei Elektronen auf der W-Position enthalten (C12A7:2e), sind temperaturstabile Verbindungen mit Elektronen als Anion (Elektride) und für zahlreiche Anwendungen in der Optoelektronik und als Katalysatoren in der chemischen Industrie von Bedeutung. Als Promotor für Ruthenium-Nanoteilchen haben sie das Potential, einen der wichtigsten Prozesse der chemischen Industrie, die Synthese von Ammoniak nach dem Haber-Bosch-Verfahren, zu revolutionieren.
Geschichte, Etymologie und Vorkommen
Vom Zement zum Ammoniak
Calziumaluminat-Zemente wurden bei der Suche nach Zementen entwickelt, die weniger Anfällig für Sulfatkorrosoin sind, 1908 vom Unternehmen Lafarge in Frankreich patentiert. Calziumaluminat-Zemente werden bis heute als korrosionsbeständige und schnell härtende Spezialzemente oder z. B. als Wärmespeicher für solarthermisch Anlagen verwendet.[1][2] Bei systematischen Untersuchungen der Verbindungen, die beim Brennen der Calaiumaluminat-Zementklinker entstehen, wurde 1909 ein kubisches Calciumaluminat beschrieben, für das damals die Zusammensetzung 5CaO · 3Al2O3 angegeben wurde.[3]
Die Struktur dieser Verbindung wurde 1936 von W. Büssem und A. Eitel am Kaiser-Wilhelm-Institut für Silikatforschung in Berlin-Dahlem aufgeklärt. Im Zuge der Strukturaufklärung korrigierten sie die Zusammensetzung zu 12CaO · 7Al2O3, C12A7 in der Zementchemischen Notation.[4]
Über 50 Jahre später verlagerte sich das Interesse an dieser Verbindung von der Zementforschung auf die ungewöhnlichen elektrischen Eigenschaften dieses Strukturtyps. 1988 entdeckte M. Lacerda von der Universidade Nova de Lisboa mit Kollegen der University of Aberdeen die gute Leitfähigkeit durch Oxidanionen O2−, die bis dahin nur von wenigen Oxiden mit Fluoritstruktur bekannt war.[5] Wie diese Ionenleitung in der nanoporösen Struktur des Mayenit erfolgt, wurde in den folgenden 20 Jahren aufgeklärt, z. B. von der Arbeitsgruppe um Hans Boysen von der Ludwig-Maximilians-Universität München.[6]
Am anderen Ende der Welt untersuchten Chemiker von der Japan Science and Technology Agency sowie von der Technischen Hochschule Tokio Mayenite, die unter sehr sauerstoffarmen Bedingungen behandelt worden waren und in denen normalerweise instabile Anionen wie das Hydrid-Anion (H−) oder Elektronen eingeschlossen wurden.[7] Im Jahr 2002 berichteten sie von einer dauerhaften Umwandlung von nicht leitenden Hydrid-Mayenit in elektronisch leitenden Mayenit durch UV-Strahlung. Interessant ist dies z. B. für die Entwicklung lichtdurchlässiger Bauteile, in die mit photographischen Verfahren elektrische Leitungsbahnen eingeschrieben werden können.[8]
Im Jahr darauf beschrieben sie das erste Elektrid, das bei Raumtemperatur und Umgebungsluft stabil ist, ein Mayenit, der in den Poren seiner Kristallstruktur Elektronen als Anion enthält.[9] Diese Elektride besitzen technisch interessante elektrische und katalytische Eigenschaften und sind weltweit Gegenstand intensiver Forschung.
Aus theoretischen Berechnungen schlossen Medvedeva und Freeman von der Northwestern University in Evanston 2004, dass sich der Mechanismus der elektrischen Leitfähigkeit mit zunehmenden Elektronenkonzentrationen von einer ionischen zu einer metallischen Leitfähigkeit mit delokalisierten Elektronen ändert. Solche metallisch leitenden Mayenite sind streng genommen keine Elektride mehr, da sie keine isolierten Elektronen an festen Kristallgitterpositionen eines Anions enthalten.[10] Drei Jahre später konnte die Arbeitsgruppe um Hideo Hosono von der Technischen Hochschule Tokio diese metallische Leitfähigkeit experimentell bestätigen.[11] Im gleichen Jahr konnten sie zeigen, dass Mayenit-Elektride bei sehr tiefen Temperaturen, unter 0,4 K, supraleitend werden.[12] Die Bezeichnung metallisch leitender Mayenite als Elektrid hat sich in der Literatur bis heute (2018) gehalten.
Im Jahr darauf belegte die Gruppe um Luis Palacios von der Universität Málaga, Spanien, erstmals, dass sich in Mayenit-Elektriden, die noch nicht metallisch leitend sind, Elektronen tatsächlich im Zentrum der Hohlräume der nanoporösen Struktur befinden.[13]
Den Übergang zur metallischen Leitfähigkeit mit zunehmenden Elektronenkonzentrationen in den Porenräumen dokumentierte eine internationale Arbeitsgruppe an der Sorbonne, der Northwestern University und der Missouri University of Science and Technology im Jahr 2015.[14]
Parallel zu den elektrischen Eigenschaften wurden die katalytischen Anwendungen von Mayenit-Elektriden untersucht und 2007 demonstrierte eine japanische Forschergruppe die Eignung von Mayenit als Katalysator einer organischen Reaktion in wässriger Lösung.[15]
Im gleichen Jahr bestimmten Y. Toda und seine Mitarbeiter die Austrittsarbeit der Elektronen aus der Mayenitstruktur. Mit 2,4 eV ist sie ähnlich gering wie die des metallischen Kaliums.[16] Kalium und andere Alkali- und Erdalkalioxide werden als Promotor der Katalysatoren für die Ammoniaksynthese eingesetzt, einem der bedeutendsten Prozesse der technischen Chemie, der aktuell 1–2 % der weltweiten Energieproduktion benötigt.
Mit der Kombination eines Mayenit-Elektrids als Promotor mit Ruthenium-Nanopartikeln als Katalysator gelang 2012 der Arbeitsgruppe um Masaaki Kitano von der Technischen Hochschule Tokio in Japan ein Durchbruch bei der Synthese von Ammoniak. Ihnen gelang es erstmals, die Aktivierungsenergie der Stickstoffaufspaltung katalytisch so weit herabzusetzen, dass sie nicht mehr den energiehungrigsten und geschwindigkeitsbestimmenden Schritt der Ammoniaksynthese darstellt.[17][18][19]
Ein weiterer Schritt zur großtechnischen Umsetzung dieser Forschungsergebnisse gelang Dong Jiang und Mitarbeitern von der Clemson University mit der Entdeckung eines günstigen Weges zur Herstellung von Mayenit-Elektriden.[20]
Von Vulkanen, Meteoriten und brennenden Kohlehalden
Die ersten Funde eines natürlichen, kubischen Calciumaluminats wurden 1963 von L. Heller in einem Sprurritfels im Nalhal Ayalon-Aufschluss der Hatrurim-Formation in Israel gemacht. Es ist ein gängiges Mineral in vielen Aufschlüssen der pyromethamorphen Hatrurim-Formation.[21]
Als neues Mineral beschrieben wurde es ein Jahr später von Gerhard Hentschel zusammen mit Brownmillerit aus Kalksteineinschlüssen in Laven des Ettringer Bellerberges mit der Zusammensetzung Ca12Al14O33. Er benannte das neue Mineral nach der nahe gelegenen Stadt Mayen Mayenit.[22] Rund 20 Jahre später dokumentierte Hentschel die Chlorgehalte der Mayenite des Bellerberg Vulkans, die er als Mischkristallbildung seines Mayenit (O2- auf der W-Position) und einem chlorhaltigen Mayenit mit 2Cl- auf der W-Position interpretierte. Eine erneute Untersuchung des Mayenit im Jahr 2012 zeigte dann, dass dieser kein O2- enthält, dafür neben Chlor (Cl−) noch (OH)-[23], was schließlich zu einer Umbenennung und Neudefinition des Materials als Chlormayenit führte. Der alte Name Mayenit hat sich als Gruppenname und in der werkstoffwissenschaftlichen Literatur gehalten und ist als Mineralname für ein natürliches Vorkommen der Verbindung Ca12Al14O32[□5O] (C12A7) reserviert.[24]
Ebenfalls in einem Skarn-Xenolithen, diesmal aus einem Andesit in Japan, entdeckte 1993 eine Arbeitsgruppe vom Geological Survey of Japan ein sehr chlorreiches Mineral dieses Strukturtyps, das sie nach dem ersten Generaldirektor ihrer Einrichtung, Tsunashirō Wada, Wadalit nannten.[25][26]
Ebenfalls im vulkanischen Umfeld, in Skarn-Xenolithen aus Ignimbriten der Chengen-Caldera wurden die Minerale Eltyubyuit und Chlorkyuygenit entdeckt.[27][28]
Eine Untersuchung der zunächst als Mayenit angesprochenen Minerale der pyrometamorphen Gesteine der Hatrurim-Formation führte im Jahr 2015 zur Entdeckung der fluorreichen Mitglieder der Mayenitgruppe Fluormayenit und Fluorkyuygenit.[29]
Chondritische Meteorite können Calcium-Aluminium-reiche Einschlüsse (CAI) enthalten. Sie bestehen aus Calcium-Aluminium-Silicium-Oxiden, die sich bei hohen Temperaturen bei der Entstehung des Sonnensystems gelildet haben, z. B. Åkermanit, Anorthit, Grossular. Einige dieser CAI wurden zu einem späteren Zeitpunkt von chlorreichen Fluiden verändert, was zur Bildung verschiedener Minerale der Mayenit-Obergruppe führte. Chi Ma und Mitarbeiter beschrieben 2010 Chlormayenit im NWA 1934 Meteoriten, einem CV3-Chondriten aus Nordwestafrika[30], der zunächst unter dem Namen Brearleyit als neues Mineral von der Commission on New Minerals, Nomenclature and Classification (CNMNC) der IMA anerkannt wurde.[31] Vier Jahre später beschrieben Chi Ma und Alexander N. Krot das Mineral Adrianit aus einem CAI des Allende-Meteoriten.[32][33] und auch Wadalit konnte in den CAIs einiger Meteorite nachgewiesen werden.[34]
Ebenfalls in der Zeit von 2010 bis 2015 wurden Minerale der Mayenit-Gruppe in Klinkern abgebrannter Kohlehalden gefunden, wo ähnlich unwirtliche Bedingungen herrschten, wie bei der Entstehung kohliger Chondrite: Hohe Temperaturen, geringer Druck und Abwesenheit von Sauerstoff. So wurden Minerale der Mayenit-Gruppe in Klinkern abgebrannter Halden des Rosice-Oslavany Kohlefeldes in Tschechien[35], des Donezkkohlebeckens in der Ukraine[36] und des Chelyabinsk-Kohlebeckens in Russland[37] nachgewiesen.
Kristallstruktur
Die Symmetrie der Minerale der Mayenitobergruppe ist kubisch mit der Raumgruppe I43d (Raumgruppen-Nr. 220) und zwei Formeleinheiten pro Elementarzelle. Der Gitterparameter liegt bei ungefähr a = 12 Å. Die Raumgruppe I43d (Nr. 220) enthält kein Symmetriezentrum und ist eine Untergruppe von Ia3d (Nr. 230), der zentrosymmetrischen Raumgruppe der Minerale der Granatgruppe, und alle Atompositionen der Mayenitstruktur lassen sich Positionen der Granatstruktur zuordnen. Eine Folge hiervon ist, dass Pulver von Mayeniten und Granaten nahezu identische Röntgenbeugungsmuster haben und z. B. Grossular und Mayenit mit Röntgenpulvermethoden nicht unterschieden werden können. Eine andere Konsequenz dieser Strukturverwandtschaft war, dass Mayenit und Wadalit lange Zeit der Granatgruppe zugeordnet wurden, obwohl ihre Strukturen erhebliche Unterschiede aufweisen.
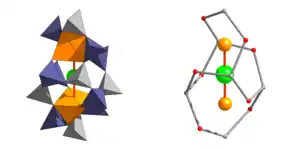
Ähnlich wie die Minerale der Zeolithgruppe zeichnet sich die Mayenitstruktur durch ein Alumosilikat-Tetraedergerüst aus, das 6 Käfige pro Elementarzelle umschließt, in die Inonen oder kleine Molekyle aufgenommen werden können. Dieses Gerüst mit der Zusammensetzung {(Al,Si)14O32} hat, je nach Siliziumgehalten eine negative Ladung von -22 (Mayenitgruppe) bis -18 (Wadalitgruppe). Jeder der Käfige enthält 2 fest an das Gerüst gebundene Ca2+-Ionen (24 positive Ladungen) was in einer Gesamtladung des Mayenitgerüsts von +2 bis +6 resultiert. Im Gegensatz zu den Zeolithen, die eine negative Ladung des Gerüstes aufweisen, wird bei den Mayeniten der Überschuss an positiven Ladungen durch Einbau von austauschbaren Anionen wie O2− in die Käfige ausgeglichen.[4][24] Auf dieser strukturellen Besonderheit beruhen die technologisch interessanten elektrischen und katalytischen Eigenschaften von Verbindungen dieses Strukturtyps.
Tetraedergerüst: T1, T2
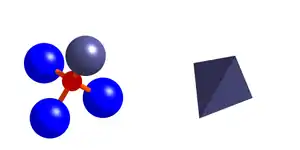
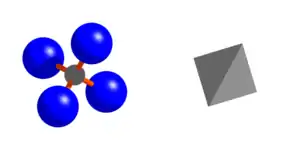
Die eine Sauerstoffposition in der Granatstruktur ist in der Mayenitstruktur in zwei Positionen aufgespalten.
Die O1-Sauerstoffe liegen auf der Wyckoff-Position 48e, eine allgemeine Punktlage, die 48 mal in der Elementarzelle auftritt. Sie sind von zwei Calciumionen und je einem Kation auf den beiden Tetraederpositionen T1 und T2 umgeben und verknüpfen die T1- und T2-Tetraeder zu einem Tetraedergerüst.
Die O2-Sauerstoffe liegen auf einer speziellen Punktlage (Wyckoff-Position 16c), von der es 16 pro Elementarzelle gibt. Sie sind an drei Calciumionen und einem Kationen auf der T1-Position gebunden.[38][25] Sie liegen auf der dreizähligen Rotationsachse und entsprechen einem Triplet von Sauerstoffen auf allgemeinen Lagen der Granatstruktur.
Die T1-Position ist tetraedrisch von 4 Sauerstoffanionen umgeben, drei O1 und einem O2-Sauerstoff. Das Kation, vorwiegend Al3+, sitzt im Zentrum und die Sauerstoffanionen auf den Ecken eines Tetraeders. Das T1-Kation liegt wie der O2-Sauerstoff auf einer 3-zähligen Achse auf der Wykhoff-Position 16c (16 mal pro Elementarzelle) und entspricht der oktaedrisch von 6 Sauerstoffen umgebenen Al-Position in der Granatstruktur. Da drei Sauerstoffe der Granatstruktur einem O2-Sauerstoff in der Mayenitstruktur entsprechen, ist Al auf dieser Position im Mayenit tetraedrisch von nur 4 Sauerstoffen umgeben.[38][25]
In natürlichen Chlormayenit sind bis zu 10 % der Kationen auf T1 wie im Granat oktaedrisch koordiniert. Bei der Reaktion von Chlormayenit mit Wasser wird ein O2-Sauerstoff durch drei OH-Gruppen auf der allgemeinen O2a-Position ersetzt und die Koordinationszahl der T1-Position auf 6 erhöht.[23]
Sie Siliziumposition der Granatstruktur spaltet sich bei Verlust des Symmetriezentrums in zwei Positionen auf und die T2-Position der Mayenitstruktur auf der Punktlage 12a entspricht einer dieser Positionen. Die T2-Position ist ebenfalls tetraedrisch von 4 Sauerstoffanionen auf der O1-Position umgeben.[38][25]
Die Tetraederpositionen sind zu einem Gerüst aus 8er-Ringen verknüpft, die zeolithartige Porenräume umschließen. In diesen Käfigen liegen die Kationen der X-Position und die austauschbaren Anionen der W-Position.
Porenräume: Positionen X und W
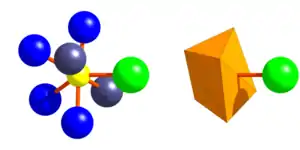
Die Hälfte der SiO4-Tetraeder der Granatstruktur fehlt in der Mayenitstruktur komplett. Die so entstehenden Hohlräume sind die W-Position der Mayenite. Pro Elementarzelle gibt es 12 W-Position (Wyckhoff-Position 12b). Sie liegen im Zentrum der Käfige des Tetraedergerüstes und sind entweder leer oder mit meist ein- bis zweiwertigen Anionen besetzt. Die W-Anionen bilden gestreckte Bindungen zu zwei benachbarten Kationen auf der X-Position.[38][25]
Die X-Position des Mayenit (Wykhoff 24d) entspricht der X-Position im Granat (24c) und enthält fast ausschließlich Calcium. Sie liegt an der Innenseite der Porenräme des Tetraedergerüsts, zwei pro Hohlraum an gegenüberliegenden Enden, und ist von 4 O1-Sauerstoffen und zwei O2-Sauerstoffen in form eines stark verzerrten Oktaeders umgeben. Wenn die angrenzende W-Position besetzt ist, erhöht sich die Koordinationszahl des Calciums auf 7.[38][25]
Chemismus
Die verschiedenen Minerale der Mayenit-Obergruppe ergeben sich im Wesentlichen durch Variationen in der Besetzung der Tetraederpositionen sowie der W-Position im Zentrum der Porenräume der Struktur. Die X-Position ist immer voll mit Calcium besetzt.
In der folgenden Tabelle sind die Minerale der Mayenit-Obergruppe aufgeführt. Unterteilt wird die Obergruppe anhand der negativen Ladung auf der W-Position in die Maynitgruppe (W2-) und die Wadalitgruppe (W6-).[24]
In den übrigen Spalten ist die idealisierte Zusammensetzung mit einer Zuordnung zu den Kationenpositionen wiedergegeben.
| Name | X12 | [4]T18-x [6]T'1x | T26 | O124O28-x | O2AH3x | W6-x | Anmerkung |
|---|---|---|---|---|---|---|---|
| unbenannte Gruppe: 0 negative Ladungen auf W | |||||||
| X2+12 | [4]T13+6 [2]T'13+2 | T23+6 | O124O26 | A−6 | □6 | ||
| Ca2+12 | [4]Al3+6 [6]Al3+2 | Al3+6 | O124O26 | (OH)−6 | □6 | hypothetisches Endglied, ≈ 40 % in Chlormayenit | |
| Ca2+12 | [4]Al3+6 [6]Al3+2 | Al3+6 | O124O26 | F−6 | □6 | hypothetisches Endglied, ≈ 3 % in Fluormayenit | |
| Mayenitgruppe: 2 negative Ladungen auf W | |||||||
| X2+12 | T13+8 | T23+6 | O124O28 | □6 | □5W2− | ||
| Mayenit (C12A7) | Ca12 | Al3+8 | Al3+6 | O124O28 | □6 | □5O2− | nur synthetisch bekannt, als Mineralname diskreditiert |
| X2+12 | T13+8 | T23+6 | O124O28 | □6 | □4W−2 | ||
| Chlormayenit | Ca12 | Al3+8 | Al3+6 | O124O28 | □6 | □4Cl−2 | |
| Sr12 | Al3+8 | Al3+6 | O124O28 | □6 | □4Cl−2 | hypothetisches Endglied, ≈ 1 % in Chlormayenit | |
| Ca12 | Fe3+8 | Fe3+6 | O124O28 | □6 | □4Cl−2 | hypothetisches Endglied, ≈ 10 % in Chlormayenit | |
| Fluormayenit | Ca12 | Al3+8 | Al3+6 | O124O28 | □6 | □4F−2 | |
| Ca12 | Fe3+8 | Fe3+6 | O124O28 | □6 | □4F−2 | hypothetisches Endglied, ≈ 2 % in Fluormayenit | |
| Ca12 | Al3+8 | Al3+6 | O124O28 | □6 | □4(OH)−2 | hypothetisches Endglied, ≈ 5 % in Fluormayenit | |
| Ca12 | Fe3+8 | Fe3+6 | O124O28 | □6 | □4(OH)−2 | hypothetisches Endglied, ≈ 1 % in Chlormayenit | |
| X2+12 | T13+8 | T23+6 | O124O28 | □6 | (H2O)4 W−2 | ||
| Chlorkyuygenit | Ca12 | Al3+8 | Al3+6 | O124O28 | □6 | (H2O)4Cl−2 | |
| Ca12 | Fe3+8 | Fe3+6 | O124O28 | □6 | (H2O)4Cl−2 | hypothetisches Endglied, ≈ 2 % in Chlorkyuygenit | |
| Fluorkyuygenit | Ca12 | Al3+8 | Al3+6 | O124O28 | □6 | (H2O)4F−2 | |
| Ca12 | Fe3+8 | Fe3+6 | O124O28 | □6 | (H2O)4F−2 | hypothetisches Endglied, ≈ 2 % in Fluorkyuygenit | |
| Ca12 | Al3+8 | Al3+6 | O124O28 | □6 | (H2O)4(OH)−2 | hypothetisches Endglied, ≈ 14 % in Fluorkyuygenit | |
| Ca12 | Fe3+8 | Fe3+6 | O124O28 | □6 | (H2O)4(OH)−2 | hypothetisches Endglied, ≈ 2 % in Chlorkyuygenit | |
| Wadalitgruppe: 6 negative Ladungen auf W | |||||||
| X2+12 | T13+8 | T23+6 | O124O28 | □6 | W−6 | ||
| Wadalit | Ca12 | Al3+8 | Al3+6 | O124O28 | □6 | Cl−6 | |
| Eltyubyuit | Ca12 | Fe3+8 | Fe3+6 | O124O28 | □6 | Cl−6 | |
| Ca12 | Fe3+8 | Fe3+6 | O124O28 | □6 | Cl−6 | hypothetisches Endglied, ≈ 2 % in Eltyubyuit | |
| X2+12 | T2+5T4+9 | O124O28 | □6 | W−6 | |||
| Adrianit | Ca2+12 | Mg2+5Si4+9 | O124O28 | □6 | Cl−6 | ||
| X3+4 X2+8 | T13+8 | T23+6 | O124O28 | □6 | W−6 | ||
| Y4 Ca8 | Al3+8 | Al3+6 | O124O28 | □6 | Cl−6 | hypothetisches Endglied, ≈ 10 % in Chlorkyuygenit | |
Chemie der Porenräume (W-Position)
Die Zementverbindung C12A7 (Mayenit) reagiert schnell und unter Hitzeentwicklung mit freien Wasser. Natürliche Minerale der Mayenit-Obergruppe enthalten häufig Wasser in den Porenräumen der Struktur in Form von molekularen Wasser (H2O) oder OH-Gruppen, das über verschiedene Austauschreaktionen in die Mayenitstruktur aufgenommen werden.
Auf dem Einbau von molekularen Wasser beruht die Umwandlung von Chlor- und Fluormayenit in Chlor- und Fluorkyuygenit:
- W□ = WH2O (Chlor- oder Fluorkyuygenit)[29]
OH-Gruppen können an verschiedenen Positionen über verschiedene Reaktionen eingebaut werden. Ein O2-Anion aus der Umgebung eines T1-Tetraeders kann durch drei OH-Gruppen ersetzt werden, wobei sich die Koordination der T1-Position von tetraedrisch (4 Sauerstoffe) zu oktaedrisch mit 3 Sauerstoffen und 3 OH-Gruppen erhöht. Der Ladungsausgleich erfolgt über zusätzliche Leerstellen auf der angrenzenden W-Position gemäß der Austauschreaktion
Zuvor wurde bereits in OH-freien, synthetischen Mayenit oktaedrisch koordiniertes Aluminium mit Infrarotspektroskopie nachgewiesen.[40]
Im Zentrum der Käfige des Aluminatgerüstes können die Hallogenid-Ionen durch einzelne OH-Gruppen ersetzt werden, gemäß der Reaktion
In synthetischen Mayeniten konnten an dieser Position weitere, oft sehr instabile, Anionen wie H−, O2−, O−, O22−, O2−, S2−, N3−, NH2−, NH2−, CN−, NO2− sowie freie Elektronen e− eingefügt und stabilisiert werden.[7][41][42]
Die Struktur des Mayenit ist eng verwandt mit der des Granates und das Zentrum der Porenräume in der Mayenitstruktur entspricht einer unbesetzten Position eines SiO4-Tetraeders in der Granatstruktur. Spektroskopische Untersuchungen deuten darauf hin, dass, ähnlich wie beim Hydrogrossular, (OH)4-Cluster leere Käfigposition im Mayenit ausfüllen können.[39]
Die X-Position an der Innenseite der Porenräume ist chemisch kaum variabel und meist vollständig mit Calcium besetzt. Beobachtet wurde ein Ersatz durch Strontium (Sr2+) und Yttrium (Y3+), gemäß der Austauschreaktionen[24]
- XCa2+ = XSr2+
- XCa2+ + [W]□ = XY3+ + [W](Cl,F,OH)−.
In Adrianit wurde die Substitution von Calcium durch Natrium beobachtet:[32]
- XCa2+ + [W]Cl− = XNa+ + [W]□
In synthetischen Mayeniten konnte Calcium teilweise durch Magnesium ersetzt werden.[43]
Ebenfalls an synthetischen Mayenit wurden Leerstellen auf der X-Position gefunden, gekoppelt an zusätzliche Leerstellen auf der W-Position entsprechend der Substitution
- XCa2+ + [W]O2− = X□ + [W]□.[44]
Chemie des Aluminatgerüsts
In natürlichen Mayeniten wurden nur wenige Substitutionen auf den Tetraederpositionen T1 und T2 beobachtet. Zum einen besteht eine vollständige Mischbarkeit zwischen Aluminium (Al3+) und Eisen (Fe3+)[45][27][46]
- [T1,2]Al3+ = [T1,2]Fe3+ (Eltyubyuit)
zum anderen kann Aluminium durch Magnesium (Mg2+) und Silizium (Si4+) ersetzt werden:[45][32][33]
- 2[T1,2]Al3+ = [T1,2]Mg2+ + [T1,2]Si4+ (Adrianit)
Der gekoppelte Einbau von Silizium im Gerüst und Chlor/Fluor in den Porenräumen führt zu einer lückenlosen Mischungsreihe von Mineralen der Mayenitgruppe und der Wadalitgruppe:
- [T1,2]Al3+ + [W]□ = [T1,2]Si4+ + [W](Cl,F)−
Von synthetischen Mayeniten ist noch der gekoppelte Einbau von Zink (Zn2+) und Phosphor (P5+) bekannt.
- 3[T1,2]Al3+ = 2[T1,2]Zn2+ + [T1,2]P5+[47]
Darüber hinaus wurden in synthetischen Mayeniten geringe Mengen der Kationen Ga3+, Fe3+, Co2+, Ni2+, Cu2+, Zn2+, V5+, Nb5+ und Ta5+ eingebaut.[42][48]
Weblinks
Einzelnachweise
- M. C. Alonso, J. Vera-Agullo, L. Guerreiro, V. Flor-Laguna, M. Sanchez, M. Collares-Pereira: Calcium aluminate based cement for concrete to be used as thermal energy storage in solar thermal electricity plants. In: Cement and Concrete Research. Band 82, 2016, S. 74–86, doi:10.1016/j.cemconres.2015.12.013.
- Khadim Ndiaye, Stéphane Ginestet and Martin Cyr: Thermal energy storage based on cementitious materials: A review. In: AIMS Energy. Band 6, 2018, S. 97–120, doi:10.3934/energy.2018.1.97 (aimspress.com [PDF; 939 kB; abgerufen am 30. September 2018]).
- Ernest Stanley Shepherd and G. S. Rankin: The binary systems of alumina with silica, lime, and magnesia; with optical study by Fred. Eugene Wright. In: American Journal of Science. Band 28, 1909, S. 293–333, doi:10.2475/ajs.s4-28.166.293.
- W. Büssem, A. Eitel: Die Struktur des Pentacalciumtrialuminats. In: Zeitschrift für Kristallographie. Band 95, 1936, S. 175–188 (rruff.info [PDF; 628 kB; abgerufen am 22. Juli 2018]).
- M. Lacerda, J. T. S. Irvine, F. P. Glasser & A. R. West: High oxide ion conductivity in Ca12Al14O33. In: Nature. Band 332, 1988, S. 525–526, doi:10.1038/332525a0.
- H. Boysen, M. Lerch, A. Stys and A. Senyshyn: Structure and oxygen mobility in mayenite (Ca12Al14O33): a high-temperature neutron powder diffraction study. In: Acta Crystallographica Section B. B63, 2007, S. 675–682 (researchgate.net [PDF; 2,3 MB; abgerufen am 30. August 2018]).
- Hayashi Katsuro, Hirano Masahiro, Hosono Hideo: Functionalities of a Nanoporous Crystal 12CaO·7Al2O3 Originating from the Incorporation of Active Anions. In: Bulletin of the Chemical Society of Japan. Band 80, 2007, S. 872–884 (csj.jp [PDF; 620 kB; abgerufen am 31. August 2018]).
- Katsuro Hayashi, Satoru Matsuishi, Toshio Kamiya, Masahiro Hirano & Hideo Hosono: Light-induced conversion of an insulating refractory oxide into a persistent electronic conductor. In: Nature. Band 419, 2002, S. 462–465, doi:10.1038/nature0105.
- Satoru Matsuishi, Yoshitake Toda, Masashi Miyakawa, Katsuro Hayashi, Toshio Kamiya, Masahiro Hirano, Isao Tanaka, Hideo Hosono: High-Density Electron Anions in a Nanoporous Single Crystal: [Ca24Al28O64]4+(4e-). In: Science. Band 301, 2003, S. 626–629, doi:10.1126/science.1083842.
- J. E. Medvedeva, A. J. Freeman: Hopping Versus Bulk Conductivity in Transparent Oxides: 12CaO·7Al2O3. In: Applied Physics Letters. Band 85, 2004, S. 955–957 (arxiv.org [PDF; 788 kB; abgerufen am 1. September 2018]).
- Sung Wng Kim, Satoru Matsuishi, Takatoshi Nomura, Yoshiki Kubota, Masaki Takata, Katsuro Hayashi, Toshio Kamiya, Masahiro Hirano, and Hideo Hosono: Metallic State in a Lime-Alumina Compound with Nanoporous Structure. In: Nano Letters. Band 7, 2007, S. 1138–1143, doi:10.1021/nl062717b.
- Masashi Miyakawa, Sung Wng Kim, Masahiro Hirano, Yoshimitsu Kohama, Hitoshi Kawaji, Tooru Atake, Hiroki Ikegami, Kimitoshi Kono, and Hideo Hosono: Superconductivity in an Inorganic Electride 12CaO·7Al2O3:e-. In: Journal of the American Chemical Society. Band 129, 2007, S. 7270–7271, doi:10.1021/ja0724644.
- Luis Palacios, Aurelio Cabeza, Sebastián Bruque, Santiago García-Granda and Miguel A. G. Aranda: Structure and Electrons in Mayenite Electrides. In: Inorganic Chemistry. Band 47, 2008, S. 2661–2667, doi:10.1021/ic7021193.
- R. P. S. M. Lobo, N. Bontemps, M. I. Bertoni, T. O. Mason, K. R. Poeppelmeier, A. J. Freeman, M. S. Park, and J. E. Medvedeva: Optical Conductivity of Mayenite: From Insulator to Metal. In: Journal of Physical Chemistry C. Band 119, 2015, S. 8849–8856 (mst.edu [PDF; 436 kB; abgerufen am 1. September 2018]).
- Haritha Buchammagari, Yoshitake Toda, Masahiro Hirano, Hideo Hosono, Daisuke Takeuchi, and Kohtaro Osakada: Room Temperature-Stable Electride as a Synthetic Organic Reagent: Application to Pinacol Coupling Reaction in Aqueous Media. In: Organic Letters. Band 9, 2007, S. 4287–4289, doi:10.1021/ol701885p.
- Y. Toda, H. Yanagi, E. Ikenaga, J. J. Kim, M. Kobata, S. Ueda, T. Kamiya, M. Hirano, K. Kobayashi, H. Hosono: Work Function of a Room‐Temperature, Stable Electride [Ca24Al28O64]4+(e–)4. In: Advanced Materials. Band 19, 2007, doi:10.1002/adma.200700663.
- M. Kitano, Y. Inoue, Y. Yamazaki, F. Hayashi, S. Kanbara, S. Matsuishi, T. Yokoyama, S. W. Kim, M. Hara, H. Hosono: Ammonia synthesis using a stable electride as an electron donor and reversible hydrogen store. In: Nature Chemistry. Band 4, 2012, S. 934–940, doi:10.1038/nchem.1476.
- Masaaki Kitano, Shinji Kanbara, Yasunori Inoue, Navaratnarajah Kuganathan, Peter V. Sushko, Toshiharu Yokoyama, Michikazu Hara & Hideo Hosono: Electride support boosts nitrogen dissociation over ruthenium catalyst and shifts the bottleneck in ammonia synthesis. In: Nature Communications. Band 6, 2015 (nature.com [PDF; 1,7 MB; abgerufen am 2. September 2018]).
- S. Kanbara, M. Kitano, Y. Inoue, T. Yokoyama, M. Hara, H. Hosono: Mechanism Switching of Ammonia Synthesis Over Ru-Loaded Electride Catalyst at Metal-Insulator Transition. In: Journal of the American Chemical Society. Band 137, 2015, S. 14517–14524, doi:10.1021/jacs.5b101451.
- Dong Jiang, Zeyu Zhao, Shenglong Mu, Vincent Phaneuf, and Jianhua Tong: Simple and Efficient Fabrication of Mayenite Electrides from a Solution-Derived Precursor. In: Inorganic Chemistry. Band 56, 2017, S. 11702–11709, doi:10.1021/acs.inorgchem.7b016.
- S. Gross: The mineralogy of the Hatrurim formation, Israel. In: Geol. Surv. Isr. Bull. Band 70, 1977, S. 1–80 (rruff.info [PDF; 5,7 MB; abgerufen am 29. Juli 2018]).
- Michael Fleischer: New Mineral Names - Mayenit. In: The American Mineralogiste. Band 50, 1965, S. 2096–2111 (rruff.info [PDF; 1,3 MB; abgerufen am 29. Juli 2018]).
- E. V. GALUSKIN, J. KUSZ, T. ARMBRUSTER, R. BAILAU, I. O. GALUSKINA, B. TERNES AND M. MURASHKO: A reinvestigation of mayenite from the type locality, the Ettringer Bellerberg volcano near Mayen, Eifel district, Germany. In: Mineralogical Magazine. Band 76, 2012, S. 707–716 (rruff.info [PDF; 388 kB; abgerufen am 29. Juli 2018]).
- Evgeny V. Galuskin, Frank Gfeller, Irina O. Galuskina, Thomas Armbruster, Radu Bailau and Viktor V. Sharygin: Mayenite supergroup, part I: Recommended nomenclature. In: European Journal of Mineralogie. Band 27, 2014, S. 99–111 (amazonaws.com [PDF; 802 kB; abgerufen am 30. Juni 2018]).
- K. Tsukimura, Y. Kanazawa, M. Aoki and M. Bunno: Structure of wadalite Ca6Al5Si2O16Cl3. In: Acta Crystallographica Section C. C49, 1993, S. 205–207, doi:10.1107/S0108270192005481.
- Yasuyuki Banno, Michiaki Bunno and Katsuhiro Tsukimura: A reinvestigation of holotype wadalite from Tadano, Fukushima Prefecture, Japan. In: Mineralogical Magazine - preprint. 2017 (cambridge.org [PDF; 913 kB; abgerufen am 8. September 2018]).
- Evgeny V. Galuskin, Irina O. Galuskina, Radu Bailau, Krystian Prusik, Viktor M. Gazeev, Aleksandr E. Zadov, Nikolai N. Pertsev, Lidia Jeżak, Anatoly G. Gurbanov, Leonid Dubrovinsky: Eltyubyuite, Ca12Fe3+ 10Si4O32Cl6 – the Fe3+ analogue of wadalite: a new mineral from the Northern Caucasus, Kabardino-Balkaria, Russia. In: European Journal of Mineralogy. Band 25, 2013, S. 221–229, doi:10.1127/0935-1221/2013/0025-2285.
- E. V. Galuskin, I. O. Galuskina, J. Kusz, F. Gfeller, T. Armbruster, R. Bailau, M. Dulski, V. M. Gazeev, N. N. Pertsev, A. E. Zadov, P. Dzierzanowski: Mayenite supergroup, part II: Chlorkyuygenite from northern Caucasus Kabardino-Balkaria, Russia, a new microporous mayenite supergroup mineral with “zeolitic” H2O. In: European Journal of Mineralogie. Band 27, 2015, S. 123–136, doi:10.1127/ejm/2015/0027-2419.
- Evgeny V. Galuskin, Frank Gfeller, Thomas Armbruster, Irina O. Galuskina, Yevgeny Vapnik, Mateusz Dulski, Mikhail Murashko, Piotr Dzierzanowsky, Viktor V. Sharygin, Sergey V. Krivovichev and Richard Wirth: Mayenite supergroup, part III: Chlormayenite, Ca12Al14O32[‹4F2], and fluorkyuygenite, Ca12Al14O32[(H2O)4F2], two new minerals from pyrometamorphic rocks of the Hatrurim Complex, South Levant. In: European Journal of Mineralogie. Band 27, 2015, S. 123–136 (researchgate.net [PDF; 689 kB; abgerufen am 28. Juli 2018]).
- Chi Ma, Stuart A. Sweeney Smith, Harold C. Connolly Jr., John R. Beckett, George R. Rossman, Devin L. Schrader: Discovery of Cl-bearing mayenite, Ca12Al14O32Cl2, a new mineral in a CV3 Meteorite. In: 73rd Annual Meteoritical Society Meeting. 2010, S. 5134-5134 (rruff.info [PDF; 82 kB; abgerufen am 29. Juli 2018]).
- Chi Ma, Harold C. Connolly Jr., John R. Beckett, Oliver Tschauner, George R. Rossman, Anthony R. Kampf, Thomas J. Zega, Stuart A. Sweeney Smith and Devin L. Schrader: Brearleyite, Ca12Al14O32Cl2, a new alteration mineral from the NWA 1934 meteorite. In: The American Mineralogiste. Band 96, 2011, S. 1199–1206 (rruff.info [PDF; 539 kB; abgerufen am 7. August 2018]).
- Chi Ma and Alexander N. Krot: DISCOVERY OF A NEW Cl-RICH SILICATE MINERAL, Ca12(Al2Mg3Si7)O32Cl6: AN ALTERATION PHASE IN ALLENDE. In: Annual Meteoritical Society Meeting. Band 77, 2014 (usra.edu [PDF; 256 kB; abgerufen am 26. Juli 2018]).
- Chi Ma and Alexander N. Krot: Adrianite, Ca12(Al4Mg3Si7)O32Cl6, a new Cl-rich silicate mineral from the Allende meteorite: An alteration phase in a Ca-Al-rich inclusion. In: American Mineralogist. In Press, 2018 (minsocam.org [PDF; 1,5 MB; abgerufen am 22. Juli 2018]).
- Hope A. Ishii, Alexander N. Krot, John P. Bradley, Klaus Keil, Kazuhide Nagashima, Nick Teslich, Benjamin Jacobsen, and Qing-Zhu Yin: Discovery, Mineral Paragenesis and Origin of Wadalite in Meteorites. In: American Mineralogist. Band 95, 2010, S. 440–448 (llnl.gov [PDF; 1,4 MB; abgerufen am 30. Juni 2018]).
- Pavla HRŠELOVÁ, Jan CEMPÍREK, Stanislav HOUZAR, Jiří SEJKORA: S,F,Cl-RICH MINERAL ASSEMBLAGES FROM BURNED SPOIL HEAPS IN THE ROSICE-OSLAVANY COALFIELD, CZECH REPUBLIC. In: The Canadian Mineralogiste. Band 51, 2013, S. 171–188 (researchgate.net [PDF; 5,7 MB; abgerufen am 11. August 2018]).
- Victor Victorovich Sharygin: Mineralogy of Ca-Rich Metacarbonate Rocks from Burned Dumps of the Donetsk Coal Basin. 2010, S. 162–170 (researchgate.net [PDF; 563 kB; abgerufen am 30. Juni 2018]).
- Victor Victorovich Sharygin: Mayenite-supergroup minerals from burned dump of the Chelyabinsk Coal Basin. In: Russian Geology and Geophysics. Band 56, 2015, S. 1603–1621 (researchgate.net [PDF; 7,1 MB; abgerufen am 30. Juni 2018]).
- Qiu Ling Feng, Frederic P. Glasser, R. Allen-Howie, Eric E. Lachowski: Chlorosilicate with the 12CaO.7Al2O3 structure and its relationship to garnet. In: Acta Crystallographica Section C. C44, 1988, S. 589–592, doi:10.1107/S0108270187012046.
- Mateusz Dulski, Katarzyna M. Marzec, Joachim Kusz, Irina Galuskina, Katarzyna Majzner & Evgeny Galuskin: Different route of hydroxide incorporation and thermal stability of new type of water clathrate: X-ray single crystal and Raman investigation. In: Scientific Reports. Band 7, 2017 (nature.com [PDF; 3,6 MB; abgerufen am 12. September 2018]).
- A. S. Tolkacheva, S. N. Shkerin, S. V. Plaksin, E. G. Vovkotrub, K. M. Bulanin, V. A. Kochedykov, D. P. Ordinartsev, O. I. Gyrdasova, and N. G. Molchanova: Synthesis of Dense Ceramics of Single-Phase Mayenite (Ca12Al14O32)O. In: Russian Journal of Applied Chemistry. Band 84, 2011, S. 907–911, doi:10.1134/S1070427211060012 (researchgate.net [PDF; 219 kB; abgerufen am 6. Oktober 2018]).
- H. Boysen, I. Kaiser-Bischoff, M. Lerch, S. Berendts, A. Börger, D. M. Trots, M. Hoelzel, A. Senyshyn: Structures and properties of variously doped Mayenite investigated by neutron and synchrotron powder diffraction. In: Zeitschrift für Kristallographie Suppl. Band 30, 2009, S. 323–328 (degruyter.com [PDF; 296 kB; abgerufen am 15. September 2018]).
- Alexander Schmidt: Synthese und Charakterisierung substituierter Mayenitphasen. 2014, S. 1–171 (d-nb.info [PDF; 12,6 MB; abgerufen am 15. September 2018]).
- Mariana I. Bertoni and Thomas O. Masona: Tunable conductivity and conduction mechanism in an ultraviolet light activated electronic conductor. In: Journal of Applied Physics. Band 97, 2005, S. 1–171 (d-nb.info [PDF; 12,6 MB; abgerufen am 15. September 2018]).
- A. N. Christensen: Neutron Powder Diffraction Profile Refinement Studies on Ca11.3Аl14O32.3 and CaCIO (D0. 88H0.12). In: Acta Chemica Scandinavia. A41, 1987, S. 110–112 (actachemscand.org [PDF; 264 kB; abgerufen am 6. Oktober 2018]).
- Tamara Mihajlovic, Christian L. Lengauer, Theodoros Ntaflos, Uwe Kolitsch and Ekkehart Tillmanns: Two new minerals, rondorfite, Ca8 Mg [SiO4] 4 Cl 2, and almarudite, K(O,Na) 2 (Mn,Fe,Mg) 2 (Be,Al) 3 [Si12 O30] and a study of iron-rich wadalite, Ca12[(A18 Si4 Fe2) O32] Cl6, from the Bellerberg (Bellberg) volcano, Eifel, Germany. In: Neues Jahrbuch für Minaralogie Abhandlungen. Band 179, 2004, S. 265–294 (researchgate.net [PDF; 4,7 MB; abgerufen am 30. Juni 2018]).
- Frank Gfeller, Dorotas Rodek, Joachim Kusz, Mateusz Dulski, Viktor Gazeev, Irina Galuskina, Evgeny Galuskin and Thomas Armbruster: Mayenite supergroup, part IV: Crystal structure and Raman investigation of Al-free eltyubyuite from the Shadil-Khokh volcano, Kel’ Plateau, Southern Ossetia, Russia. In: European Journal of Mineralogy. Band 27, 2015, S. 137–143 (psu.edu [PDF; 333 kB; abgerufen am 26. Juli 2018]).
- J. T. S. Irvine, A. R. West: Ca12Al14O33 solid electrolytes doped with zinc and phosphorus. In: Solid State Ionics. Band 41, 1990, S. 896–899, doi:10.1016/0167-2738(90)90147-J.
- Jian Huang, Loredana Valenzano and Gaurav Sant: Framework and Channel Modifications in Mayenite (12CaO·7Al2O3) Nanocages By Cationic Doping. In: Chemistry of Materials. Band 27, 2015, S. 4731–4741, doi:10.1021/acs.chemmater.5b01360.