MIBG-Szintigrafie
Die MIBG-Szintigrafie (Metaiodbenzylguanidin-Szintigrafie, auch Nebennierenmark-Szintigrafie) ist ein nuklearmedizinisches Untersuchungsverfahren (Szintigrafie) des sympathischen Nervensystems. Dazu gehören unter anderem das Nebennierenmark und der Grenzstrang. Die wichtigsten Indikationen der Untersuchung sind die Ortsbestimmung eines Phäochromozytoms, Staging und Therapiebeurteilung eines Neuroblastoms, aber auch die Differentialdiagnostik von Parkinson-Krankheit und Multisystematrophie. MIBG kommt, mit 131Jod markiert, auch für die Therapie in Frage.
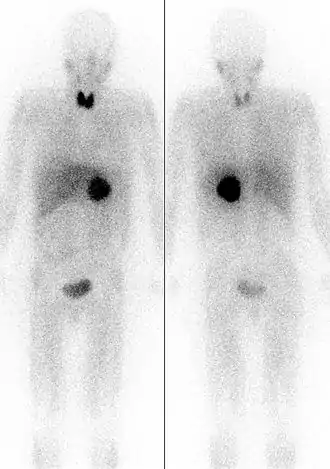
Links: von vorne. Rechts: von hinten.
Anwendung
Indikationen
Die wichtigsten Indikationen der Untersuchung liegen im Bereich der Onkologie. Sie dient der Feststellung und Lokalisierung sowie der Stadienbestimmung (Staging) und Verlaufskontrolle folgender Tumoren: Phäochromozytome, Neuroblastome, Ganglioneuroblastome, Ganglioneurome, Paragangliome, Karzinoide, medulläre Schilddrüsenkarzinome und Merkelzell-Tumoren.
Die Spezifität der Untersuchung für Tumoren des sympathischen Nervensystems wird mit 100 % angegeben, während die Sensitivität zum Nachweis einzelner Herde eines Neuroblastoms bei 80 % und für die Richtigkeit des Staging bei 90 bis 95 % liegt. Es gibt MIBG-negative Neuroblastome und sehr kleine Herde können dem Nachweis entgehen.[1]
Da 131Iod-MIBG auch zur Behandlung dieser Tumoren eingesetzt wird, kann die Untersuchung zur vorbereitenden Bestimmung der notwendigen Dosis (Dosimetrie) beziehungsweise zur Feststellung eines Therapieerfolges im Verlauf eingesetzt werden.
Indikationen außerhalb der Onkologie sind Funktionstests des Nebennierenmarks bei Hyperplasie sowie Untersuchungen der sympathischen Innervation von Herzmuskel, Speicheldrüsen und Lunge. Da beim idiopathischen Parkinson-Syndrom (Parkinson-Krankheit) die sympathische Innervation des Herzens regelhaft vermindert ist, während sie bei den Multisystematrophien normal ist, kann die MIBG-Szintigrafie zur Unterscheidung dieser beiden Krankheitsbilder herangezogen werden.[2][3]
Kontraindikationen
Eine Schwangerschaft gilt mit wenigen Ausnahmen als absolute Kontraindikation für nuklearmedizinische Untersuchungen, Stillzeit als relative Kontraindikation. Nach einer MIBG-Szintigrafie mit 123Iod soll die Stillende für 48 Stunden die Milch abpumpen und verwerfen. Nach einer Untersuchung mit 131Iod soll abgestillt werden.
Untersuchungprinzip und Durchführung
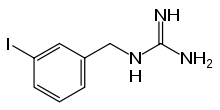
Metaiodbenzylguanidin (MIBG, Iobenguan) ist eine Verbindung aus der Benzylgruppe von Bretylium und der Guanidin-Gruppe von Guanethidin. Es wurde in den frühen 1980er Jahren entwickelt, um Tumoren des Nebennierenmarks sichtbar zu machen. Es ähnelt strukturell Noradrenalin und wird über einen aktiven Mechanismus in neuroendokrine Zellen aufgenommen und in neurosekretorischen Granula gespeichert.
MIBG kann sowohl mit 131I als auch mit 123I markiert werden (siehe Liste der Iod-Isotope) und für Experimente mit Kleintieren auch mit 125I. 123Iod verursacht höhere Kosten, da es im Zyklotron hergestellt wird, hat aber günstigere physikalische Eigenschaften (kürzere Halbwertszeit, fehlende Beta-Komponenete der Strahlung, weniger harte Gammastrahlung). Bei höherer verwendbarer Aktivität resultiert eine bessere Bildqualität bei gleichzeitig niedrigerer Strahlenexposition des Patienten.
Einige Stunden vor der Gabe des Tracers sollte die Schilddrüse mit Perchlorat blockiert werden. Die Dauer der Blockade richtet sich nach dem verwendeten Isotop.
Die Aufnahme von MIBG ins Nebennierenmark wird durch eine Reihe von Arzneimitteln und Wirkstoffgruppen beeinflusst, die daher – je nach Substanz oder Substanzklasse – etwa ein bis vier Wochen vor der Untersuchung abgesetzt werden sollen. Dazu gehören: Opioide, Kokain, Tramadol, trizyklische Antidepressiva, Sympathomimetika, Labetalol, Metoprolol, Amiodaron, Reserpin, Bretylium, Guanethidin, Calciumantagonisten, ACE-Hemmer, Phenothiazine, Thioxanthene.

Bei Verwendung von 123I-MIBG werden planare Ganz- oder Teilkörperaufnahmen etwa 4 und 24 Stunden nach der intravenösen Gabe des Tracers angefertigt, nach 24 Stunden auch SPECT-Aufnahmen der interessierenden Körperregion – meist des Oberbauches. Mit 131I-MIBG erfolgen die Aufnahmen in der Regel nach etwa 24 und 48 Stunden. Für SPECT-Aufnahmen sind dann oft sehr lange Aufnahmezeiten bei unbefriedigender Bildqualität notwendig.
Die Aufnahme des MIBG in verschiedene Organe hängt von deren Katecholamin-Ausscheidung und adrenergen Innervation ab. Nach intravenöser Gabe erscheinen etwa 50 % der verwendeten Aktivität innerhalb von 24 Stunden im Urin. MIBG wird normalerweise vor allem von der Leber aufgenommen. Ein niedrigerer Uptake findet in Milz, Lunge, Speicheldrüsen, Schilddrüse, Skelett- und Herzmuskel statt. Normale Nebennieren sind üblicherweise nicht sichtbar, können aber in bis zu 15 % der Fälle zumindest schwach anreichern. MIBG wird in unterschiedlichem Ausmaß in Nasenschleimhaut, Lunge, Gallenblase, Dickdarm, Gebärmutter und temperaturabhängig im braunen Fettgewebe aufgenommen. Freies Iod kann im Magen-Darm-Trakt und in der Schilddrüse erscheinen. Knochen reichern physiologischerweise nicht an, so dass vermehrte Aktivität im Knochen als Beteiligung von Knochen- oder Knochenmark (Metastasen) angesehen werden muss.
Falsch negative Befunde können bei sehr kleinen Herden, bei Herden nahe am Primärtumor, an großen Metastasen oder in Regionen mit hoher physiologischer Speicherung auftreten. Weitere Gründe können im Tumor selbst liegen (Heterogenität, Nekrosen, Fehlen von neurosekretorischen Granula, fehlender Traceraufnahme des Tumors) oder durch pharmakologische Blockierungen bedingt sein.[1]
Da bei der Parkinson-Krankheit die sympathische Innervation des Herzens vermindert ist, während sie bei den Multisystematrophien erhalten ist, kann die MIBG-Szintigrafie des Brustkorbs bereits in einer frühen Phase der Krankheitserscheinungen zur Differentialdiagnostik dieser beiden neurologischen Krankheitsbilder herangezogen werden. Eine verminderte Anreicherung des MIBG im Herzmuskel bei erhaltener Anreicherung im übrigen Mediastinum (vermindertes Herz/Mediastinum-Verhältnis) spricht dabei für den idiopathischen Morbus Parkinson, ein normales Herz/Mediastinum-Verhältnis für ein atypisches Parkinson-Syndrom.[2][3]
Risiken und Nebenwirkungen, Strahlenbelastung
Da aufgrund niedriger Aktivität pro Gewicht (spezifische Aktivität) im Vergleich mit den meisten anderen nuklearmedizinischen Untersuchungen relativ viel Tracer benötigt wird, können pharmakologische Wirkungen des MIBG auftreten. Nach Injektion werden gelegentlich Herzrasen, Übelkeit, Blässe und Bauchschmerzen beobachtet. Wenn der Tracer sehr langsam – über mindestens 5 Minuten – verabreicht wird, sind diese Nebenwirkungen sehr selten.
Die Strahlenexposition beträgt bei der Anwendung von 400 MBq 123I-MIBG etwa 5 mSv. Als kritisches Organ gilt die Leber mit einer Organdosis von etwa 27 mSv. Bei der Anwendung von 80 MBq 131I-MIBG beträgt die Äquivalentdosis (Ganzkörper) etwa 11 mSv, die Organdosis der Leber etwa 66 mSv. Die erforderliche Aktivitätsmenge wird bei Kindern je nach Körpergewicht reduziert.[1]
Alternativen
Phäochromozytom
Die Diagnose des Phäochromozytoms gelingt meist bereits mit der Bestimmung der Katecholamine und ihrer Abbauprodukte im Blutplasma und Urin. Zur Ortsbestimmung können Sonografie, Computertomografie und Magnetresonanztomografie verwendet werden. Die Stärke der MIBG-Szintigrafie liegt im Ausschluss weiterer Lokalisationen.
Bei metastasiertem Phäochromozytom können entdifferenzierte Metastasen, die sich dem Nachweis in der MIBG-Szintigrafie entziehen, mittels 18F-FDG-Positronen-Emissions-Tomografie (PET) entdeckt werden. Andere geeignete PET-Radiopharmaka sind 11C-Noradrenalin oder -Hydroxyephedrin. Der besseren Ortsauflösung der PET stehen die logistischen Schwierigkeiten gegenüber, da 11C mit einer Halbwertszeit von nur etwa 20 Minuten in einem Zyklotron am Untersuchungsort hergestellt werden muss, während 18F-Pharmaka mit einer Halbwertszeit von knapp zwei Stunden zum Untersuchungsort transportiert werden können.
Neuroblastom
Die Diagnose erfolgt in den Frühstadien meist zufällig mittels Ultraschall, Computertomografie (CT) oder Magnetresonanztomografie (MRT), die aus anderen Anlässen angefertigt wurden. Die Skelettszintigrafie kann zur Unterscheidung zwischen Knochenmarks- und Knochenmetastasen herangezogen werden.[1]
Andere neuroendokrine Tumoren
Viele neuroendokrine Tumoren lassen sich auch mittels Somatostatin-Rezeptor-Szintigrafie darstellen. Sensitiver, und damit aktuell für G1/G2- und ggf. G3-NETs (nicht G3-NEC) die nuklearmedizinische Bildgebung der Wahl, ist ein DOTA-basiertes PET/CT (DOTATATE, Edotreotid). Die FDG-PET kann insbesondere bei Tumoren mit niedriger Proliferationsrate G1/G2 mit einem Ki67 < 20 % falsch negativ sein, bei niedrig differenzierten neuroendokrinen Karzinomen (NEC) G3 mit hoher Proliferationsrate allerdings hilfreich zum Staging sein.
Parkinson-Krankheit
Die Diagnose der Parkinson-Krankheit erfolgt meist nach dem klinischen Bild oder durch testweise Gabe von Parkinsonmitteln. Weitere nuklearmedizinische Methoden sind die Dopamin-Rezeptor-Szintigrafie und die Dopamin-Transporter-Szintigrafie. Der Vorteil der MIBG-Szintigrafie liegt in der einfachen Durchführbarkeit und der Abgrenzung des Morbus Parkinson zu den Multisystematrophien.
Literatur
- Torsten Kuwert: Nebennierenmark. In: Torsten Kuwert, Frank Grünwald, Uwe Haberkorn, Thomas Krause (Hrsg.): Nuklearmedizin. Stuttgart 2008, ISBN 978-3-13-118504-4.
- Emilio Bombardieri u. a. 131I/123I-Metaiodobenzylguanidine (MIBG) Scintigraphy. Leitlinie (2003) der European Association of Nuclear Medicine (EANM); PDF (35 kB)
- S1-Leitlinie mIBG-Szintigraphie bei Kindern der Deutschen Gesellschaft für Nuklearmedizin (DGN). In: AWMF online (Stand 2013)
Einzelnachweise
- M. Schmidt u. a. DGN-Handlungsempfehlung (S1-Leitlinie) mIBG-Szintigraphie bei Kindern. Aktualisierte Fassung (2013) der deutschen Übersetzung (2002) der Leitlinie der EANM (2002). (PDF; 392 kB) Abgerufen am 21. September 2019.
- S. Braune, M. Reinhardt, R. Schnitzer, A. Riedel, C. H. Lücking: Cardiac uptake of [123I]MIBG separates Parkinson's disease from multiple system atrophy. In: Neurology. Band 53, Nummer 5, September 1999, S. 1020–1025, PMID 10496261.
- A. Lipp, P. Sandroni, J. E. Ahlskog u. a.: Prospective differentiation of multiple system atrophy from Parkinson disease, with and without autonomic failure. In: Arch. Neurol.. 66, Nr. 6, Juni 2009, S. 742–750. doi:10.1001/archneurol.2009.71. PMID 19506134. PMC 2838493 (freier Volltext).