Somatostatin-Rezeptor-Szintigrafie
Die Somatostatin-Rezeptor-Szintigrafie, auch Octreotid-Scan genannt, ist ein bildgebendes Verfahren, das im Wesentlichen in der Diagnostik von neuroendokrinen Tumoren (NET) verwendet wird.
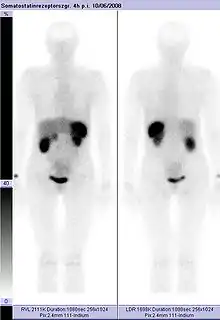
Normale Aktivität in Leber, Galle, Milz, Nieren und Harnblase
Durchführung und Funktionsprinzip
Die Somatostatin-Rezeptor-Szintigrafie wird mit einem speziellen Radiopharmakon durchgeführt. Dieses besteht aus drei chemisch miteinander verbundenen Komponenten:
- Einem starken Komplexbildner, wie beispielsweise 1,4,7,10-Tetraazacyclododecan-1,4,7,10-tetraessigsäure, genannt DOTA oder Diethylentriaminpentaessigsäure genannt DTPA, der an
- ein Somatostatin-Analogon, wie beispielsweise Octreotid gebunden (konjugiert) ist und
- einem kurzlebigen Radioisotop, das Gammastrahlung emittiert, wie beispielsweise 111Indium, das eine Halbwertszeit von 2,8 Tagen aufweist; zur Anwendung an PET-Geräten wird nunmehr auch eine Markierung mit dem Positronenstrahler 68Gallium angeboten.
Unmittelbar vor der Injektion wird das Konjugat Komplexbildner–Somatostatin-Analogon mit dem Radioisotop, meist 111Indium, beladen. Die freien Indiumionen werden durch den Komplexbildner vollständig chelatisiert. Das so hergestellte Radiopharmakon wird intravenös appliziert und verteilt sich dabei im Blutkreislauf des Patienten. An Zellen, die entsprechende Somatostatin-Rezeptoren besitzen, reichert sich das Radiopharmakon an. Dies sind unter anderem der Hypothalamus, die Großhirnrinde und der Hirnstamm, sowie eine Reihe von Tumoren und deren Metastasen. Etwa vier Stunden nach der Verabreichung des Radiopharmakons wird eine erste Aufnahme durchgeführt. Die Dauer beträgt etwa eine Stunde. Das angereicherte Radiopharmakon zerfällt. Die dabei abgestrahlte Gammastrahlung durchdringt das umgebende Gewebe und wird mittels einer Gammakamera detektiert und per Bildverarbeitung zu einem Bild zusammengesetzt. Die Anzahl der Zerfallsereignisse ist in den Bereichen der Anreicherung besonders hoch. Am nächsten Tag wird meist eine zweite Szintigrafie durchgeführt. (siehe auch: Szintigrafie und Single Photon Emission Computed Tomography)
Das einzige in Europa und in den USA zugelassene Radiopharmakon für die Somatostatin-Rezeptor-Szintigrafie war 111Indium-Pentetreotid (= 111Indium-DTPA-[D-Phe1]-Octreotid, OctreoScan®).[1] Die verabreichte Aktivität liegt üblicherweise zwischen 100 und 200 MBq. Die Strahlenexposition (Äquivalentdosis) liegt bei der Verwendung von 110 MBq 111Indium bei etwa 10 mSv.[2]
Mitte 2008 ist mit 99mTc-Tektrotyd ein weiteres Radiopharmakon zugelassen worden.[3] Aufgrund der günstigeren physikalischen Eigenschaften des Technetium-99m können höhere Aktivitäten verwendet werden, was zu besserer Bildqualität und höherer Sensitivität gegenüber der Untersuchung mit Indium-Octreotid führt.[4] Als zu verabreichende Aktivität wird vom Hersteller 370 bis 925 MBq angegeben.
Anwendung
Gastro-entero-pankreatische neuro-endokrine Tumoren (GEP-NET) sind mit den üblichen bildgebenden Verfahren (Sonografie, Endoskopie, Computertomographie und Magnetresonanztomographie) nur schwer nachzuweisen. Durch die Exprimierung von Somatostatin-Rezeptoren können diese Tumoren mittels Somatostatin-Rezeptor-Szintigrafie lokalisiert werden.[5] In verschiedensten klinischen Studien wurde der Einsatz der Somatostatin-Rezeptor-Szintigrafie an einer großen Anzahl von Patienten mit den unterschiedlichsten Tumoren getestet. Die Sensitivität bei neuroendokrinen Tumoren ist – mit Ausnahme von Insulinomen sehr hoch.[6]
Obwohl auch andere Tumorzellen, wie beispielsweise Brustkrebs, verstärkt Somatostatin-Rezeptoren exprimieren, ist in diesen Fällen die Sensitivität erheblich geringer und die Ergebnisse weniger eindeutig.[7]
Auch bei kolorektalen Karzinomen (Darmkrebs) wurde ein antiproliferativer Effekt von Octreotid nachgewiesen werden. Allerdings exprimieren nur etwa 40 % der kolorektalen Karzinome Somatostatinrezeptoren.[8]
Entwicklungsgeschichte
1981 wurden erste Ergebnisse über die Verteilung von Somatostatin-Rezeptoren veröffentlicht.[9][10] Von der gleichen Arbeitsgruppe wurden 1985 das erste Somatostatin-Analogon Octreotid synthetisiert und in vivo getestet.[11] Die ersten szintigrafischen Untersuchungen im Tiermodell wurden 1990 durchgeführt. Dazu wurde die Struktur des Octreotids so verändert, dass in Position 3 das Phenylalanin durch Tyrosin ersetzt wurde. Die Hydroxygruppe des Tyrosins wurde unmittelbar vor der Injektion zur Markierung durch das radioaktive Isotop 123Iod ersetzt.[12] 1991 wurde die erste Szintigrafie mit 111Indium und Octreotid im Tiermodell beschrieben.[13]
Eine neue, allerdings noch nicht zugelassene, Entwicklung ist der Einsatz von 68Gallium-DOTATOC als Radiopharmakon. Hierbei wird an Stelle von 111Indium das Radioisotop 68Gallium verwendet. Es handelt sich dabei nicht mehr um ein szintigrafisches Verfahren, sondern um eine Positronen-Emissions-Tomografie.
Einzelnachweise
- T. M. Behr u. a.: Nuklearmedizinische Diagnostik und Therapie neuroendokriner Tumoren des Gastrointestinaltraktes einschließlich des Karzinoides. In: Nuklearmediziner 26/2003, S. 121–33.
- M. Hofmann, T. Krause. Therapie mit rezeptoraffinen Peptiden. In: Torsten Kuwert, Frank Grünwald, Uwe Haberkorn, Thomas Krause (Hrsg.) Nuklearmedizin. Stuttgart 2008, ISBN 978-3-13-118504-4
- Österreichisches Bundesamt für Sicherheit im Gesundheitswesen (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 60 kB)
- M. Gabriel et al. An intrapatient comparison of 99mTc-EDDA/HYNIC-TOC with 111In-DTPA-octreotide for diagnosis of somatostatin receptor-expressing tumors. J Nucl Med. 2003 May;44(5):708-16. PMID 12732671
- In-111-Octreoscan (PDF; 122 kB) Deutsche Gesellschaft für Nuklearmedizin
- E. P. Krenning u. a.: Somatostatin receptor scintigraphy with [111In-DTPA-D-Phe1]- and [123I-Tyr3]-octreotide: the Rotterdam experience with more than 1000 patients. In: Eur J Nucl Med 20/1993, S. 716–31.
- K. Joseph u. a.: Receptor Scintigraphy with 111In-Pentetreotide for Endocrine Gastroenteropancreatic Tumors. In: Horm Metab Res 27/1993, S. 28–35.
- J. K. Seifert u. a.: 111-Indium-DTPA-Octreotid-Szintigraphie bei kolorektalen Lebermetastasen. In: Langenbeck's Archives of Surgery 382/1997, S. 332–36.
- J. C. Reubi u. a.: High affinity binding sites for a somatostatin-28 analog in rat brain. In: Life sciences 28/1981, S. 2191–8.
- J. C. Reubi u. a.: Specific high affinity binding sites for somatostatin-28 on pancreatic beta-cells: differences with brain somatostatin receptors. In: Endocrinology 110/1982, S. 1049–51.
- J. C. Reubi: A somatostatin analogue inhibits chondrosarcoma and insulinoma tumour growth. In: Act Endol 109/1985, S. 108–14
- W. H. Bakker u. a.: Receptor Scintigraphy with a Radioiodinated Somatostatin Analogue: Radiolabelling, Purification, Biologic Activity, and In Vivo Application in Animals. In: J Nucl Med 31/1990, S. 1501–9.
- W. H. Bakker u. a.: In Vivo Use of Radioiodinated Somatostatin Analogue: Dynamics, Metabolism, and Binding to Somatostatin Receptor-Positive Tumors in Man. In: J Nucl Med 32/1991, S. 1184–9.
Literatur
- M. Fischer: Entwicklung eines Radiopharmakons zur Darstellung von Insulinomen im Tiermodell auf Basis des Inkretinhormons GLP-1(7-36)amid und seiner Analoga. Dissertation, Philipps-Universität Marburg, 2003.
Weblinks
- Somatostatin-Rezeptor-Szintigrafie Universitätsklinikum Heidelberg
- Octreotid-Scan bei Kindern