Hornträger
Die Hornträger (Bovidae) oder Rinderartigen sind eine Familie der Wiederkäuer, die wiederum zu den Paarhufern zählen. Sie bilden die gegenwärtig arten- und formenreichste Gruppe innerhalb der Paarhufer und der Huftiere und enthalten unter anderem die Rinder, Schafe, Ziegen und verschiedenste Antilopenformen. Die Familie kommt sowohl in Eurasien als auch in Afrika und Nordamerika natürlich vor. Domestizierte Formen erreichten auch Australien und Südamerika. Sehr häufig sind Hornträger in offenen Landschaften anzutreffen, viele Arten bewohnen zudem Wälder und Feuchtgebiete sowie Felslandschaften. Je nach Landschaftstyp haben sich unterschiedliche Sozialsysteme herausgebildet, die von territorial einzelgängerisch, häufig standorttreu lebenden Tieren bis hin zu großen, umherwandernden Herden reichen. Die Fortpflanzung ist demzufolge abhängig von der Lebensweise der einzelnen Arten. So gibt es monogame Paarbildungen wie auch polygyne Vermehrungsstrategien. Insgesamt ernähren sich Hornträger von einer Vielzahl an Pflanzen, von harten Gräsern bis zu weichen Blättern und Früchten, gelegentlich werden auch tierische Reste verspeist.
| Hornträger | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Alpensteinbock (Capra ibex) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Bovidae | ||||||||||||
| Gray, 1821 |
Generell lassen sich innerhalb der Hornträger zwei große Formengruppen unterscheiden. Zur einen gehören die Rinder, Büffel und Kudus, zur anderen die Ziegen, Schafe, Antilopen und Gazellen. Diese Zweiteilung wurde bereits Anfang des 20. Jahrhunderts bemerkt, die Forschungsgeschichte zu den Hornträgern als einheitliche Gruppe reicht aber bis in die erste Hälfte des 19. Jahrhunderts zurück. In der Vergangenheit war die genaue systematische Gliederung der Gruppe Gegenstand zahlreicher Debatten, erst molekulargenetische Analyseverfahren, die gegen Ende des 20. Jahrhunderts aufkamen, ergaben ein geschlossenes Bild. Nicht unumstritten ist eine Revision der Familie aus dem Jahr 2011, die zu einer Verdopplung der Anzahl der heutigen Arten führte. Diese Neubetrachtung der Hornträger stieß teilweise auf Ablehnung, fand aber auch mehrfach Unterstützer, die sie als notwendig erachteten. Aus stammesgeschichtlicher Sicht sind die Hornträger relativ jung. Die ältesten Nachweise datieren in das Untere Miozän vor etwa 18 Millionen Jahren.
Merkmale
Habitus
.jpg.webp)

Insgesamt gehören rund 280 Arten zu dieser Familie, deren Variationsbreite vom kleinen Kleinstböckchen (Neotragus pygmaeus) mit einer Kopf-Rumpf-Länge von rund 40 cm und einem Gewicht von 2 kg bis zum riesigen Bison (Bos bison) mit einer Körperlänge von 380 cm und einem Gewicht von 1000 kg reicht. Äußerliches Kennzeichen aller Arten stellen die Hörner dar, von denen fast immer zwei an der Zahl auftreten (eine Ausnahme ist die Vierhornantilope, unter den domestizierten Formen verfügt auch das Jakobsschaf über vier Hörner) und in ihrer Form artspezifisch gestaltet sind. Als extrem formenreiche Gruppe haben die Hornträger einen relativ variablen Körperbau herausgebildet, der an die jeweiligen Landschaftsverhältnisse angepasst ist. Tendenziell sind Offenlandarten größer als Bewohner geschlossener Landschaften und besitzen auch größere und längere Hörner. Ein Geschlechtsdimorphismus ist bei herdenbildenden Arten stärker entwickelt als bei einzelgängerischen. Offenlandtiere besitzen auch häufig einen längeren Körper und langschmale Gliedmaßen mit etwa gleich entwickelten Vorder- und Hinterbeinen, was als Anpassung an eine schnelle Fortbewegung aufzufassen ist. Bei Waldbewohnern sind die Hinterbeine generell stärker ausgebildet und die Vorderbeine deutlich kürzer, wodurch die Kruppe eine erhöhte Lage aufweist. Darüber hinaus ist ihr Körper in der Regel kürzer, was durch die beengteren Platzverhältnisse in Wäldern bedingt wird. Die Fellfärbung erscheint variabel vom eintönigen Braun bis hin zu einzelnen Flecken und Streifen, die häufig einen tarnenden Charakter haben. Der Schwanz kann kurz und flach, aber auch lang und rund sein und ein büschelartiges Ende aufweisen. Bei vielen Arten treten Kehlsäcke auf, einige verfügen über einen Nasenspiegel.[1][2]
Hörner
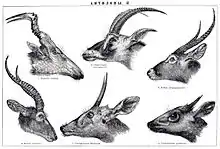
Die Hörner, deren Länge von 2 cm beim Kleinstböckchen bis über 1,50 m bei der Säbelantilope (Oryx dammah) oder der Riesen-Elenantilope (Taurotragus derbianus) variiert, sind bei einigen Arten nur bei den Männchen ausgebildet, bei den meisten aber bei beiden Geschlechtern, wobei die der Weibchen dann häufig kleiner und weniger kräftig gebaut sind. Die Ursachen für die Ausbildung der Hörner auch bei weiblichen Tieren sind nicht vollständig geklärt, angenommen werden eine Verteidigung gegen Fressfeinde, Nahrungskonkurrenz oder ein Tarneffekt im innerartlichen Wettstreit, um ein männliches Tier vorzutäuschen. Da häufig behörnte Weibchen eher bei großen und auffälligen Arten der Offenlande und weniger bei versteckt im Wald lebenden Formen mit tarnendem Fellkleid auftreten, wird einigen Untersuchungen zufolge der Schutz vor Raubtieren als einer der treibenden Faktoren angesehen.[3][2] Es handelt sich bei den Hörnern um knöcherne Auswüchse des Schädels, die im Innern aus spongioser Substanz oder aus Hohlräumen bestehen und am unteren Rand eine raue Kante besitzen. Sie entstehen aus einem Verknöcherungszentrum in der Haut (Os cornu) und wachsen von unten nach oben, wodurch sich die typische spitze Struktur der Hörner herausbildet. Das einzelne Horn ist bei den meisten Arten über einen kurzen Knochenzapfen (pedicle) mit dem Stirnbein verbunden, Ausnahmen bilden einige Vertreter der Ducker (Cephalophus) sowie die Vierhornantilope (Tetracerus quadricornis) und die Nilgauantilope (Boselaphus tragocamelus). Der Zapfen erreicht nie die Ausmaße des knöchernen Horns, sondern bleibt immer dünner als dieses. Umgeben sind die Hörner von einer Scheide aus Horn (Keratin), die innen hohl ist (was den Hornträgern unter anderem den alten Namen „Cavicornia“ („hohle Hörner“) einbrachte). Der Überzug setzt an der unteren Kante des knöchernen Horns an und überragt dieses immer, er wächst von innen nach außen.[4] Anders als bei Hirschen und Gabelhornträgern sind die Stirnwaffen der Hornträger niemals verzweigt, zudem werden die Hörner weder wie bei den Geweihen der Hirsche jährlich abgeworfen noch unterliegt die Hornscheide wie bei den Gabelböcken einer jahreszyklischen Erneuerung. Vielmehr wachsen sie ein Leben lang und regenerieren nicht bei Beschädigung oder Bruch. Die Hörner verlaufen teils nahezu gerade wie bei den Klippspringern (Oreotragus) oder sind gebogen wie beim Wisent (Bos bonasus) beziehungsweise auf vielfältige Weise gewunden und geschwungen. Bei einigen Arten können sie (bezogen jeweils auf das rechte Horn) im Uhrzeigersinn (homonym oder invers) oder gegen den Uhrzeigersinn (heteronym oder normal) gedreht sein. Solche Torsionen treten einerseits entlang der Längsachse der Hörner auf, beispielsweise bei der Elenantilope (Taurotragus oryx), ohne deren geraden Verlauf zu beeinflussen, andererseits kommen sie auch bei gebogenen Hörnern vor wie bei der Impala (Aepyceros melampus) oder bilden offene Spiralen, etwa beim Kap-Großkudu (Strepsiceros strepsiceros). In jedem Fall entstehen die Windungen durch unterschiedliche Wachstumsraten in den Hornscheiden.[5][2][6]
Skelettmerkmale


Weitere charakteristische Merkmale finden sich im Gebiss- und Skelettbau. Im Gebiss fehlen die oberen Schneidezähne, der obere Eckzahn sowie der erste Prämolar im Ober- und Unterkiefer. Nur einige frühe, heute ausgestorbene Formen besaßen noch einen kleinen oberen Eckzahn, vergrößerte Eckzähne, wie sie bei einigen Hirschen und bei den Moschustieren auftreten, waren bei Hornträgern nie ausgebildet. Der untere Eckzahn ähnelt den Schneidezähnen (incisiform). Die standardisierte Zahnformel der Hornträger lautet: Bei manchen Arten fehlt aber teilweise auch der zweite Prämolar. Generell sind die Prämolaren molarisiert, ähneln also den hinteren Backenzähnen. Diese werden durch ein Kauflächenmuster aus längsverlaufenden, mondsichelartigen (selenodonten) Zahnschmelzleisten gekennzeichnet. Sie sind zudem deutlich hochkroniger (hypsodont) als bei den Hirschen. Die Zahnreihe endet in der Regel unter der Orbita. Die Stirnhöhlen sind bei einem größeren Teil der Hornträger stark zurückgebildet.[7] Wie bei den Paarhufern typisch verläuft die Mittelachse der Hand und des Fußes durch die Strahlen III und IV. Beide Strahlen sind im Bereich der Metapodien miteinander verwachsen und bilden das Kanonenbein. Die inneren und äußeren Metapodien (Strahlen II und V), also seitlich am Hauptstrahl (Kanonenbein) des Mittelfußes oder der Mittelhand ansetzende Knochen, sind bei den Hornträgern im Vergleich zu den Hirschen stärker reduziert, ebenso die Anzahl der Finger- und Zehenglieder, die sich zumeist auf nur ein oder zwei beläuft. Die jeweiligen Endphalangen tragen aber noch Hufe.[5][8] Alle Hornträger besitzen somit nur ein Paar funktionaler Zehen je Fuß (Strahlen III und IV). Anhand des Aufbaus der Füße können Bewohner geschlossener und offener Habitate unterschieden werden. Erstere haben weiter auseinander gespreizte Zehen, die einzelnen Zehenglieder (Phalangen) sind zudem in einer mehr oder weniger linear verlaufenden Reihe angeordnet, so dass der Fuß dichter am Boden orientiert ist. Bei letzteren stehen die Zehen eng beieinander, die mittlere Phalanx setzt gegenüber der vordersten Hufphalanx in einem steilen Winkel an und ragt fast senkrecht zum Erdboden auf. Das Merkmal ist besonders extrem bei den Klippspringern ausgebildet.[1][2][6]
Verbreitung

Hornträger kommen in Eurasien und Afrika sowie in Nordamerika natürlich vor, in Südamerika gab es nie wilde Hornträger, ebenso wenig in Australien. Domestizierte Arten sind aber in nahezu alle Länder gebracht worden. Die von den Hornträgern genutzten Landschaften variieren je nach den Ansprüchen der Arten erheblich und verteilen sich vom Meeresspiegelniveau bis in Gebirgslagen und Hochländer um 6000 m. Die meisten Hornträger bewohnen offenes Gelände. So bieten die afrikanischen Savannen wie auch die felsigen Gebirge Asiens jeweils zahlreichen Arten einen idealen Lebensraum. Andere Vertreter sind in wüstenartigen Regionen, gemäßigteren Steppen und Grasländern, im Wald oder in Feuchtgebieten vorzufinden. Viele Arten bevorzugen ungestörte Landschaftsräume, andere kommen auch mit stärker vom Menschen beeinflussten Gebieten zurecht.[2]
Lebensweise
Territorial- und Sozialverhalten


Innerhalb der Hornträger haben sich verschiedene soziale Organisationstypen herausgebildet, die in Abhängigkeit vom natürlich vorgegebenen Lebensraum bestehen. Folgende generelle Formen können unterschieden werden:
- einzelgängerische und territoriale Tiere wie Dikdiks, Klippspringer und Oribis; diese leben meist in monogamen Paaren und markieren ihre Reviere; beide Geschlechter ähneln sich stark, Jungtiere verlassen das Gebiet der Elterntiere nach der Geschlechtsreife und gründen eigene Paare und Territorien.
- einzelgängerische und nichtterritoriale Tiere wie Buschböcke; eher selten bei Hornträgern; die Aktionsräume mehrerer Individuen überschneiden sich meist, allerdings gibt es häufig Kerngebiete ohne Überlappung, die ausschließlich von einzelnen Tieren genutzt werden; einige Männchen können auch territoriales Verhalten zeigen.
- herdenbildende und territoriale Tiere wie Wasserböcke, Litschis, Topis und einige Antilopen; die häufigste Form des Sozialsystems unter Hornträgern; die Tiere bilden umherziehende Herden aus Weibchen und Jungtieren, während Männchen generell territorial sind; jungadulte Männchen trennen sich von ihrer Ursprungsgruppe und leben anfangs in Junggesellengruppen oder mit einem Weibchen zusammen, bevor sie eigene Reviere gründen; bei Arten mit sehr ausgedehnten Streifgebieten und dadurch weiten Wanderwegen etablieren Männchen Territorien nur bei längeren Aufenthalten.
- herdenbildende und nichtterritoriale Tiere; sehr häufig bei den Rindern und Ziegenartigen, aber auch bei den Elenantilopen; hier erfolgt die Fortpflanzung der Männchen durch Dominanz und nicht durch Territorialität, während der fortpflanzungsfreien Zeit leben die Geschlechter getrennt.
Wie bei vielen Säugetieren besteht ein positiver Zusammenhang zwischen Körpergröße und Größe des Aktivitätsraumes. Das Batesböckchen (Neotragus batesi) mit einem Gewicht von rund 2,5 kg hat Territorien von 0,01 bis 0,03 km², bei der Uganda-Grasantilope (Kobus thomasi), die bis 94 kg wiegt, beträgt die Größe der Territorien zwischen 3 und 20 km². Darüber hinaus ist die Größe der Streifgebiete von vielen natürlichen Faktoren abhängig. In der Regel gibt die Verfügbarkeit von Nahrung den Ausschlag dafür, wie ausgedehnt der Aktivitätsraum ist und ob Tiere ortstreu bleiben oder wandern, wobei umherziehende Tiere überwiegend Herden formieren. Solche Gruppenbildungen können wiederum in zwei prinzipielle Typen unterschieden werden. So gibt es Herden mit zusammenhängenden oder teils locker verstreuten Streifgebieten; die jeweilige Nutzung der einzelnen Bereiche erfolgt in einer mehr oder weniger festgelegten Reihenfolge in Abhängigkeit von den Jahreszeiten. Die Herden des Kaffernbüffel (Syncerus caffer) beispielsweise haben Aktionsräume von 100 bis teilweise über 1000 km². Darüber hinaus gibt es nomadisch lebende Verbände mit extrem großen Aktionsräumen wie bei der Mongolischen Gazelle (Procapra gutturosa), die Wanderungen über Gebiete von bis zu 32.000 km² unternehmen. Die Aktionsräume werden ohne feste Reihenfolge durchwandert, meist auf der Suche nach den besten Nahrungsplätzen, die durch einzelne Niederschlagsereignisse entstehen. Ein besonderes Phänomen bei herdenbildenden Tieren stellen die mitunter extrem großen Herdenverbände dar, so beim Serengeti-Weißbartgnu (Connochaetes mearnsi) oder bei der Westlichen Thomson-Gazellen (Eudorcas nasalis), die Tausende von Tieren umfassen können und beispielsweise in der Serengeti eine jährliche Wanderung von mehr als 450 km unternehmen.[9][10][2]
Ernährung

Die Nahrungssuche nimmt einen Großteil der täglichen Aktivitäten ein. Kleine Arten wie Dikdiks und Griesböckchen tendieren zu häufigen, aber sehr kurzen Fressphasen, die großen Rinder dagegen zu einer kontinuierlichen, länger anhaltenden Nahrungsaufnahme. In beiden Fällen ist die Gesamtdauer der täglichen Fresszeit aber durchschnittlich gleich. Prinzipiell sind Hornträger Pflanzenfresser, allerdings werden von einigen Arten gelegentlich auch Vögel, Reptilien und Amphibien verzehrt. Innerhalb der Hornträger sind drei grundlegende Ernährungsstrategien bekannt:
- spezialisierte und selektive Konsumenten von weicher Pflanzennahrung (browser) wie die Dikdiks, Ducker, Buschböcke, Klippspringer und Kudus; sie stellen rund 40 % der Hornträger und umfassen zumeist kleinere Tiere; sehr kleine Arten wie Blauducker sind auf proteinreiche Nahrung wie Früchte, Samen und Blüten spezialisiert und verdauen diese vergleichsweise schnell; größere Vertreter fressen überwiegend Blätter von Bäumen und Büschen; häufig werden Teile zahlreicher Pflanzen gefressen, bei einigen Duckern sind zwischen 50 und 80 Arten bekannt, bei einigen Kudus über 150, die im Speiseplan stehen; die Wasseraufnahme erfolgt über die Nahrung.
- Grasfresser oder Konsumenten grober Pflanzenteile (grazer); häufig größere, selten sehr kleine Vertreter, die 25 % der Hornträger stellen und überwiegend Gräser oder faserige Pflanzenteile fressen; in der Regel handelt es sich um Offenlandbewohner, unterschieden werden kann darüber hinaus zwischen Tieren, die in gut durchfeuchteten bis sumpfigen Landschaften (Büffel, Gnus, Kuhantilopen) oder in Trockenländern (Oryxantilopen) zu finden sind; die Tiere sind zumeist wasserabhängig.
- Konsumenten gemischter Pflanzenkost (mixed feeder) mit Übergangsformen zum browsing und grazing, hierzu zählen etwa Impalas, Elenantilopen oder zahlreiche Ziegenartige; sie stellen rund 35 % der Hornträger; die Tiere sind anpassungsfähig an verschiedene Landschaftsräume, die abwechselnd harten oder weichen Nahrungskomponenten werden abhängig von der jahreszeitlichen Verfügbarkeit vertilgt; die Wasserabhängigkeit schwankt häufig mit der Qualität der Nahrung.
Die Art der vertilgten Nahrung spiegelt sich auch im Körperbau wider. Browser haben in der Regel ein kleines und schmales Maul, grazer ein deutlich größeres und breiteres. Anhand der Zähne können „Schneider“ und „Mahler“ unterschieden werden. „Schneider“ besitzen langschmale Molaren mit zahlreichen scharfen Kanten, die gegenständigen Zähne des Ober- und Unterkiefers wirken wie Scheren und zerschneiden die überwiegend weiche Pflanzennahrung. „Mahler“ dagegen verfügen über breite Molaren mit wenigen Erhebungen. Sie ähneln teilweise denen der Pferde und können die harte Grasnahrung gut zermahlen.[9][1][2]
Fortpflanzung

Die Fortpflanzungsform ist abhängig von der Art der sozialen Organisation. Kleine, territoriale Waldtiere leben häufig monogam und bilden Paare mit Territorien, die verteidigt werden. Bei diesen ist selten ein Sexualdimorphismus ausgebildet. Bei größeren und vor allem herdenbildenden Tieren sind die Männchen oft polygyn, was in einem starken Fortpflanzungswettkampf unter diesen und in einem ausgesprochenen Unterschied zwischen männlichen und weiblichen Individuen resultiert. Die Paarungszeit ist in den wärmeren Regionen generell ganzjährig, in den gemäßigten Klimabereichen aber strikt jahreszeitlich gebunden. Der Sexualzyklus dauert bei Weibchen etwa 21 bis 22 Tagen, er kann aber bei extrem großen Arten auch bis zu 26 Tage anhalten. Der Paarungswettstreit der Männchen, der zu den eindrucksvollsten in der Tierwelt gehört, ist stark ritualisiert und choreographiert, doch kann es auch zu starken Verletzungen kommen. Je nach Hornform kommen unterschiedlich gestaltete Wettkämpfe vor, die von Hakeln und Schieben mit den Hörnern bei langhörnigen Antilopen beziehungsweise Stechen und Piken bei kurzhörnigen über Schiebewettkämpfe bei den Rindern bis zum gegenseitigen Kopframmen bei den Ziegenartigen reichen. Bei Herden, die ein festgelegtes Gebiet im Jahresrhythmus durchwandern, bestehen bei Männchen oft Balzplätze, die über mehrere Jahre aufgesucht werden. Die Tragzeit variiert je nach Körpergröße zwischen sechs und neun Monaten. Überwiegend kommt nur ein Junges zur Welt, jedoch sind bei Duckern, Ziegen und Schafen auch Zwillingsgeburten nachgewiesen. Generell gilt, je größer eine Art ist, desto häufiger kommen singuläre Neugeborene zur Welt. Bei nahezu allen Hornträgern zieht sich das trächtige Weibchen für die Geburt von den Artgenossen zurück und versteckt das Neugeborene für eine gewisse Zeit.[2]
Systematik
Äußere Systematik
| Innere Systematik der rezenten Cetartiodactyla nach Zurano et al. 2019[11] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Die Hornträger sind eine Familie aus der Ordnung der Paarhufer (Artiodactyla). Innerhalb der Paarhufer bilden die sie wiederum einen Teil der Unterordnung der Wiederkäuer (Ruminantia), deren Mitglieder über einen mehrkammerigen Magen verfügen, und dem diesen untergeordneten Taxon der Stirnwaffenträger (Pecora), deren besonderes Merkmal die Ausbildung von Hörnern und Geweihen ist. Dadurch sind die Hornträger mit den Hirschen (Cervidae), den Giraffenartigen (Giraffidae), den Moschustieren (Moschidae) und den Gabelhornträgern (Antilocapridae) näher verwandt. Von allen diesen Gruppen stellen die Hornträger die weitaus umfangreichste Familie dar. Ursprünglich wurde der Gabelbock (Antilocapra) als eng verwandt mit den Hornträgern angesehen (und teilweise innerhalb dieser geführt), molekulargenetische Studien verweisen ihn jedoch an die Basis der Entwicklung der Stirnwaffenträger.[12] Diesen zufolge formen die Hornträger eine Gemeinschaftsgruppe mit den Hirschen und den Moschustieren, wobei letztere gelegentlich auch in eine gemeinsame Überfamilie mit den Hornträgern (Bovioidea) gestellt werden.[13][14] Die Abspaltung der Hornträger von den übrigen Stirnwaffenträgern erfolgte im Übergang vom Oligozän zum Miozän vor rund 24 Millionen Jahren.[15][16][11]
Innere Systematik
Bereits zu Beginn des 20. Jahrhunderts wurde auf morphologischer Basis eine Dichotomie der Hornträger erkannt, woraufhin eine Aufteilung in die Boodontia (Rinder, Büffel und Kudus) und die Aegodontia (Schafe, Ziegen, Gazellen und Antilopen) erfolgte.[17][13] Diese Zweiteilung fand auch durch moderne molekulargenetische Studien ihre Bestätigung. Heute werden die Hornträger in zwei Unterfamilien gegliedert, die Bovinae (= Boodontia) und die Antilopinae (= Aegodontia).[18] Die Bovinae sind dabei vor allem durch ihren mittelgroßen bis sehr großen und vor allem schweren Körperbau gekennzeichnet, ihre Gliedmaßen besitzen eine kräftige Muskulatur. Sie tragen leicht bis stärker gebogene Hörner, die häufig an der Vorderseite eine Kiele besitzen und niemals querverlaufende Ringstrukturen wie bei den Antilopinae aufweisen. Bovinen bevorzugen Landschaften mit dichtem Unterwuchs oder Wälder. Die Antilopinae stellen eine sehr diverse Gruppe mit kleinen und großen Formen dar. Die Fellfärbung ist im Gegensatz zu den Bovinen variantenreicher mit abgehobenen Streifen auf den Körperseiten oder im Gesicht. Bis auf wenige Gebirgsformen sind die Angehörigen eher leicht gebaut und repräsentieren häufig Offenlandbewohner.[2][6] Während die Bovinae schon lange als eigenständige Unterfamilie galten, waren die Antilopinae ursprünglich auf mehrere gleichrangige Gruppen aufgeteilt. Innerhalb der Hornträger können zudem rund ein Dutzend Triben unterschieden werden, von denen neun allein zu den Antilopinae gehören.[19][15][16]
Übersicht über die Gattungen und Arten der Hornträger
Innere Systematik der Bovidae nach Zurano et al. 2019[11]
| Bovidae |
| ||||||
| Bovinae |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Antilopinae |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Die hier vorgestellte Systematik folgt im Wesentlichen Groves und Leslie 2011[2] beziehungsweise Groves und Grubb[20], berücksichtigt aber auch neuere Erkenntnisse:[21][22]
- Familie Bovidae Gray, 1821
-
- Tribus Bovini Gray, 1821 (Rinder)
- Gattung Eigentliche Rinder (Bos Linnaeus, 1758)
- Amerikanischer Bison (Bos bison Linnaeus, 1758; auch Bison bison)
- Wisent (Bos bonasus Linnaeus, 1758; auch Bison bonasus)
- † Bergwisent (Bos caucasicus Satunin, 1904; auch Bison caucasicus)
- Gaur (Bos gaurus C. H. Smith, 1827); aus dieser Art wurde der Gayal (Bos frontalis) domestiziert
- Banteng (Bos javanicus d'Alton, 1823); aus dieser Art wurde das Balirind domestiziert
- Yak (Bos mutus Przewalski, 1883); aus dieser Art wurde die Haustierform Bos grunniens domestiziert
- † Auerochse (Bos primigenius Bojanus, 1827); aus dieser Art wurde das Hausrind (Bos taurus) und der Zebu (Bos indicus) domestiziert
- Kouprey (Bos sauveli Urbain, 1937)
- Gattung Asiatische Büffel (Bubalus C. H. Smith, 1827)
- Wasserbüffel oder Arni (Bubalus arnee (Kerr, 1792)); aus dieser Art wurde die Haustierform Bubalus bubalis domestiziert
- Tiefland-Anoa oder Anoa (Bubalus depressicornis (C. H. Smith, 1827))
- Tamarau oder Mindoro-Büffel (Bubalus mindorensis Heude, 1888)
- Berg-Anoa (Bubalus quarlesi (Ouwens, 1910)); die Art ist nicht allgemein anerkannt und wird in der Regel zusammen mit dem Tiefland-Anoa geführt
- Gattung Syncerus Hodgson, 1847
- Sudan-Büffel (Syncerus brachyceros (Gray, 1837))
- Kaffernbüffel (Syncerus caffer (Sparrman, 1779))
- Virunga-Büffel (Syncerus matthewsi (Lydekker, 1904))
- Rotbüffel (Syncerus nanus (Boddaert, 1785))
- Gattung Pseudoryx Dung, Giao, Chinh, Tuoc, Arctander & MacKinnon, 1993
- Saola oder Vietnamesisches Waldrind (Pseudoryx nghetinhensis Dung, Giao, Chinh, Tuoc, Arctander & MacKinnon, 1993)
- Tribus Boselaphini Knottnerus-Meyer, 1907
- Gattung Tetracerus Geoffroy Saint Hilaire & F. Cuvier, 1824
- Vierhornantilope (Tetracerus quadricornis (de Blainville, 1816))
- Gattung Boselaphus de Blainville, 1816
- Nilgauantilope (Boselaphus tragocamelus (Pallas, 1766))
- Tribus Tragelaphini Jerdon, 1874
- Gattung Nyala Heller, 1912
- Nyala oder Flachland-Nyala (Nyala angasii (Angas, 1849))
- Gattung Tragelaphus de Blainville, 1816
- Sudan-Schirrantilope (Tragelaphus bor Heuglin, 1877)
- Bergnyala (Tragelaphus buxtoni (Lydekker, 1910))
- Äthiopien-Schirrantilope (Tragelaphus decula (Rüppell, 1835))
- Bongo (Tragelaphus eurycerus (Ogilby, 1837))
- Ostküsten-Schirrantilope (Tragelaphus fasciatus Pocock, 1900)
- Westliche Sitatunga (Tragelaphus gratus Sclater, 1880)
- Nil-Sitatunga (Tragelaphus larkenii (St. Leger, 1931))
- Hochland-Schirrantilope (Tragelaphus meneliki Neumann, 1902)
- Sambia-Schirrantilope (Tragelaphus ornatus Pocock, 1900)
- Kongo-Schirrantilope (Tragelaphus phaleratus (C. H. Smith, 1827))
- Senegal-Schirrantilope (Tragelaphus scriptus Pallas, 1766)
- Sambesi-Sitatunga (Tragelaphus selousi Rothschild, 1898)
- Sitatunga oder Wasserkudu und Ostafrika-Sitatunga (Tragelaphus spekii Speke, 1863)
 Sitatunga (Tragelaphus spekii)
Sitatunga (Tragelaphus spekii) - Südliche Schirrantilope (Tragelaphus sylvaticus (Sarrman, 1780))
- Nikose-Situnga (Tragelaphus sylvestris (Meinertzhagen, 1916))
- Gattung Ammelaphus Heller, 1912
- Südlicher Kleinkudu (Ammelaphus australis Heller, 1913)
- Kleiner Kudu oder Nördlicher Kleinkudu (Ammelaphus imberbis (Blyth, 1869))
- Gattung Strepsiceros C. H. Smith, 1827
- Nördlicher Großkudu (Strepsiceros chora (Cretzschmar, 1826))
- Westlicher Großkudu (Strepsiceros cottoni Dollman & Burlace, 1928)
- Kap-Großkudu (Strepsiceros strepsiceros (Pallas, 1766))
- Sambesi-Großkudu (Strepsiceros zambesiensis Lorentz, 1894)
.jpg.webp) Sambesi-Großkudu (Strepsiceros zambesiensis)
Sambesi-Großkudu (Strepsiceros zambesiensis)
- Gattung Elenantilopen (Taurotragus Wagner, 1855)
- Riesen-Elenantilope (Taurotragus derbianus (Gray, 1847))
- Elenantilope (Taurotragus oryx (Pallas, 1766))
- Unterfamilie Antilopinae Gray, 1821
- Gattung Böckchen (Nesotragus von Düben, 1846)
- Batesböckchen (Nesotragus batesi (De Winton, 1903))
- Kirchenpauer-Moschusböckchen (Nesotragus kirchenpaueri Pagenstecher, 1885)
- Livingstone-Moschusböckchen (Nesotragus livingstonianus Kirk, 1865)
- Moschusböckchen (Nesotragus moschatus von Düben, 1846)
- Tribus Neotragini Sclater & Thomas, 1894
- Gattung Neotragus C. H. Smith, 1827
- Kleinstböckchen (Neotragus pygmaeus (Linnaeus, 1758))
- Tribus Aepycerotini Gray, 1872
- Gattung Impalas (Aepyceros Sundevall, 1847)
- Schwarzfersenantilope oder Impala (Aepyceros melampus (Lichtenstein, 1812))
- Schwarznasenimpala (Aepyceros petersi Bocage, 1879)
 Schwarznasenimpala (Aepyceros petersi)
Schwarznasenimpala (Aepyceros petersi)
- Tribus Antilopini Gray, 1821 (Gazellenartige)
- Gattung Raphicerus C. H. Smith, 1827
- Steinböckchen (Raphicerus campestris (Thunberg, 1811))
- Natal-Greisbock (Raphicerus colonicus Thomas & Schwann, 1906)
- Kap-Greisbock (Raphicerus melanotis (Thunberg, 1811))
- Sharpe-Greisbock oder Nördliches Greisböckchen (Raphicerus sharpei Thomas, 1897)
- Gattung Springböcke (Antidorcas Sundevall, 1847)
- Angola-Springbock (Antidorcas angolensis Blaine, 1922)
- Kalahari-Springbock (Antidorcas hofmeyri Thomas, 1926)
- Kap-Springbock oder Springbock (Antidorcas marsupialis (Zimmermann, 1780))
- Gattung Ammodorcas Thomas, 1891
- Stelzengazelle oder Dibetag (Ammodorcas clarkei (Thomas, 1891))
- Gattung Giraffengazellen (Litocranius Kohl, 1886)
- Nördliche Giraffengazelle (Litocranius sclateri Neumann, 1899)
- Südliche Giraffengazelle (Litocranius walleri (Brooke, 1878))
_-_Flickr_-_Lip_Kee_(1).jpg.webp) Südliche Giraffengazelle (Litocranius walleri)
Südliche Giraffengazelle (Litocranius walleri)
- Gattung Saigas (Saiga Gray, 1843)
- Mongolische Saiga (Saiga mongolica Bannikov, 1946; auch Saiga borealis)
- Saiga (Saiga tatarica (Linnaeus, 1766))
- Gattung Antilope Pallas, 1766
- Hirschziegenantilope (Antilope cervicapra (Linnaeus, 1758))
- Gattung Nanger Lataste, 1885
- Damagazelle (Nanger dama (Pallas, 1766))
- Südliche Grant-Gazelle (Nanger granti (Brooke, 1872))
- Nördliche Grant-Gazelle (Nanger notatus (Thomas, 1897))
- Östliche Grant-Gazelle (Nanger petersii (Günther, 1884))
- Sömmerringgazelle (Nanger soemmerringii (Cretzschmar, 1826))
.jpg.webp) Sömmerringgazelle (Nanger soemmerringii)
Sömmerringgazelle (Nanger soemmerringii)
- Gattung Gazella de Blainville, 1816
- Akaziengazelle (Gazella acaciae Mendelssohn, Groves & Shalmon, 1997)
- Indische Gazelle oder Dekkan-Chinkara (Gazella bennettii (Sykes, 1831))
- † Jemen-Gazelle (Gazella bilkis Groves & Lay, 1985)
- Gujarat-Chinkara (Gazella christii Blyth, 1842)
- Arabische Wüstengazelle (Gazella cora (C. H. Smith, 1827))
- Cuviergazelle (Gazella cuvieri (Ogilby, 1841))
- Farrur-Gazelle (Gazella dareshurii Karami & Groves, 1993)
- Dorkasgazelle (Gazella dorcas (Linnaeus, 1758))
 Dorkasgazelle (Gazella dorcas)
Dorkasgazelle (Gazella dorcas) - Arabische Küstengazelle (Gazella erlangeri Neumann, 1906)
- Belutschistan-Chinkara (Gazella fuscifrons Blanford, 1873)
- Echtgazelle oder Edmigazelle (Gazella gazella (Pallas, 1766))
- Turkmenistan-Kropfgazelle (Gazella gracilicornis Stroganov, 1956)
- Buschir-Gazelle (Gazella karamii Groves, 1993)
- Dünengazelle (Gazella leptoceros (Cuvier, 1842))
- Sandgazelle (Gazella marica Thomas, 1897)
- Maskat-Gazelle (Gazella muscatensis Brooke, 1874)
- Pelzeln-Gazelle (Gazella pelzelni Kohl, 1886)
- Punjab-Chinkara oder Rajasthan-Gazelle (Gazella salinarum Groves, 2003)
- † Saudi-Gazelle (Gazella saudiya Carruthers & Schwarz, 1935)
- Iran-Chinkara oder Shikari-Gazelle (Gazella shikarii Groves, 1993)
- Spekegazelle (Gazella spekei Blyth, 1873)
 Spekegazelle (Gazella spekei)
Spekegazelle (Gazella spekei) - Kropfgazelle (Gazella subgutturosa (Güldenstädt, 1780))
- Jarkand-Kropfgazelle (Gazella yarkandensis Blanford, 1875)
- Gattungen Eudorcas Fitzinger, 1869
- Mongalla-Gazelle (Eudorcas albonotata (Rothschild, 1903))
- Westliche Thomson-Gazelle (Eudorcas nasalis (Lönnberg, 1908))
- Rotstirngazelle (Eudorcas rufifrons (Gray, 1846))
- † Algerische Gazelle (Eudorcas rufina (Thomas, 1894))
- Östliche Thomson-Gazelle oder Thomson-Gazelle (Eudorcas thomsonii (Günther, 1884))
- Heuglin-Gazelle (Eudorcas tilonura (Heuglin, 1869))
- Gattung Dorcatragus Noack, 1894
- Beira (Dorcatragus megalotis (Menges, 1894))
- Gattung Dikdiks (Madoqua Ogilby, 1837)
- Cavendish-Dikdik (Madoqua cavendishi Thomas, 1898)
- Damara-Dikdik (Madoqua damarensis (Günther, 1880))
 Damara-Dikdik (Madoqua damarensis)
Damara-Dikdik (Madoqua damarensis) - Günther-Dikdik (Madoqua guentheri Thomas, 1894)
- Harar-Dikdik oder Rotbauchdikdik (Madoqua hararensis Neumann, 1904)
- Hinde-Dikdik (Madoqua hindei Thomas, 1902)
- Kirk-Dikdik (Madoqua kirkii (Günther, 1880))
- Lawrance-Dikdik (Madoqua lawrancei Deake-Brockmann, 1926)
- Rotbauch-Dikdik (Madoqua phillipsi Thomas, 1894)
- Silberdikdik (Madoqua piacentinii Drake-Brockmann, 1911)
- Eritrea-Dikdik (Madoqua saltiana (Desmarest, 1817))
- Smith-Dikdik (Madoqua smithii Thomas, 1901)
- Kleindikdik (Madoqua swaynei Thomas, 1894)
- Thomas-Dikdik (Madoqua thomasi (Neumann, 1905))
- Gattung Oribis (Ourebia Laurillard, 1842)
- Serengeti-Oribi (Ourebia hastata (Peters, 1852))
- Sudan-Oribi (Ourebia montana (Cretzschmar, 1826))
.jpg.webp) Sudan-Oribi (Ourebia montana)
Sudan-Oribi (Ourebia montana) - Südliches Oribi oder Bleichböckchen (Ourebia ourebi (Zimmermann, 1783))
- Senegal-Oribi (Ourebia quadriscopa (Hamilton Smith, 1827))
- Gattung Kurzschwanzgazellen (Procapra Hodgson, 1846)
- Mongolische Gazelle (Procapra gutturosa (Pallas, 1777))
- Tibetgazelle (Procapra picticaudata Hodgson, 1846)
- Przewalski-Gazelle (Procapra przewalskii (Büchner, 1891))
- Tribus Reduncini Knottnerus-Meyer, 1907
- Gattung Riedböcke (Redunca C. H. Smith, 1827)
- Adamaoua-Riedbock (Redunca adamauae Pfeffer, 1962)
- Großer Riedbock (Redunca arundinum (Boddaert, 1785))
- Bohor-Riedbock (Redunca bohor Rüppell, 1842)
- Ostafrika-Bergriedbock (Redunca chanleri (Rothschild, 1895))
- Sudan-Riedbock (Redunca cottoni (Rothschild, 1902))
- Bergriedbock oder Südlicher Bergriedbock (Redunca fulvorufula (Afzelius, 1815))
 Bergriedbock (Redunca fulvorufula)
Bergriedbock (Redunca fulvorufula) - Tschad-Riedbock (Redunca nigeriensis (Blaine, 1913))
- Sambia-Riedbock (Redunca occidentalis (Rothschild, 1907))
- Gemeiner Riedbock oder Senegal-Riedbock (Redunca redunca (Pallas, 1767))
- Gattung Wasserböcke (Kobus A. Smith, 1840)
- Upemba-Litschi (Kobus anselli Cotterill, 2005)
- Defassa-Wasserbock (Kobus defassa (Rüppell, 1835))
- Ellipsen-Wasserbock (Kobus ellipsiprymnus (Ogilby, 1833))
- Kafue-Litschi (Kobus kafuensis Haltenorth, 1963)
- Senegal-Grasantilope oder Kob (Kobus kob (Erxleben, 1777))
- Letschwe oder Litschi-Moorantilope (Kobus leche Gray, 1850)
 Letschwe (Kobus leche)
Letschwe (Kobus leche) - Weißohr-Moorantilope (Kobus leucotis (Lichtenstein & Peters, 1854))
- Kamerun-Grasantilope (Kobus loderi (Lydekker, 1900))
- Weißnacken-Moorantilope (Kobus megaceros (Fitzinger, 1855))
- † Roberts-Wasserbock (Kobus robertsi (Rothschild, 1907))
- Bangweulu-Litschi (Kobus smithemani (Lydekker, 1900))
- Uganda-Grasantilope (Kobus thomasi (Sclater, 1895))
- Puku (Kobus vardonii (Livingstone, 1857))
- Gattung Pelea Gray, 1851
- Rehantilope (Pelea capreolus (Forster, 1790))
- Tribus Hippotragini Sundevall in Retzius & Lovén, 1845 (Pferdeböcke)
- Gattung Rossantilopen oder Eigentliche Pferdeböcke (Hippotragus Sundevall, 1845)
- Pferdeantilope (Hippotragus equinus (Geoffroy Saint-Hilaire, 1803))
_male_walking.jpg.webp) Pferdeantilope (Hippotragus equinus)
Pferdeantilope (Hippotragus equinus) - † Blaubock (Hippotragus leucophaeus (Pallas, 1766))
- Rappenantilope (Hippotragus niger (Harris, 1838); teilweise gelten auch die Ostafrikanische Rappenantilope (H. n. roosevelti) und die Riesen-Rappenantilope (H. n. variani) als eigenständige Arten)
- Pferdeantilope (Hippotragus equinus (Geoffroy Saint-Hilaire, 1803))
- Gattung Addax Laurillard, 1842
- Mendesantilope oder Addax (Addax nasomaculatus (de Blainville, 1816))
- Gattung Oryxantilopen (Oryx de Blainville, 1810)
- Beisa-Oryx (Oryx beisa (Rüppell, 1835))
- Büschelohr-Oryx (Oryx callotis Thomas, 1892)
- Säbelantilope (Oryx dammah (Cretzschmar, 1826))
- Galla-Oryx (Oryx gallarum Neumann, 1902)
- Spießbock oder Südliche Oryx (Oryx gazella (Linnaeus, 1758))
.jpg.webp) Spießbock (Oryx gazella)
Spießbock (Oryx gazella) - Arabische Oryx oder Weiße Oryx (Oryx leucoryx (Pallas, 1777))
- Tribus Alcelaphini Brooke in Wallace, 1876 (Kuhantilopen)
- Gattung Eigentliche Kuhantilopen (Alcelaphus de Blainville, 1816)
- † Nordafrikanische Kuhantilope (Alcelaphus buselaphus (Pallas, 1766))
- Südliche Kuhantilope oder Kaama-Kuhantilope (Alcelaphus caama (Geoffroy Saint-Hilaire, 1803))
- Kongoni-Kuhantilope oder Cokes Kuhantilope (Alcelaphus cokii Günther, 1884)
- Lelwel-Kuhantilope (Alcelaphus lelwel (Heuglin, 1877))
- Lichtenstein-Antilope (Alcelaphus lichtensteinii (Peters, 1852))
- Westafrika-Kuhantilope (Alcelaphus major (Blyth, 1869))
- Somalia-Kuhantilope (Alcelaphus swaynei (Sclater, 1892))
- Tora-Kuhantilope (Alcelaphus tora Gray, 1873)
- Gattung Beatragus Heller, 1912
- Hunter-Antilope oder Hirola (Beatragus hunteri (Sclater, 1889))
- Gattung Leierantilopen (Damaliscus Sclater & Thomas, 1894)
- Ruaha-Topi (Damaliscus eurus Blaine, 1914)
- Korrigum (Damaliscus korrigum (Ogilby, 1834))
- Serengeti-Topi (Damaliscus jimela (Matschie, 1892))
- Sassaby (Damaliscus lunatus (Burchell, 1824))
- Blessbock (Damaliscus phillipsi Harper, 1939)
- Buntbock (Damaliscus pygargus (Pallas, 1767))
 Buntbock (Damaliscus pygargus)
Buntbock (Damaliscus pygargus) - Bangweulu-Sassaby (Damaliscus superstes Cotterill, 2003)
- Tiang (Damaliscus tiang (Heuglin, 1863))
- Küsten-Topi (Damaliscus topi Blaine, 1914)
- Uganda-Topi oder Topi (Damaliscus ugandae Blaine, 1914)
- Gattung Gnus (Connochaetes Lichtenstein, 1812)
- Weißbartgnu oder Östliches Weißbartgnu (Connochaetes albojubatus Thomas, 1892)
- Weißschwanzgnu (Connochaetes gnou (Zimmermann, 1780))
- Weißbindengnu oder Njassa-Gnu (Connochaetes johnstoni Sclater, 1896)
- Serengeti-Weißbartgnu oder Westliches Weißbartgnu (Connochaetes mearnsi Heller, 1913)
- Streifengnu (Connochaetes taurinus (Burchell, 1824))
 Streifengnu (Connochaetes taurinus)
Streifengnu (Connochaetes taurinus)
- Tribus Caprini Gray, 1821 (Ziegenartige)
- Gattung Pantholops Hodgson, 1834
- Tschiru (Pantholops hodgsoni (Abel, 1826))
- Gattung Oreamnos Rafinesque, 1817
- Schneeziege (Oreamnos americanus (de Blainville, 1816))
- Gattung Takine (Budorcas Hodgson, 1850)
- Goldtakin (Budorcas benfordi Thomas, 1911)
- Mishmi-Takin (Budorcas taxicolor Hodgson, 1850)
- Sichuan-Takin (Budorcas tibetana Milne-Edwards, 1874)
- Bhutan-Takin (Budorcas whitei Lydekker, 1907)
- Gattung Ammotragus Blyth, 1840
- Mähnenspringer (Ammotragus lervia (Pallas, 1777))
 Mähnenspringer (Ammotragus lervia)
Mähnenspringer (Ammotragus lervia)
- Mähnenspringer (Ammotragus lervia (Pallas, 1777))
- Gattung Arabitragus Ropiquet & Hassanin, 2005
- Arabischer Tahr (Arabitragus jayakiri (Thomas, 1894))
- Gattung Hemitragus Hodgson, 1841
- Himalaya-Tahr (Hemitragus jemlahicus (C. H. Smith, 1826))
- Gattung Pseudois Hodgson, 1846
- Blauschaf (Pseudois nayaur (Hodgson, 1833))
- Zwergblauschaf (Pseudois schaeferi Haltenorth, 1963)
- Gattung Ziegen (Capra Linnaeus, 1758)
- Wildziege oder Bezoarziege (Capra aegagrus Erxleben, 1777); aus dieser Art wurde die Hausziege domestiziert
- Westkaukasischer Steinbock oder Kuban-Tur (Capra caucasica Güldenstedt & Pallas, 1783)
- Ostkaukasischer Steinbock oder Dagestan-Tur (Capra cylindricornis (Blyth, 1841))
- Schraubenziege oder Markhor (Capra falconeri (Wagner, 1839))
- Alpensteinbock (Capra ibex Linnaeus, 1758)
- Nubischer Steinbock oder Syrischer Steinbock (Capra nubiana F. Cuvier, 1825)
- Iberiensteinbock (Capra pyrenaica Schinz, 1838)
- Sibirischer Steinbock (Capra sibirica (Pallas, 1776))
- Äthiopischer Steinbock (Capra walie Rüppell, 1835)
- Gattung Nilgiritragus Ropiquet & Hassanin, 2005
- Nilgiri-Tahr (Nilgiritragus hylocrius (Ogilby, 1838))
- Gattung Schafe (Ovis Linnaeus, 1758)
- Altai-Wildschaf (Ovis ammon (Linnaeus, 1758))
- Oman-Wildschaf (Ovis arabica Sopin & Harrison, 1986)
- Tadschikistan-Wildschaf (Ovis bochariensis Nasonov, 1914)
- Dickhornschaf (Ovis canadensis Shaw, 1804)
.jpg.webp) Dickhornschaf (Ovis canadensis)
Dickhornschaf (Ovis canadensis) - Kasachstan-Wildschaf (Ovis collium Severtzov, 1873)
- Afghanisches Urialschaf oder Turkmenistan-Wildschaf (Ovis cycloceros Hutton, 1842)
- Dall-Schaf (Ovis dalli Nelson, 1884)
- Gobi-Wildschaf (Ovis darwini Przewalski, 1883)
- Armenisches Wildschaf (Ovis gmelini Blyth, 1841); aus dieser Art wurde wahrscheinlich das Hausschaf domestiziert, möglicherweise ging aus ihr auch das Mufflon hervor
 Armenisches Wildschaf (Ovis gmelini)
Armenisches Wildschaf (Ovis gmelini) - Tibet-Argali (Ovis hodgsoni Blyth, 1841)
- Isphahan-Wildschaf (Ovis isphahani Nasonov, 1910)
- Nordchina-Wildschaf (Ovis jubata Peters, 1876)
- Tienshan-Argali (Ovis karelini Severtzov, 1873)
- Laristan-Wildschaf (Ovis laristanica Nasonov, 1909)
- Karatau-Wildschaf (Ovis nigrimontana Severtzov, 1873)
- Schneeschaf (Ovis nivicola Eschscholtz, 1829)
- Pamir-Argali (Ovis polii Blyth, 1841)
- Punjab-Wildschaf (Ovis punjabiensis Lydekker, 1913)
- Kysylkum-Wildschaf (Ovis severtzovi Nasonov, 1914)
- Ladakh-Wildschaf (Ovis vignei Blyth, 1841)
- Gattung Gämsen (Rupicapra de Blainville, 1816)
- Anatolische Gämse oder Kleinasien-Gämse (Rupicapra asiatica Lydekker, 1908)
- Karpaten-Gämse (Rupicapra carpatica Couturier, 1938)
- Abruzzen-Gämse (Rupicapra ornata Neumann, 1899)
 Abruzzen-Gämse (Rupicapra ornata)
Abruzzen-Gämse (Rupicapra ornata) - Kantabrische Gämse (Rupicapra parva Cabrera, 1911)
- Pyrenäen-Gämse (Rupicapra pyrenaica Bonaparte, 1845)
- Gämse oder Alpengämse (Rupicapra rupicapra (Linnaeus, 1758))
- Gattung Myotragus Bate, 1909
- † Höhlenziege (Myotragus balearicus Bate, 1909)
- Gattung Gorale (Naemorhedus C. H. Smith, 1827)
- Roter Goral oder Tibet-Goral (Naemorhedus baileyi Pocock, 1914)
- Westhimalaya-Goral (Naemorhedus bedfordi (Lydekker, 1905))
- Langschwanzgoral oder Nordchina-Goral (Naemorhedus caudatus (Milne-Edwards, 1876))
- Burma-Goral (Naemorhedus evansi (Lydekker, 1905))
- Grauer Goral oder Osthimalaya-Goral (Naemorhedus goral (Hardwicke, 1825))
 Grauer Goral (Naemorhedus goral)
Grauer Goral (Naemorhedus goral) - Chinesischer Goral oder Westchina-Goral (Naemorhedus griseus (Milne-Edwards, 1871))
- Gattung Seraue (Capricornis Ogilby, 1837)
- Japanischer Serau (Capricornis crispus (Temminck, 1844))
- Indochinesischer Serau (Capricornis maritimus Heude, 1888)
- Chinesischer Serau (Capricornis milneedwardsii David, 1869)
- Roter Serau (Capricornis rubidus Blyth, 1863)
- Südlicher Serau oder Sumatra-Serau (Capricornis sumatraensis (Bechstein, 1799))
- Taiwan-Serau oder Fomosa-Serau (Capricornis swinhoei Gray, 1862)
- Himalaya-Serau oder Nepal-Serau (Capricornis thar (Hodgson, 1831))
- Gattung Ovibos de Blainville, 1816
- Moschusochse (Ovibos moschatus (Zimmermann, 1780))
 Moschusochse (Ovibos moschatus)
Moschusochse (Ovibos moschatus)
- Moschusochse (Ovibos moschatus (Zimmermann, 1780))
- Tribus Cephalophini Blyth, 1863 (Ducker)
- Gattung Sylvicapra Ogilby, 1837
- Senegal-Kronenducker (Sylvicapra coronata (Gray, 1842))
- Kronenducker (Sylvicapra grimmia (Linnaeus, 1758))
- Sahel-Kronenducker (Sylvicapra pallidor Schwarz, 1914)
- Gattung Philantomba Blyth, 1840
- Ostafrika-Blauducker (Philantomba aequatorialis (Matschie, 1892))
- Angola-Blauducker (Philantomba anchietae (Bocage, 1879))
- Simbabwe-Blauducker (Philantomba bicolor (Gray, 1863))
- Kongo-Blauducker (Philantomba congica (Lönnberg, 1908))
- Malawi-Blauducker (Philantomba hecki (Matschie, 1897))
- Sambia-Blauducker (Philantomba defriesi (Rothschild, 1904))
- Tansania-Blauducker (Philantomba lugens (Thomas, 1898))
- Maxwell-Ducker (Philantomba maxwelli (C. H. Smith, 1827))
- Bioko-Blauducker (Philantomba melanorhea (Gray, 1846))
- Blauducker oder Kap-Blauducker (Philantomba monticola (Thunberg, 1789))
 Blauducker (Philantomba monticola)
Blauducker (Philantomba monticola) - Simpson-Blauducker (Philantomba simpsoni (Thomas, 1910))
- Verheyen-Ducker (Philantomba walteri Colyn, Hulselmans, Sonet, Oudé, De Winter, Natta, Nagy & Verheyen, 2010)
- Gattung Cephalophus C. H. Smith, 1827
- Sansibar-Ducker (Cephalophus adersi Thomas, 1918)
- Uëlle-Weißbauchducker (Cephalophus arrheni Lönnberg, 1917)
- Brooke-Ducker (Cephalophus brookei Thomas, 1903)
- Petersducker (Cephalophus callipygus Peters, 1876)
- Kongo-Schwarzrückenducker (Cephalophus castaneus Thomas, 1892)
- Weißbeinducker (Cephalophus crusalbum Grubb, 1978)
- Östlicher Gelbrückenducker (Cephalophus curticeps Grubb & Groves, 2001)
- Schwarzrückenducker (Cephalophus dorsalis Gray, 1846)
 Schwarzrückenducker (Cephalophus dorsalis)
Schwarzrückenducker (Cephalophus dorsalis) - Elgon-Schwarzstirnducker (Cephalophus forsteri St. Leger, 1934)
- Harvey-Rotducker (Cephalophus harveyi (Thomas, 1893))
- Kenia-Schwarzstirnducker (Cephalophus hooki St. Leger, 1934)
- Itombwe-Schwarzstirnducker (Cephalophus hypoxanthus Grubb & Groves, 2001)
- Jentink-Ducker (Cephalophus jentinki Thomas, 1892)
- Johnston-Ducker (Cephalophus johnstoni Thomas, 1901)
- Lestrade-Ducker (Cephalophus lestradei Grubb & Groves, 1974)
- Weißbauchducker (Cephalophus leucogaster Gray, 1873)
- Natal-Rotducker oder Rotducker (Cephalophus natalensis A. Smith, 1834)
- Schwarzducker (Cephalophus niger Gray, 1846)
- Schwarzstirnducker (Cephalophus nigrifrons Gray, 1871)
- Ogilby-Ducker oder Fernando-Po-Ducker (Cephalophus ogilbyi (Waterhouse, 1838))
- Ruwenzori-Schwarzstirnducker oder Ruwenzoriducker (Cephalophus rubidus Thomas, 1901)
- Rotflankenducker (Cephalophus rufilatus Gray, 1846)
- Gelbrückenducker (Cephalophus silvicultor (Afzelius, 1815))
 Gelbrückenducker (Cephalophus silvicultor)
Gelbrückenducker (Cephalophus silvicultor) - Abbott-Ducker (Cephalophus spadix True, 1890)
- Weyns-Ducker (Cephalophus weynsi Thomas, 1901)
- Zebraducker (Cephalophus zebra (Gray, 1838))
- Tribus Oreotragini Pocock, 1910
- Gattung Klippspringer (Oreotragus A. Smith, 1834)
- Tansania-Klippspringer (Oreotragus aceratos Noack, 1899)
- Kenia-Klippspringer (Oreotragus aureus Heller, 1913)
- Sambia-Klippspringer (Oreotragus centralis Hinton, 1921)
- Kap-Klippspringer oder Klippspringer (Oreotragus oreotragus (Zimmermann, 1783))
- Nigeria-Klippspringer (Oreotragus porteousi Lydekker, 1911)
- Äthiopien-Klippspringer (Oreotragus saltatrixoides (Temminck, 1853))
- Massai-Klippspringer oder Schillings-Klippspringer (Oreotragus schillingsi Neumann, 1902)
- Somali-Klippspringer (Oreotragus somalicus Neumann, 1902)
- Simbabwe-Klippspringer (Oreotragus stevensoni Roberts, 1946)
- Angola-Klippspringer (Oreotragus tyleri Hinton, 1921)
- Transvaal-Klippspringer (Oreotragus transvaalensis Roberts, 1917)
 Transvaal-Klippspringer (Oreotragus transvaalensis)
Transvaal-Klippspringer (Oreotragus transvaalensis)
In den meisten neueren Systematiken seit dem Jahr 2004 wird Bison innerhalb von Bos geführt, da der Amerikanische Bison eine gemeinsame Gruppe mit dem Yak bildet, der Wisent dagegen mit dem Hausrind (beziehungsweise dem Auerochsen).[23] Die Elenantilopen (Taurotragus) sind nach molekulargenetischen Untersuchungen in die Gattung Tragelaphus in ihrer ursprünglichen Definition eingebettet,[15][16] aus diesem Grund wurden letztere in bis zu fünf Gattungen aufgespalten. Die Böckchen wurden traditionell in der Gattung Neotragus vereint. Diese ist aber nach Studien aus dem Jahr 2014 polyphyletisch und enthält nur das Kleinstböckchen (Neotragus pygmaeus). Alle anderen Arten werden nun in die Gattung Nesotragus gestellt. Die Untersuchungen ergaben auch, dass Nesotragus näher mit den Impalas (Aepyceros) verwandt ist (wie ursprünglich für alle Böckchen angedacht), beide gemeinsam bilden die Schwestergruppe aller anderen Antilopinae. Neotragus hingegen steht in enger Beziehung zu den Duckern (Cephalophini) und zu den Klippspringern (Oreotragus).[22] Dabei muss in weiteren Untersuchungen herausgearbeitet werden, ob Nesotragus mit den Aepycerotini und Neotragus mit den Cephalophini beziehungsweise mit den Oreotragini vereint werden können. Innerhalb der Ducker selbst ist Cephalophus nicht monophyletisch, da die Gattung auch Sylvicapra mit einschließt.[24] Möglicherweise muss Cephalophus deshalb aufgespalten werden, vorgeschlagen wurden etwa Cephalophorus, um den Peters- und den Rotducker sowie die Schwarzstirnducker und den Ogilby-Ducker dort aufzunehmen, und Leucocephalophus für den Sansibar-Ducker.[15][25]
Die Antilopen bilden kein einheitliches Taxon innerhalb der Hornträger; der Begriff „Antilope“ ist lediglich eine Sammelbezeichnung für schlanke, tropische Hornträger, der nichts mit den Verwandtschaftsverhältnissen zu tun hat. Der Name geht auf das griechische Wort ανθὀλωπς (antholops „Blumenauge“) zurück und bezeichnete ein mythisches Ungeheuer. Eine ähnliche Bedeutung hat das Wort Gazelle, das sich vom arabischen ghazal ableitet.[2]
Konservatismus oder Inflation – Zur Artenvielfalt der Hornträger
Wurden bis zum Anfang des 21. Jahrhunderts noch rund 140 Arten in gut 45 Gattungen unterschieden,[19] ergab eine im Jahr 2011 veröffentlichte Revision durch Colin Peter Groves und Peter Grubb rund 280 Arten verteilt auf knapp 55 Gattungen.[20] Der hohe Zuwachs, der der Familie nahezu die doppelte Anzahl an Mitgliedern beschied, erfolgte hauptsächlich durch Aufsplittung der bestehenden Arten, weniger durch Neuentdeckungen, wodurch zahlreiche ehemalige Unterarten auf Artstatus verschoben wurden. Groves und Grubb folgten dabei teilweise dem phylogenetischen Artkonzept. Ihr Vorgehen wurde nach der Veröffentlichung von einigen Wissenschaftlern als „taxonomische Inflation“ heftig kritisiert. Dabei bezog sich die Kritik unter anderem auf das uneinheitliche Artkonzept der Biologie, was Groves und Grubb ermöglichte, einzelne Gruppen und Populationen aus den als Arten betrachteten Metapopulationen herauszulösen und auf teils räumlich eng begrenzte, endemische Arten zu reduzieren. Des Weiteren wurde an der Aufsplittung die sich daraus eventuell ergebende negative Auswirkung auf den Artenschutz bemängelt, da eine höhere Anzahl an Arten mehr Ressourcen zu ihrem Erhalt erfordern. Darüber hinaus könnte dies beispielsweise das Umsiedeln stark bedrohter individueller Gruppen erschweren, welche dann der Gefahr einer Hybridisierung ausgesetzt wären. So empfanden einige Forscher unter anderem die extreme Aufspaltung der Seraue in sechs und der Klippspringer in elf Arten als überzogen und auf morphologischem Wege nicht haltbar.[26][27][28] Andererseits meinen Befürworter, dass viele Arten, die in jüngerer Zeit erst durch Genanalysen ermittelt werden konnten, häufig durch rein äußerliche Merkmale nicht abtrennbar seien. Derartige Artenschwärme oder „kryptische Arten“ treten wiederholt nicht nur bei Klein-, sondern auch bei Großsäugern auf. Während bei den Hornträgern bereits Mitte der 1990er Jahre das Kirk-Dikdik innerhalb der Gazellenartigen als Artenschwarm identifiziert werden konnte,[29] wurden im ersten Jahrzehnt des 21. Jahrhunderts unter anderem mit dem Buschbock-Artkomplex innerhalb der Tragelaphini[30], dem Leierantilopen-Artkomplex innerhalb der Kuhantilopen[31], dem Litschi-Artkomplex innerhalb der Wasserböcke[32], dem Grant-Gazellen-Artkomplex innerhalb der Gazellenartigen[33] und dem Maxwell-Ducker-Artkomplex innerhalb der Ducker[34] weitere belegt. Auch ergaben genetische Untersuchungen, dass die Tahre (ursprünglich Hemitragus) in Wirklichkeit polyphyletisch sind und mehrere Arten und Gattungen enthalten.[35] Prinzipiell wäre durch kryptische Arten die tatsächliche Artanzahl innerhalb der Hornträger stark unterschätzt, die vorgenommene Revision wird dadurch als längst überfällig erachtet. Im Falle der Klippspringer sind die einzelnen Populationen diskontinuierlich über das östliche und südwestliche Afrika verbreitet und durch ihre Spezialisierung auf felsige Regionen nur in einzelnen Landschaftsinseln präsent. Dadurch stellen sie Habitatspezialisten dar, vergleichbar einigen Ziegenformen, deren einzelne, abgetrennte Populationen eine eigene biogeographische Geschichte besitzen. Durch das Aufdecken dieser kryptischen Arten könnte nach Meinung der Befürworter der Aufsplittung der Artenschutz durchaus profitieren, da so Arten stärker in den Blickpunkt geraten, die ansonsten durch die konservative Taxonomie im entsprechenden Artenschwarm zumeist übersehen werden.[36][37][38]
Stammesgeschichte
Während die Paarhufer eine stammesgeschichtlich relativ alte Gruppe darstellen und mit Diacodexis schon im Unteren Eozän vor rund 55 Millionen Jahren nachweisbar sind,[39] traten die Hornträger erdgeschichtlich relativ spät in Erscheinung. Vorläufer der heutigen Boviden waren mit Palaeohypsodontus bereits im Oberen Oligozän in Asien[40] und mit Andegameryx oder Hispanomeryx im Unteren Miozän in Europa präsent.[41][42] Bei diesen frühem Formen handelt es sich zumeist um hornlose Tiere mit leicht hochkronigen Zähnen, die schon das selenodonte Kauflächenmuster erkennen lassen. Das in dieser Zeit ebenfalls auftretende hornlose Amphimoschus, das von zahlreichen Fundstellen Europas belegt ist, galt mitunter den Hornträgern zugehörig, war allerdings in seiner systematischen Stellung umstritten. Heute wird es als Verwandter des Gabelbocks betrachtet.[43] Zu den ältesten bekannten Vertretern echter Boviden gehört die Gattung Eotragus aus dem Unteren Miozän. Diese Tiere ähnelten heutigen Duckerantilopen, waren niemals größer als Rehe und hatten sehr kleine, spießartige Hörner, die sehr eng standen. Sehr frühe Funde, die auf etwa 18 Millionen Jahre datieren, stammen aus Westeuropa und Zentralasien, einige Hornfragmente konnten für das Mittlere Miozän auch in Südostasien nachgewiesen werden.[44] Eotragus wird in der Regel als ein Stammbovine angesehen, nur unwesentlich jünger ist Pseudoeotragus aus Mitteleuropa, das möglicherweise in die Ahnenlinie der Antilopinen gehört. Noch während des Miozäns kam es zur starken Diversifizierung innerhalb der Hornträger in Europa, Asien und Afrika, spätestens im Pliozän waren alle wichtigen Linien der Hornträger bereits vertreten. Einige entwickelten sich dabei exklusiv in Afrika wie etwa die Tragelaphini, die meisten waren aber relativ weit über Eurasien und Afrika verbreitet. Die Übersiedlung der Hornträger nach Nordamerika ist bisher wenig untersucht. Erste Vertreter dort sind aus dem Oberen Miozän vor rund 7,5 bis 6,8 Millionen Jahren überliefert und werden durch Neotragocerus mit ungenauem Verwandtschaftsverhältnis repräsentiert. Im Unteren Pliozän vor knapp 5 Millionen Jahren trat mit Sinocapra erstmals ein naher Verwandter der Schafe im südwestlichen Nordamerika auf.[45][46][47]
Forschungsgeschichte

Die Geschichte der Erforschung und systematischen Gliederung der Hornträger geht bis in die erste Hälfte des 19. Jahrhunderts zurück. Zuvor hatte Linnaeus in seinem Werk Systema naturae die Gattungen Capra, Ovis und Bos eingeführt, welche die Kerngruppe der heutigen Hornträger stellen. Er ordnete diese zusammen mit Camelus, Moschus und Cervus innerhalb der Pecora ein. Weitere Gattungen der Hornträger folgten zeitlich relativ kurz nach Linnaeus, etwa Antilope durch Peter Simon Pallas im Jahr 1766. Im späten 18. und früher 19. Jahrhundert wurden die Vertreter der heutigen Paarhufer in relativ unterschiedlichen Gruppierungen angesiedelt, Johann Friedrich Blumenbach beispielsweise verwies 1779 in seinem Handbuch der Naturgeschichte die Rinder, Schafe, Ziegen, Gazellen, Hirsche, Kamele und Schweine zu den „Bisulca“ (Tiere mit gespaltenen Klauen).[48] Den heute gültigen Familiennamen Bovidae für die Hornträger führte John Edward Gray im Jahr 1821 ein. Er stellte diesen aber zusätzlich noch die Capridae mit den Schafen und Ziegen sowie die Antilopidae zur Seite und ordnete alle zusammen mit den Moschidae (Moschustiere), den Cervidae (Hirsche) und den Giraffidae (Giraffen) in die Gruppe der Ruminantia (Wiederkäuer).[49] In seinem Katalogwerk des British Museum aus dem Jahr 1873 unterschied Gray für die Gruppe, die die Rinder, Schafe, Ziegen und Antilopen umfasst, bereits 16 Familien, einschließlich der Antilocapridae (Gabelhornträger), die noch bis in das späte 20. Jahrhundert als eng mit den Hornträgern verwandt galten.[50] Erst spätere Autoren fassten dann im Übergang vom 19. zum 20. Jahrhundert alle Formen unter den Begriff Bovidae zusammen, allerdings herrschte Unklarheit über die genaue innere Gliederung der Familie. Zumeist waren 10 bis 15 taxonomische Einheiten anerkannt, die in der Regel als Unterfamilie, teilweise aber auch als Triben geführt wurden.[17]
Max Schlosser erkannte Anfang des 20. Jahrhunderts erstmals die Zweiteilung der Hornträger und unterschied diese im Aufbau der Backenzähne, wobei er die Boodontia von den Aegodontia abtrennte. Boodonte Zähne (vergleichbar den „Mahlern“) zeichnen sich durch eine sehr große Kaufläche und prominente Leisten an der äußeren und inneren Seitenkanten sowie durch einen komplexen Umriss der zentralen Eintiefung aus, während aegodonte Zähne (in etwa den „Schneidern“ entsprechend) kleiner sind, flachere Seitenwände und eine weniger komplexe Eintiefung aufweisen.[18][5] Aufgrund der Zweiteilung der Hornträger führte Schlosser die Untertaxa auf der Ebene der Triben (gab ihnen aber die Namen von Unterfamilien). In seiner klassischen Systematik der Säugetiere aus dem Jahr 1945 folgte George Gaylord Simpson Schlosser nicht vollständig. Er teilte die Bovidae in fünf Unterfamilien, die nicht-bovinen Formen umfassten bei ihm mit den Cephalophinae, den Hippotraginae, den Antilopinae und den Caprinae vier Gruppen, und ordnete diesen insgesamt 13 Triben zu.[17] Ein weiterer Versuch einer Systematik wurde von Alan W. Gentry 1992 unternommen, der wie Simpson fünf Unterfamilien und 13 Triben unterschied, die aber ein abweichendes Arrangement besaßen. Nach einer kladistischen Analyse von Skelettmerkmalen kam er zu dem Schluss, dass Ducker und Rinder trotz ihrer großen Verschiedenheit dicht verwandt seien und in einer gemeinsamen Unterfamilie, den Bovinae, zusammengefasst werden müssten. Die Impalas wurden hier den Kuhantilopen zugeordnet, die Rehantilope und die Saiga den Gazellenartigen.[51] In ihrem Werk Mammal Species of the World unterschieden Don E. Wilson und DeeAnn M. Reeder 2005 wiederum acht Unterfamilien ohne auf spezielle Triben einzugehen.[52]
Alle vorhergehenden Gliederungsversuche basierten auf skelettanatomischen Merkmalen. Mit dem Aufkommen von molekulargenetischen Analyseverfahren Ende des 20. Jahrhunderts konnte die von Schlosser bereits bemerkte Zweiteilung der Hornträger besser aufgelöst werden. So ließen sich zwei Kladen unterscheiden, die Bovinae und die Antilopinae, die den Rang von Unterfamilien einnehmen. Die Antilopinae umfassen dabei alle nicht-bovinen Formen der vorangegangenen, anatomisch-morphologisch begründeten Gliederungsversuche.[19][15][16]
Literatur
- Richard D. Estes: Social organization of the African Bovidae. In: V. Geist und F. Walther (Hrsg.): The Behaviour of Ungulates and its relation to management. IUCN, Morges, 1974, S. 166–205
- Colin P. Groves und Peter Grubb: Ungulate Taxonomy. Johns Hopkins University Press, 2011, S. 1–317 (S. 108–280)
- Colin P. Groves und David M. Leslie Jr.: Family Bovidae (Hollow-horned Ruminants). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 444–779
- P. J. Jarman: The Social Organisation of Antelope in Relation to Their Ecology. Behaviour 48 (3/4), 1974, S. 215–267
- Don E. Wilson und D. M. Reeder: Mammal Species of the World. Johns Hopkins University Press, Baltimore 2005, ISBN 0-8018-8221-4
Einzelnachweise
- Meike Köhler: Skeleton and habitat of recent and fossil ruminants. Münchner Geowissenschaftliche Abhandlungen A 25, 1993, S. 1–88
- Colin P. Groves und David M. Leslie Jr.: Family Bovidae (Hollow-horned Ruminants). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 444–779
- Theodore Stankowich und Tim Caro: Evolution of weaponry in female bovids. Proceedings of the Royal Society B 276, 2009, S. 4329–4334
- Nikos Solounias: Family Bovidae. In: Donald R. Prothero und Scott E. Foss (Hrsg.): The Evolution of Artiodactyls. Johns Hopkins University, Baltimore, 2007, S. 278–291
- Alan W. Gentry: Bovidae. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, Los Angeles, London, 2010, S. 741–796
- Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume VI. Pigs, Hippopotamuses, Chevrotain, Giraffes, Deer and Bovids. Bloomsbury, London 2013, S. 120–606
- Andrew A. Farke: Evolution and functional morphology of the frontal sinuses in Bovidae (Mammalia: Artiodactyla), and implications for the evolution of cranial pneumaticity. Zoological Journal of the Linnean Society 159, 2010, S. 988–1014
- William J. Silvia, Charles H. Hamilton und William F. Silvia: The occurrence of metatarsal splint bones in ruminants and their potential use in establishing phylogenetic relationships. Zitteliana B 32, 2014, S. 155–162
- P. J. Jarman: The Social Organisation of Antelope in Relation to Their Ecology. Behaviour 48 (3/4), 1974, S. 215–267
- Richard D. Estes: Social organization of the African Bovidae. In: V. Geist und F. Walther (Hrsg.): The Behaviour of Ungulates and its relation to management. IUCN, Morges, 1974, S. 166–205
- Juan P. Zurano, Felipe M. Magalhães, Ana E. Asato, Gabriel Silva, Claudio J. Bidau, Daniel O. Mesquita und Gabriel C. Costa: Cetartiodactyla: Updating a time-calibrated molecular phylogeny. Molecular Phylogenetics and Evolution 133, 2019, S. 256–262
- Edward Byrd Davis: Family Antilocapridae. In: Donald R. Prothero und Scott E. Foss (Hrsg.): The Evolution of Artiodactyls. Johns Hopkins University, Baltimore, 2007, S. 227–240
- Jonathan D. Marcot: Molecular Phylogeny of terrestrial artioidactyls. In: Donald R. Prothero und Scott E. Foss (Hrsg.): The Evolution of Artiodactyls. Johns Hopkins University, Baltimore 2007, S. 4–18
- Michelle Spaulding, Maureen A. O’Leary und John Gatesy: Relationships of Cetacea (Artiodactyla) Among Mammals: Increased Taxon Sampling Alters Interpretations of Key Fossils and Character Evolution. PlosOne 4 (9), 2009, S. e7062
- Alexandre Hassanin, Frédéric Delsuc, Anne Ropiquet, Catrin Hammer, Bettine Jansen van Vuuren, Conrad Matthee, Manuel Ruiz-Garcia, François Catzeflis, Veronika Areskoug, Trung Thanh Nguyen und Arnaud Couloux: Pattern and timing of diversification of Cetartiodactyla (Mammalia, Laurasiatheria), as revealed by a comprehensive analysis of mitochondrial genomes. Comptes Rendus Palevol 335, 2012, S. 32–50
- Fayasal Bibi: A multi-calibrated mitochondrial phylogeny of extant Bovidae (Artiodactyla, Ruminantia) and the importance of the fossil record to systematics. BMC Evolutionary Biology 13, 2013, S. 166
- George Gaylord Simpson: The Principles of Classification and a Classification of Mammals. Bulletin of the American Museum of Natural History 85, 1945, S. 1–350 (S. 270–272)
- Max Schlosser: Mammalia, Säugetier. In: Karl von Zittel: Grundzüge der Paläontologie (Paläozoologie). München, Berlin, 1911, S. 497–506
- Alexandre Hassanin und Emmanuel J. P. Douzery: The Tribal Radiation of the Family Bovidae (Artiodactyla) and the Evolution of the Mitochondrial Cytochrome b Gene. Molecular Phylogenetics and Evolution 13 (2), 1999, S. 227–243
- Colin Groves und Peter Grubb: Ungulate Taxonomy. Johns Hopkins University Press, 2011, S. 1–317 (S. 108–280)
- Jose R. Castello: Bovids of the World. Princeton University Press, 2015, S. 1–662
- Eva V. Bärmann und Tim Schikora: The polyphyly of Neotragus – Results from genetic and morphometric analyses. Mammalian Biology 79, 2014, S. 283–286
- Alexandre Hassanin und Anne Ropiquet: Molecular phylogeny of the tribe Bovini (Bovidae, Bovinae) and the taxonomic status of the Kouprey, Bos sauveli Urbain 1937. Molecular Phylogenetics and Evolution 33, 2004, S. 896–907
- Anne R Johnston und Nicola M Anthony: A multi-locus species phylogeny of African forest duikers in the subfamily Cephalophinae: evidence for a recent radiation in the Pleistocene. BMC Evolutionary Biology 12, 2012, S. 120, doi:10.1186/1471-2148-12-120
- Colin Groves: Current taxonomy and diversity of crown ruminants above the species level. Zitteliana B 32, 2014, S. 5–14
- Rasmus Heller, Peter Frandsen, Eilene D. Lorenzen und Hans R. Siegismund: Are There Really Twice as Many Bovid Species as We Thought? Systematic Biology 62 (3), 2013, S. 490–493
- Frank E. Zachos, Marco Apollonio, Eva V. Bärmann, Marco Festa-Bianchet, Ursula Göhlich, Jan Christian Habel, Elisabeth Haring, Luise Kruckenhauser, Sandro Lovari, Allan D. McDevitt, Cino Pertoldi, Gertrud E. Rössner, Marcelo R. Sánchez-Villagra, Massimo Scandura und Franz Suchentrunk: Species inflation and taxonomic artefacts — A critical comment on recent trends in mammalian classification. Mammalian Biology 78, 2013, S. 1–6
- Frank E. Zachos: Commentary on taxonomic inflation, species delimitation and classification in Ruminantia. Zitteliana B 32, 2014, S. 213–216
- Arlene T. Kumamoto, Steven C. Kingswood und Wouter Hugo: Chromosomal divergence in allopatric populations of Kirk's Dikdik, Madoqua kirki (Artiodactyla, Bovidae). Journal of Mammology 75 (2), 1994, S. 357–364
- Yoshan Moodley, Michael W. Bruford, Christoph Bleidorn, Torsten Wronski, Ann Apio und Martin Plath: Analysis of mitochondrial DNA data reveals non-monophyly in the bushbuck (Tragelaphus scriptus) complex. Mammalian Biology 74, 2009, S. 418–422
- Fenton P. D. Cotterill: Insights into the taxonomy of tsessebe antelopes Damaliscus lunatus (Bovidae: Alcelaphini) with the description of a new evolutionary species in south-central Africa. Durban Museum Novitates 28, 2003, S. 11–30
- Fenton P. D. Cotterill: The Upemba lechwe, Kobus anselli: an antelope new to science emphasizes the conservation importance of Katanga, Democratic Republic of Congo. Journal of Zoology 265, 2005, S. 113–132
- Eline D. Lorenzen, Peter Arctander und Hans R. Siegismund: Three reciprocally monophyletic mtDNA lineages elucidate the taxonomic status of Grant’s gazelles. Conservation Genetics 9, 2008, S. 593–601
- Marc Colyn, Jan Huselmans, Gontran Sonet, Pascal Oudé, Jan De Winter, Armand Natta, Zolatán Tamás Nagy und Erik Verheyen: Discovery of a new duiker species (Bovidae: Cephalophinae) from the Dahomey Gap, West Africa. Zootaxa 2637, 2010, S. 1–30
- Anne Ropiquet und Alexandre Hassanin: Molecular evidence for the polyphyly of the genus Hemitragus (Mammalia, Bovidae). Molecular Phylogenetics and Evolution 36, 2005, S. 154–168
- Spartaco Gippoliti, Fenton P.D. Cotterill und Colin P. Groves: Mammal taxonomy without taxonomists: a reply to Zachos and Lovari. Hystrix, the Italian Journal of Mammalogy 24 (2), 2013, S. 145–147
- Fenton P. D. Cotterill, Peter J. Taylor, Spartaco Gippoliti, Jaqueline M. Bishop und Colin P. Groves: Why One Century of Phenetics is Enough: Response to “Are There Really Twice As Many Bovid Species As We Thought?” Systematic Biology 63 (5), 2014, S. 819–832
- Spartaco Gippoliti, Fenton P. D. Cotterill, Dietmar Zinner und Colin P. Groves: Impacts of taxonomic inertia for the conservation of African ungulate diversity: an overview. Biological Reviews 93 (1), 2018, S. 115–130, doi:10.1111/brv.12335
- Kenneth D. Rose: Skeleton of Diacodexis, Oldest Known Artiodactyl. Science 216, 1982, S. 621–623
- John C. Barry, Susanne Cote, Laura MacLatchy, Everett H. Lindsay, Robert Kityo und A. Rahim Rajpar: Oligocene and Early Miocene Ruminants (Mammalia, Artiodactyla) from Pakistan and Uganda. Palaeontologia Electronica 8 (1), 2005, S. 22A (PDF)
- Israel M. Sánchez, M. Soledad Domingo und Jorge Morales: The genus Hispanomeryx (Mammalia, Ruminantia, Moschidae) and its bearing on musk deer phylogeny and systematics. Palaeontology 53 (5), 2010, S. 1023–1047
- V. Quiralte und J. Morales: Andegameryx andegaviensis Ginsburg, 1971 (Artiodactyla, Ruminantia,) from the early Miocene site of Estrepouy (MN3, France). Estudios Geológicos 67 (2), 2011, S. 423–426
- Bastien Mennecart, Grégoire Métais, Loïc Costeur, Léonard Ginsburg und Gertrud E. Rössner: Reassessment of the enigmatic ruminant Miocene genus Amphimoschus Bourgeois, 1873 (Mammalia, Artiodactyla, Pecora). PLoS ONE 16 (1), 2021, S. e0244661, doi:10.1371/journal.pone.0244661
- Kantapon Suraprasit, Yaowalak Chaimanee, Olivier Chavasseau und Jean-Jaques Jaeger: Middle Miocene bovids from Mae Moh Basin, Northern Thailand: The first record of the genus Eotragus from Southeast Asia. Acta Palaeontologica Polonica 60 (1), 2015, S. 67–78
- Jim I. Mead und Louis H. Taylor: New Species of Sinocapra (Bovidae, Caprinae) from the Lower Pliocene Panaca Formation, Nevada, USA. Palaeontologia Electronica 8 (1), 2005, S. 11A (PDF)
- Fayasal Bibi, Maia Bukhsianidze, Alan W. Gentry, Denis Geraads, Dimitri S. Kostopoulos und Elisabeth S. Vrba: The Fossil Record and Evolution of Bovidae: State of the Field. Palaeontologia Electronica 12 (3), 2009, S. 10A (PDF)
- Alan W. Gentry, Getrud E. Rössner und Elmar P. J. Heizmann: Suborder Ruminantia. In: Gertrud E. Rössner und Kurt Heissig: The Miocene land mammals of Europe. München 1999, S. 225–257
- Johann Friedrich Blumenbach: Handbuch der Naturgeschichte. Göttingen 1779, S. 1–448 (S. 112–128)
- John Edward Gray: On the natural arrangement of vertebrose animals. London Medical Repository 15, 1821, S. 297–310 (306–307)
- John Edward Gray: Catalogue of ruminant Mammalia (Pecora, Linnaeus), in the British Museum. London, British Museum (Natural History), 1872, S. 1–102 ()
- Alan W. Gentry: The subfamilies and tribes of the family Bovidae. Mammal Review 22 (1), 1992, S. 1–32
- Don E. Wilson und DeeAnn M. Reeder: Mammal Species of the World. Johns Hopkins University Press, Baltimore, 2005 ISBN 0-8018-8221-4 ()