Gabelbock
Der Gabelbock (Antilocapra americana), auch als Gabelhornantilope, Gabelantilope, Gabelhorntier, Gabelhornträger oder Pronghorn bekannt, ist ein nordamerikanischer Wiederkäuer der Prärie. Obwohl seine Gestalt an die Antilopen Afrikas und Asiens erinnert, gehört er nicht zu deren Familie der Hornträger. Er bildet die heute monotypische Familie der Gabelhornträger (Antilocapridae) als ihr einziger rezenter Vertreter.
| Gabelbock | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Männlicher Gabelbock (Antilocapra americana) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Familie | ||||||||||||
| Antilocapridae | ||||||||||||
| J. E. Gray, 1866 | ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Antilocapra | ||||||||||||
| Ord, 1818 | ||||||||||||
| Wissenschaftlicher Name der Art | ||||||||||||
| Antilocapra americana | ||||||||||||
| (Ord, 1815) |

Merkmale
Habitus
Der Gabelbock ist in etwa so groß wie ein Damhirsch. Er hat eine Kopfrumpflänge von bis zu 150 Zentimetern (der Schwanz ist 8 bis 15 cm lang), eine Körperhöhe von 90 Zentimetern und ein Gewicht von 50 bis 70 Kilogramm. Die Männchen sind etwas größer als die Weibchen (Sexualdimorphismus). Das Fell ist oberseits gelb- bis rotbraun und unterseits bis zu den Flanken weiß gefärbt; weiße Bänder finden sich zudem auf der Vorderseite des Halses und um das Maul herum. Die Männchen haben außerdem eine schwarze Zeichnung im Gesicht und am Hals. Ein Gabelbock kann seine Körperhaare aufrichten. Durch das Aufstellen der weißen Rumpfhaare gibt er ein weithin sichtbares Signal, das in einer Herde als Warnung wahrgenommen wird.
Unterscheidbar sind die Geschlechter auch durch die Hörner. Beim Männchen können sie bis zu 25 cm lang werden (meist sind sie doppelt so lang wie die Ohren) und gabeln sich in ein kurzes nach vorne gerichtetes und ein langes nach oben gerichtetes und etwas zurückgebogenes Ende – von dieser Eigenschaft leitet sich ihr deutscher Name ab. Weibchen haben oft gar keine Hörner; falls doch, dann sind diese niemals länger als die Ohren.
Unter den Sinnesorganen des Gabelbocks kommt dem Auge die größte Bedeutung zu. Durch die Lage der Augen an den Kopfseiten hat ein Gabelbock die Möglichkeit, ein Blickfeld von nahezu 360° zu beobachten. Gehör- und Geruchssinn sind von etwas geringerer Bedeutung, beide sind aber dennoch gut entwickelt. Die Ohren können aufgestellt und in verschiedene Richtungen gewendet werden. Die Nase spielt vor allem beim Erkennen von Reviergrenzen eine Rolle.
Anders als bei anderen Paarhufern fehlen die Afterklauen vollständig, die Gliedmaßen tragen also nur die dritte und die vierte Zehe.
Gabelböcke zeichnen sich durch eine außergewöhnliche Sprungkraft aus. So können sie mit einem einzigen Sprung bis zu sechs Meter vorwärts schnellen.
Schädel- und Gebissmerkmale

Der Gabelbock besitzt ein reduziertes Gebiss: im Unterkiefer sind je Kieferhälfte 3 Schneidezähne, 1 Eckzahn, 3 Prämolaren und 3 Molaren ausgebildet, im Oberkiefer fehlen die Schneide- und Eckzähne. Die Zahnformel lautet somit , insgesamt sind also 32 Zähne ausgebildet. Die unteren Schneidezähne besitzen eine spachtelartige Form, ähnlich ist der Eckzahn gestaltet (incisiform). Die Backenzähne sind allgemein hochkronig (hypsodont) und weisen auf den Kauflächen ein mondsichelartig geformtes (selenodontes) Zahnschmelzmuster auf.[1][2] Hervorzuheben ist vor allem die Hochkronigkeit, die teilweise jene der spezialisierten Grasfresser unter den Rindern übertrifft.[3]
Hörner
Eine Besonderheit stellen die Hörner dar, die direkt oberhalb des Augenfensters ansetzen. Wie die der Hornträger bestehen sie aus einer knöchernen Grundlage (Schaft), die mit Keratin überzogen ist (Hornscheide). Dabei gabelt sich der Hornschaft beim heutigen Gabelbock selber nicht, nur der Keratinüberzug bildet die beiden Hornspitzen aus. Jedes Jahr werden die Hornscheiden nach der Brunft etwa ab Oktober gewechselt. Nur die Knochenzapfen bleiben zeitlebens bestehen, während die Hornscheide sich ablöst und zu Boden fällt. Darunter hat sich zu diesem Zeitpunkt bereits neue Hornmasse gebildet, die noch mit einem pelzigen Überzug bedeckt ist. Das jährliche Wachstum des Keratinüberzuges ist nach rund zehn Monaten abgeschlossen. In dieser Hinsicht ähnelt der Gabelbock den Hirschen, die ihr Geweih jährlich wechseln, weicht aber markant von den Hornträgern ab, bei denen es nicht zu einem Austausch der Hornscheide kommt. Fossile Vertreter der Gabelhornträger besaßen zum Teil sehr komplexe Hörner mit mehreren oder vielfach gegabelten beziehungsweise in sich gedrehten Schäften. Hier ist unklar, ob es ebenfalls zu einem jährlichen Abrieb der Hornscheide kam. Einige Experten sehen darin ein besonderes Merkmal des heute lebenden Gabelbocks. Die frühesten Gabelhornträger besaßen noch mit Haut überzogene Hörner, was anhand von Blutkanälchen an den Hornschäften nachgewiesen wurde.[4][3]
Verbreitung
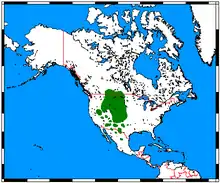

Der Gabelbock entwickelte sich in den Grasländern Nordamerikas und war einst weit über die Prärie und auch in den Wüsten und Halbwüsten der südwestlichen USA sowie des nordwestlichen Mexiko verbreitet. Er bevorzugt Regionen mit weitem Sichtfeld und einer mosaikartigen Vegetation aus offenen Steppen- und Staudenlandschaften. Ursprünglich über weite Bereiche der Großen Ebenen bis hin zum Saskatchewan River im Norden verbreitet, ist er seit der Besiedlung Nordamerikas durch die Europäer in höhere Gebirgslagen des westlichen Kontinentalteiles zurückgedrängt worden. In den Rocky Mountains kommt er bis in Höhen von 3350 m vor. Generell meidet der Gabelbock geschlossenere Landschaften (siehe auch: Bedrohung und Schutz).[1][2]
Lebensweise
Gabelböcke können zu allen Tages- und Nachtzeiten aktiv sein, sind dies jedoch überwiegend während der Dämmerung. Wo die Umstände es erforderlich machen, führen sie jahreszeitliche Wanderungen durch, die über Strecken von bis zu 260 Kilometern[5] führen können. Dies ist beispielsweise in Wüsten notwendig, um Wasserläufe zu suchen, oder in felsigen Gegenden, die im Winter kein ausreichendes Nahrungsangebot haben. Die weitesten untersuchten Wanderungen führen aus dem Grand-Teton-Nationalpark über die Gros Ventre Range zum Oberlauf des Green Rivers in Wyoming.[6]
Im Sommer werden ältere Männchen zu Einzelgängern und versuchen, durch Kämpfe ein Territorium zu erstreiten. In diesem sammeln sie einen Harem um sich. Ein Territorium kann vier Quadratkilometer umfassen und wird durch Urin markiert und somit abgesteckt. Das Männchen ist fortan damit beschäftigt, andere Männchen am Betreten und Weibchen am Verlassen des Territoriums zu hindern. Bei einem Aufeinandertreffen zweier Männchen reichen meistens Drohgebärden mit lauten Schreien und Scheinattacken aus, um über Sieger und Verlierer zu entscheiden. Kommt es doch einmal zum Kampf, können die scharfkantigen Hörner ernsthafte Verletzungen und sogar den Tod verursachen.
Im Herbst und im Winter tun sich all die kleinen Verbände mit einzelgängerischen Männchen zu großen Herden zusammen, die in historischen Zeiten mehrere zehntausend Tiere umfassen konnten, heute jedoch maximal aus wenig mehr als 1000 Tieren bestehen.

Jüngere Männchen, die noch nicht kämpfen können, finden sich zu kleinen Verbänden zusammen; alte Männchen, die zu schwach zum Kämpfen geworden sind, bleiben einzelgängerisch und versuchen, den Revieren der Artgenossen auszuweichen. Die Weibchen leben in Gruppen von etwa 20 Tieren. Nach einer Tragzeit von achteinhalb Monaten sondert sich das Weibchen von der Herde ab und bringt ein bis zwei, sehr selten drei Junge mit einem Geburtsgewicht von etwa drei Kilogramm zur Welt. Diese haben zunächst ein graues Fell, das nach drei Monaten die typischen Farben der Alttiere annimmt. Die ersten drei Tage werden sie in einem Versteck gehalten, und etwa nach einer Woche können junge Gabelböcke selbst rennen. Obwohl sie schon nach drei Wochen Gras zu sich nehmen, werden sie noch fünf bis sechs Monate lang gesäugt. Die Geschlechtsreife erreichen die Weibchen mit 15 bis 16, die Männchen mit etwa 24 Monaten.
Gabelböcke haben eine geringe Lebenserwartung und werden selbst unter günstigen Umständen selten älter als zehn Jahre.
Ernährung
Der Gabelbock ist stark wählerisch in seinem Nahrungsverhalten. Generell ernährt er sich von verschiedenen Pflanzen, vor allem von Kräutern, Blättern, Sprossen und Gräsern. Häufig verbringt ein Tier nur relativ kurze Zeit, etwa eine halbe Minute, an einer Nahrungsressource. Vor allem im Frühjahr und zu Beginn des Sommers bevorzugt der Gabelbock Gras, während er im Herbst und Winter Blätter an Stauden frisst. Bedeutend sind hierbei vor allem Artemisia-Gewächse. In Trockenlandschaften bilden zudem Kakteen einen Teil der Ernährungsgrundlage.[1][2]
Geschwindigkeit
Im Laufen können Gabelböcke Geschwindigkeiten von 60 bis 70 km/h erreichen; anhand von gemessenen Schrittlängen wurde sogar eine Geschwindigkeit von 86,5 km/h angenommen.[7] Derart hohe Geschwindigkeiten können über eine Strecke von bis zu fünf Kilometern durchgehalten werden. Eine Distanz von 11 Kilometern können sie in 10 Minuten bei einer Durchschnittsgeschwindigkeit von 65 km/h überwinden. Die Tiere sind also eher Langstreckenläufer als Sprinter. Die körperliche Anpassung an solche Geschwindigkeiten besteht nicht nur in dem schlanken Körperbau und den kräftigen Beinen, sondern auch in einer Vergrößerung von Lungen und Herz – das Herz eines Gabelbocks ist etwa doppelt so groß wie das eines Hausschafs. Weitere Anpassungen bestehen beispielsweise in einer erhöhten Anzahl der Mitochondrien pro Muskelvolumen. Es sind solche Verstärkungen der allgemeinen Säugetierstrukturen – und nicht die Entwicklung neuer Strukturen –, die es dem Gabelbock ermöglichen, einen höheren Sauerstoffanteil aus der Atemluft aufzunehmen und zu verwerten, als es für ein Säugetier seiner Größe zu erwarten ist.[8]
Oft stößt man auf die Aussage, Gabelböcke seien nach dem Gepard die schnellsten Säugetiere der Welt.[8] Hier ist aber die Frage, ob die Höchst- oder die Durchschnittsgeschwindigkeit gemeint ist. Über sehr kurze Distanzen können manche afrikanisch-asiatische Antilopen, wie zum Beispiel die Hirschziegenantilope, die gleiche Geschwindigkeit erreichen. Allerdings sind Gabelböcke die schnellsten Säugetiere des amerikanischen Doppelkontinents und, gemessen über eine Strecke von fünf Kilometern, wahrscheinlich sogar die schnellsten Säugetiere überhaupt.
Natürliche Feinde
Die natürlichen Feinde des Gabelbocks sind vor allem der Wolf, der Kojote und der Puma.[7] Diese reißen ob der Schnelligkeit ihrer Beutetiere jedoch meistens nur junge, alte oder kranke Individuen. Durch gezielte Tritte mit den Hinterhufen versuchen Gabelböcke, sich gegen die Angreifer zur Wehr zu setzen, was vor allem bei Kojoten oft Erfolg hat. Als Hauptwaffe gegen Fressfeinde gilt aber ihre Geschwindigkeit. Neben diesen natürlichen Feinden stellt jedoch auch der Mensch eine große Bedrohung für den Gabelbock dar.
Zu den ursprünglichen natürlichen Feinden gehörten unter anderem der Gepard Miracinonyx trumani, der Löwe Panthera atrox und möglicherweise auch der Kurznasenbär.[7] Da die maximale Höchstgeschwindigkeit von 86 km/h weit höher ist als nötig, um den heutigen Jägern zu entkommen, wurde teilweise angenommen, dass der Gabelbock aufgrund von Nachstellungen durch Miracinonyx seine guten Laufeigenschaften entwickelt habe.[7] Dieses mutmaßliche Beispiel einer Koevolution in der Räuber-Beute-Beziehung (auch Red-Queen-Hypothese) lässt sich nach Ansicht zahlreicher Wissenschaftler jedoch nicht belegen: Während schon die frühesten Vertreter der Gabelhornträger vom beginnenden Miozän an vor rund 20 Millionen Jahren aus anatomischen Gründen als extrem schnelle Läufer anzusehen sind, stammt der älteste Nachweis der Katze in Nordamerika erst aus dem ausgehenden Pliozän.[9]
Systematik und Evolution
Taxonomie
|
Der Gabelbock wird als eigenständige Art und monotypische Gattung Antilocapra den Wiederkäuern (Ruminantia) innerhalb der Paarhufer (Artiodactyla) zugeordnet. Dort bildet er zudem die Familie der Gabelhornträger (Antilocapridae).[11] Die nähere Verwandtschaft des Gabelbocks war lange Zeit vollkommen unklar. Obwohl er schon frühzeitig in eine eigene Familie gestellt wurde, wurde er von manchen Autoren bis in die 1980er Jahre als Teil der Hornträger (Bovidae) betrachtet und dort der eigenen Unterfamilie Antilocaprinae zugeordnet. Auf der Basis morphologischer Daten wurde der Gabelbock ursprünglich als Schwesterart der Hirsche (Cervidae) eingeordnet, vor allem aufgrund des Aufbaus des Tränenbeines, der sich bei den beiden Gruppen ähnelt und sie von allen anderen Paarhufern abgrenzt.[12] Genetische Untersuchungen legten dagegen ein Schwestergruppenverhältnis der Moschustiere (Moschidae) und der Hirsche nahe, während der Gabelbock nicht mehr in die nähere Verwandtschaft der Hirsche gestellt wurde.[12][13] Karyologische Analysen ergaben, dass der Gabelbock mit seinen aus 58 Chromosomen bestehenden Genom einen vergleichsweise ursprünglichen Zustand innerhalb der Stirnwaffenträger (Pecora) repräsentiert. Obwohl die Giraffen (Giraffa) mit nur 30 Chromosomen zahlreiche Verschmelzungen im Genom aufweisen, wird eine nahe Verwandtschaft dieser beiden Taxa an der Basis der Pecora angenommen. Die Struktur des X-Chromosoms deutet dabei darauf hin, dass der Gabelbock die Schwesterart der Giraffen sein könnte, alternativ stellen sie – wie hier im Kladogramm dargestellt – die Schwesterart aller übrigen Pecora dar.[14] Die Verschiebung der Antilocapridae an die Basis der Stirnwaffenträger zeigt auf, dass die Ausbildung der mit Keratin überzogenen, knöchernen Hörner eine echte konvergente und nicht nur parallele Entwicklung zu den Hörnern der Boviden ist. Zudem nehmen die Antilocapridae und somit auch der Gabelbock dadurch eine Schlüsselstellung für das Verständnis der Entwicklung der Stirnwaffen bei den Wiederkäuern ein.[3]
Innere Systematik der Antilocapridae nach Semprebon et al. 2007[15] und Davis 2007[3] (nicht vollständig)
|
Die Gabelhornträger stellen heute eine monotypische Familie mit dem Gabelbock als einzigem Mitglied dar. Fossil sind aber wenigstens 20 Gattungen mit insgesamt rund 60 Arten bekannt, die alle aus Nordamerika stammen. Der phylogenetische Vorgänger der Antilocapridae ist unbekannt, dürfte aber in asiatischen Paarhufern des Oligozän zu finden sein. Die Unterscheidung der einzelnen Mitglieder der Gabelhornträger erfolgt überwiegend anhand der unterschiedlich gestalteten Hornschäfte, weniger anhand schädel- und skelettanatomischer Merkmale. Da die letzte Revision der Familie im Jahr 1937 erfolgte, wird eine neue angemahnt, die auf Gattungs- und Artebene durchgeführt werden sollte und bei der ebenfalls Merkmale des Skelett- und Schädelbaus mit einzubeziehen wären.[3]
Die Familie teilt sich in zwei Hauptlinien auf. Zur einen gehören die kleineren „Merycodontinae“, die nur 7 bis 10 kg schwer wurden, aber möglicherweise eine paraphyletische Unterfamilie darstellen. Charakterisiert sind sie neben der allgemein geringeren Körpergröße durch schmalere und runde Hornschäfte mit einem oder mehreren knöchernen Graten oder Ringen an der Basis, durch das Vorhandensein der oberen Eckzähne und durch rudimentäre, seitliche Zehen an den Vorderfüßen. Sie kamen vor allem im Unteren Miozän bis zum Beginn des Oberen Miozän vor etwa 20,6 bis 10,3 Millionen Jahren vor. Die spätesten Formen überlappen zeitlich ein wenig mit den Antilocaprinae, der stammesgeschichtlich jüngeren Gruppe mit durchschnittlich größeren Tieren (30 bis 80 kg), die erstmals im Mittleren Miozän vor rund 15 Millionen Jahren auftritt. Deren besondere Merkmale umfassen seitlich abgeflachte Hornschäfte ohne basale Grate, eine Keratinhülle um die Hörner, eine hochkronige Bezahnung und fehlende Seitenstrahlen an den Vorderfüßen. Zudem sind die Metapodien deutlich verlängert und erinnern an jene der Hirsche. Innerhalb der Antilocaprinae bestehen ebenfalls einige Entwicklungslinien. So stellen die Ilingocerotini Formen mit gedrehten Hörnern dar, die entfernt an jene der Kudus erinnern. Die Stockocerotini kennzeichnen wiederum vier bis sechs knöcherne Hornschäfte, die oberhalb der Orbita wachsen. Die Antilocaprini werden durch den Gabelbock repräsentiert. Dessen nächste verwandte Gattung stellt hier Texoceros dar, der im Gegensatz zum Gabelbock einen gegabelten knöchernen Hornschaft besitzt.[15][3] Innerhalb der Gattung Antilocapra ist Antilocapra pacifica die Schwesterart, welche 1991 anhand mehrerer Hornschäfte und Schädelfragmente beschrieben worden war. Gefunden wurden diese im Contra Costa County im US-Bundesstaat Kalifornien, sie können aber nur allgemein in das Pleistozän datiert werden. Die Vertreter dieser Art erreichten etwa die Größe des heutigen Gabelbocks, besaßen aber ausgeprägtere Hörner.[16]
Vom heutigen Gabelbock können je nach Lehrmeinung vier bis sechs Unterarten unterschieden werden, von denen der Status der vier folgenden unumstritten ist:[11]
- A. a. americana (Ord, 1815); in der Prärie der USA und Kanadas
- A. a. mexicana Merriam, 1901; in den Halbwüsten des Südwestens der USA und den angrenzenden Gegenden Mexikos
- A. a. peninsularis Nelson, 1912; in Baja California
- A. a. sonoriensis Goldman, 1945; in Süd-Arizona und Nordmexiko
Die manchmal ebenfalls als Unterarten geführten Antilocapra americana anteflexa und Antilocapra americana oregona sind dagegen wohl Synonyme der Unterart Antilocapra americana americana. Die Erstbeschreibung der Art erfolgte 1815 durch George Ord als Antilope americanus[1] anhand von Individuen aus den Ebenen und dem Hochland entlang des Missouri River in den Vereinigten Staaten.[11] 1818 richtete Ord zudem die Gattung Antilocapra ein und ordnete dieser Antilocapra americana als Typusart zu.[1]
Stammesgeschichte

Die einst artenreiche Familie der Gabelhornträger trat erstmals im Unteren Miozän vor rund 20 Millionen Jahren in den Gras- und Savannenlandschaften des westlichen Nordamerika auf. Die Tiere waren schon relativ gut entwickelt und mit ihrem grazilen Körperbau und langen Gliedmaßen von Beginn an an die offenen Landschaften angepasst, sie stellten somit schnellläufige (cursoriale) Paarhufer dar. Hinweise auf phylogenetische Vorgänger gibt es nicht. Da aus Nordamerika keine älteren Stirnwaffenträger bekannt sind, wanderten die Vorläufer der Gabelhornträger möglicherweise aus Eurasien ein. Als nächster Verwandter kann Amphimoschus angesehen werden, der aus zahlreichen Fundstellen des Unteren und Mittleren Miozäns Europas belegt ist. Dieser besaß allerdings keine Stirnwaffen, die Übereinstimmungen zu den Gabelhornträgern finden sich überwiegend im Bau des Innenohrs.[17] Unter den Gabelhornträgern Nordamerikas erschienen zuerst die kleinen „Merycodontinae“, deren Hörner noch mit Haut überzogen waren. Der früheste bekannte Vertreter war Paracosoryx mit einem sehr langen, weit oben gegabelten Gehörn. Andere frühe Formen werden durch Meriamoceros repräsentiert, das kurze, am oberen Ende zu kleinen Schaufeln umgebildete Hörner aufwies. Recht erfolgreich war Ramoceros, das erst vor 10 Millionen Jahren verschwand und ein vielfach gegabeltes, den Geweihen der Hirsche ähnelndes Gehörn besaß. Dieses war aber teilweise asymmetrisch aufgebaut, so dass eine Seite länger war als die andere. Die Typusform der frühen Antilocapridae stellte Merycodus dar, dessen Besonderheit ein gegabelter Hornschaft mit zwei gleich langen Sprossen ist. Da etwas mehr als die Hälfte der aufgefundenen Schädel hornlos ist, gehen Wissenschaftler davon aus, dass weibliche Tiere nicht über Hörner verfügten. Als einer der ersten Vertreter der Gabelhornträger ist Merycodus auch im nördlichen Teil des heutigen Mexikos nachgewiesen.[18] Trotz ihres Vorkommens in offenen Landschaften ernährten sich die frühen Gabelhornträger weitgehend von gemischter Pflanzenkost.[15][3][9]

Im Mittleren Miozän vor rund 15 Millionen Jahren sind dann mit Plioceros, ein kurzhalsiges Tier mit sehr breiten und kurzen Hörnern, die ersten Vertreter der Antilocaprinae mit Keratin überzogenen Hornbildungen nachgewiesen. Plioceros war dabei noch relativ klein, besaß aber schon extrem hochkronige Zähne. Es stellt zudem eine der am weitesten verbreiteten Angehörigen der Gabelhornträger dar und ist von der Westküste des nordamerikanischen Kontinentes bis nach Florida an der Ostküste überliefert. Ein bedeutendes Fundgebiet ist zudem die Ash-Hollow-Formation im Mittleren Westen. Im Oberen Miozän und im Pliozän erreichten die Antilocaprinae ihre größte Vielfalt, sie sind zu jener Zeit mit 9 Gattungen und 30 Arten bekannt. Osbornoceros aus dem Oberen Miozän sah dabei dem heutigen Gabelbock schon ähnlich, besaß aber eher gewundene Hörner. Er gehörte weiterhin zu den ersten Vertretern, die vermehrt hartes Gras zu sich nahmen.[15][3][9]

Im Verlauf des Pliozän begann langsam der Niedergang der Gabelhornträger. Allerdings erschienen zu dieser Zeit mit den Stockocerotini eine Gruppe gedrungener Tiere, die sich dem eiszeitlichen Klima anpassten und die eine heute ausgestorbene Seitenlinie repräsentieren. Der älteste Vertreter aber war Hexameryx, der durch sechs weit zueinander divergierende Hornschäfte, drei an jeder Kopfseite, geprägt war, allerdings bisher nur aus dem Oberen Miozän von Florida bekannt ist.[19] Capromeryx stellt weiterhin eine Form dar, die sich durch eine markante Körpergrößenreduktion auszeichnete. Im Durchschnitt waren Individuen des Oberen Pleistozän rund 14 bis 30 % kleiner als solche des Unteren. Der Verzwergungsprozess verlief dabei isometrisch.[20] Die jeweils zwei Hornschäfte je Kopfseite standen bei Capromeryx sehr eng beieinander und waren Untersuchungen zufolge wohl zusammen von einer Keratinschicht umgeben. Dabei gehört die Gattung zu den häufig aufgefundenen Gabelhornträgern sowohl in den heutigen USA als auch im angrenzenden Mexiko.[21][22] In die gleiche Entwicklungslinie sind auch Hexobelomeryx und Hayoceros zu stellen, die zu den am stärksten angepassten Grasfressern innerhalb der Gabelhornträger gehörten. Das für die Gruppe namengebende Stockoceros wies insgesamt vier gleich lange Hornschäfte, die von beiden Geschlechtern getragen wurden, und weniger hypsodonte Backenzähne auf, es verblieb weitgehend bei der gemischten Pflanzenkost.[23] Zudem gehört Stockoceros zu den spätesten Vertretern der fossilen Gabelhornträger und trat etwa zeitgleich mit den ersten Angehörigen der heutigen Gattung Antilocapra auf. Allein 7 Teilskelette, 55 Schädel und fast 800 weitere Skelettreste sind von dieser fossilen Gattung aus der Papago Springs Cave nahe Sonoita in Arizona bekannt.[24] Während am Ende der Letzten Kaltzeit all diese Arten ausstarben, überlebte der Gabelbock, den es auch bereits im Pleistozän gegeben hatte, als einziger.[15][3]
Menschen und Gabelböcke
Bedeutung des Gabelbocks für die Indianer
Für die Indianer der Prärie waren Gabelböcke wertvolle Fleischlieferanten. Da sie ein überaus häufiges Wild waren – noch 1800 gab es etwa 40 Millionen Einzeltiere in der Prärie – spielten sie im indianischen Alltag oft eine große Rolle. Die Westlichen Shoshone kannten eine zeremonielle Gabelbockjagd, die von einem Schamanen eingeleitet wurde. Wie die Bisonjagd hatte die Jagd auf Gabelböcke eine religiöse Dimension. Eine Gruppe Jäger trieb die Tiere mit Hilfe eines Feuers in die Hände einer zweiten Gruppe Jäger, in die Richtung eines Flusses oder in einen zuvor vorbereiteten Korral, ein Fanggehege für wilde Tiere. Die Nördlichen Shoshone hingegen streiften sich Felle von Gabelböcken über und pirschten sich so getarnt möglichst nah an eine Herde heran. Auch nach der Verfügbarkeit des Pferdes war die Gabelbockjagd eine anspruchsvolle Herausforderung, da Gabelböcke schneller als Pferde zu laufen vermögen.
Die Lakota begehrten die Gabelböcke nicht nur wegen ihres Fleisches, sondern auch wegen ihrer Felle, die sie gerne für die Herstellung von Kleidung verwendeten. Den Bestand des Gabelbocks konnten die amerikanischen Ureinwohner mit ihren Jagdmethoden jedoch nicht in nennenswerter Weise beeinträchtigen.
Moderne Entwicklungen, Bedrohung und Schutz
Den europäischen Kolonisten war der Gabelbock lange Zeit unbekannt, bis die Art von Lewis und Clark auf ihrer Expedition (1804–1806) beschrieben wurde. In jener Zeit waren die Grasländer des nordamerikanischen Westens überreich an Großwild wie Bisons und Gabelböcken.
Nach der großflächigen Besiedlung Nordamerikas durch weiße Siedler glich das Schicksal des Gabelbocks dem des Amerikanischen Bison. Sie wurden zunächst wegen ihrer Felle und ihres Fleisches geschossen, später nur noch zum Sport bzw. aus Vergnügen. Aus den fahrenden Zügen entlang der Eisenbahnstrecken schossen Reisende Tausende von Gabelböcken ab, deren Kadaver zu beiden Seiten der Bahnlinien verwesten. Bis 1920 war die Bestandszahl durch unkontrollierte Jagd auf nur noch 20.000 Tiere gesunken. Erst danach wurden Schutzmaßnahmen erlassen, weshalb es heute wieder eine Million Gabelböcke in den USA und in Kanada gibt, so dass die Art als Ganzes nicht als gefährdet gilt.
In Mexiko hat sich der Bestand dagegen nie erholen können. Dort gibt es auch heute nur wenig mehr als 1000 Tiere. Folgerichtig listet die internationale Organisation zur Koordinierung des Naturschutzes (IUCN) die beiden mexikanischen Unterarten als bedroht. Dies sind der Sonora-Gabelbock (A. a. sonoriensis) und der Baja-California-Gabelbock (A. a. peninsularis). Letzterer ist nur auf der Halbinsel Baja California beheimatet und wird als stark bedroht geführt.
Gabelböcke sind für einige bedeutende Infektionskrankheiten der Paarhufer empfänglich. So bilden sie ein Erregerreservoir für das bösartige Katarrhalfieber, BVD/MD und die Epizootic Hemorrhagic Disease (EHD). Daneben besteht eine hohe Empfindlichkeit für Milzbrand, Tollwut und diverse Parasitosen.
Gabelböcke im Zoo
Als Beitrag zur Bestandssicherung werden Gabelböcke auch als Zootiere gehalten. Ihre Schreckhaftigkeit und ihre Neigung zur Panik im Umgang mit Menschen stellt hier ein besonderes tierpflegerisches Problem dar. Bei Unterschreitung der Fluchtdistanz reagieren die Tiere nicht selten mit einem kompromisslosen Angriff, der infolge der wirkungsvoll eingesetzten Hörner durchaus gefährlich werden kann. Jegliche Anwendung von Zwangsmaßnahmen kann zu Selbsttraumatisierung oder Stressmyopathie führen. Körperliche Untersuchungen können daher nur unter Sedation oder Narkose erfolgen. Eine wirkungsvolle Narkose ist dabei nur durch hochpotente Betäubungsmittel vom Morphintyp erreichbar. Gabelböcke lassen sich im Zoo nur schwer mit anderen Huftierarten vergesellschaften, schon das Eingliedern handaufgezogener, männlicher Tiere kann aufgrund ihrer Aggressivität zu Konflikten führen. Auch das natürliche Sprung- und Schwimmvermögen der Gabelböcke muss bei der Einrichtung des Geheges berücksichtigt werden. Anders als in freier Wildbahn beträgt die Lebenserwartung der Tiere in Gefangenschaft bis zu 17 Jahre.
Literatur
- Heinrich Weidinger: Pronghorn, die nordamerikanische Antilope. Weidinger, Fürth, 1995, ISBN 3-00-005546-0
- John A. Byers: Built for Speed. A Year in the Life of Pronghorn. Harvard University Press, Cambridge Mass, 2003, ISBN 0-674-01142-2
- Gary Turbak: Pronghorn. Portrait of the American Antelope. Northland Publishing, Flagstaff (Arizona), 1995, ISBN 0-87358-595-X
- Valerius Geist; Michael H. Francis (Fotograf): Antelope Country: Pronghorns – The Last Americans, Krause Publications 2001, ISBN 978-0-87349-279-9
Weblinks
- National Wildlife Federation (engl.)
- North American Pronghorn Foundation (Organisation zum Schutz und zur Erforschung des Gabelbocks, engl.)
- U.S. Fish & Wildlife Service PDF (engl.)
- Antilocapra americana in der Roten Liste gefährdeter Arten der IUCN 2006. Eingestellt von: Antelope Specialist Group, 1996. Abgerufen am 12. Mai 2006.
Einzelnachweise
- Bart W. O'Gara: Antilocapra americana. Mammalian Species 90, 1978, S. 1–7
- J. A. Byers: Antilocapridae. In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 780–787
- Edward Byrd Davis: Family Antilocapridae. In: Donald R. Prothero und Scott E. Foss (Hrsg.): The Evolution of Artiodactyls. Johns Hopkins University, Baltimore, 2007, S. 227–240
- Bart W. O'Gara Und Gary Matson: Growth and Casting of Horns by Pronghorns and Exfoliation of Horns by Bovids. Journal of Mammalogy 56 (4), 1975, S. 829–846
- Hall Sawyer, Fred Lindzey und Doug McWhirter: Mule Deer and Pronghorn Migration in Western Wyoming. Wildlife Society Bulletin 33 (4), 2005, S. 1266–1273 ISSN 0091-7648
- Joel Berger, Steven L. Cain,K im Murray Berger: Connecting the dots: an invariant migration corridor links the Holocene to the present. In: Biology Letters, 2006 2, Seiten 528–531. doi:10.1098/rsbl.2006.0508
- John Byers: American Pronghorn: Social Adaptations and the Ghosts of Predators Past. Chicago University Press, 1998, S. 1–300 (S. 10–14) ISBN 978-0226086996 ()
- Milton Hildebrand und George E. Goslow: Vergleichende und funktionelle Anatomie der Wirbeltiere. Springer-Verlag, Berlin Heidelberg 2004, S. 623.
- James R. Heffelfinger, Bart W. O'Gara, Christine M. Janis und Randall Babb: A bestiary of ancestral Antilocaprids. Proceedings of the 20th Biennial Pronghorn Workshop 20, 2004, S. 87–111
- Juan P. Zurano, Felipe M. Magalhães, Ana E. Asato, Gabriel Silva, Claudio J. Bidau, Daniel O. Mesquita und Gabriel C. Costa: Cetartiodactyla: Updating a time-calibrated molecular phylogeny. Molecular Phylogenetics and Evolution 133, 2019, S. 256–262
- Don E. Wilson & DeeAnn M. Reeder (Hrsg.): Antilocapra americana. in Mammal Species of the World. A Taxonomic and Geographic Reference (3rd ed).
- M. V. Kuznetsova, M. V. Kholodova, A. A. Danilkin: Molecular Phylogeny of Deer (Cervidae: Artiodactyla). Russian Journal of Genetics 41 (7), 2005; S. 742–749.
- Manuel Hernández Fernández und Elisabeth S. Vrba: A complete estimate of the phylogenetic relationships in Ruminantia: a dated species-level supertree of the extant ruminants. Biological Reviews 80, 2005, S. 269–302
- Halina Cernohorska, Svatava Kubickova, Olga Kopecna, Anastasia I. Kulemzina, Polina L. Perelman, Frederick F. B. Elder, Terence J. Robinson, Alexander S. Graphodatsky, Jiri Rubes: Molecular cytogenetic insights to the phylogenetic affinities of the giraffe (Giraffa camelopardalis) and pronghorn (Antilocapra americana). Chromosome Research 21, 2013; S. 447–460 doi:10.1007/s10577-013-9361-0
- Gina M. Semprebon und Florent Rivals: Was grass more prevalent in the pronghorn past? An assessment of the dietary adaptations of Miocene to Recent Antilocapridae (Mammalia: Artiodactyla). Palaeogeography, Palaeoclimatology, Palaeoecology 253, 2007, S. 332–347
- Gary D. Richards und Monte L. McCrossin: A new species of Antilocapra from the Late Quaternary of California. Geobios 24 (5), 1991, S. 623–635
- Bastien Mennecart, Grégoire Métais, Loïc Costeur, Léonard Ginsburg und Gertrud E. Rössner: Reassessment of the enigmatic ruminant Miocene genus Amphimoschus Bourgeois, 1873 (Mammalia, Artiodactyla, Pecora). PLoS ONE 16 (1), 2021, S. e0244661, doi:10.1371/journal.pone.0244661
- E. Jiménez-Hidalgo, O. Carranza-Castañeda und M. Montellano-Ballesteros: A Pliocene record of Capromeryx (Mammalia: Antilocapridae) in México. Journal of Paleontology 78 (6), 2004, S. 1179–1186
- S. David Webb: Pliocene Pronghorns of Florida. Journal of Mammalogy 54 (1), 1973, S. 203–221
- Donald R. Prothero, Valerie J. P. Syverson, Richard Hulbert Jr., Erin E de Anda und Daniella Balassa: Allometric trends in growth and dwarfing in the dwarf pronghorn Capromeryx: Does dwarfing follow the same trends as growth? New Mexico Museum of Natural History and Science Bulletin 82, 2021, S. 335–339
- Richard S. White Jr. und Gary S. Morgan: Rancholabrean Tramperos Creek Fauna, Union County, New Mexico, with a review of the occurence and paleobiology of Capromeryx in the Rancholabrean of New Mexico. New Mexico Museum of Natural History and Science, Bulletin 53, 2011, S. 641–651
- Victor M. Bravo-Cuevas, Eduardo Jiménez-Hidalgo, Miguel A. Cabral-Perdomo und Jaime Priego-Vargas: Taxonomy and paleobiological notes of the late Pleistocene (Rancholabrean) antilocaprids (Mammalia, Artiodactyla, Antilocapridae) from the state of Hidalgo, central Mexico. Revista Mexicana de Ciencias Geológicas 30 (3), 2013, S. 601–613
- Florent Rivals und Gina M. Semprebon: A comparison of the dietary habits of a large sample of the Pleistocene pronghorn Stockoceros onusrosagris from the Papago Springs Cave in Arizona tot he modern Antilocapra americana. Journal of Vertebrate Paleontology 26 (2), 2006, S. 495–500
- Morris F. Skinner: The fauna of Papago Springs Cave, Arizona and a study of Stockoceros with three new antilocaprines from Nebraska and Arizona. Bulletin of the American Museum of Natural History 80, 1942, S. 143–220