Schwarzfersenantilope
Die Schwarzfersenantilope oder Impala (Aepyceros melampus) ist eine Art aus der Gattung der Impalas innerhalb der Familie der Hornträger. Sie kommt im östlichen und südlichen Afrika vor, wo sie vorwiegend offene Savannenlandschaften und Buschgebiete bewohnt. Es handelt sich um eine mittelgroße Antilope. Besondere Kennzeichen finden sich in dem grazilen Körperbau mit schlanken Gliedmaßen und geradem Rückenverlauf sowie in der schwarzen Fellzeichnung an den Hinterfüßen, letzteres Kennzeichen begründet den deutschen Trivialnamen. Hörner werden außerdem nur von männlichen Individuen getragen. Die Tiere leben in einem komplexen Sozialsystem. Weibchen formen gemeinsam mit ihrem Nachwuchs Herden, deren Größe regional variiert. Männliche Tiere leben in Junggesellengruppen oder vermischen sich teilweise mit den Herden. Dominante Männchen zeigen vor allem während der Fortpflanzungsphase territoriales Verhalten und begründen eigene Reviere. Sie kämpfen dann um das Paarungsvorrecht. In der Regel bringt ein Weibchen ein Junges zur Welt, die Geburten sind innerhalb einer Gruppe und Region zum Teil synchronisiert. Die Aufzucht erfolgt in der Herde, allerdings versteckt das Muttertier anfangs das Neugeborene phasenweise vor der Gruppe. Die Nahrung besteht aus härteren Gräsern und weicheren Blättern und Zweigen. Die jeweilige Zusammensetzung richtet sich nach der jahreszeitlichen Verfügbarkeit. Die Art wurde im Jahr 1812 wissenschaftlich eingeführt. Sie galt mitunter als einziger Vertreter ihrer Gattung, wogegen jedoch genetische Untersuchungen sprechen. Fossil trat sie möglicherweise schon im Altpleistozän auf. Der Bestand wird momentan als nicht gefährdet eingestuft.
| Schwarzfersenantilope | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
.jpg.webp)
Männliche Schwarzfersenantilope | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Aepyceros melampus | ||||||||||||
| (Lichtenstein, 1812) |
Merkmale
Habitus

Die Schwarzfersenantilope gehört zu den mittelgroßen Antilopen. Ermittelt anhand von Individuen aus dem Sambesi-Gebiet beträgt die Kopf-Rumpf-Länge 117 bis 151 cm, zuzüglich eines 21 bis 34 cm langen Schwanzes. Das Gewicht liegt bei 23 bis 62 kg. Für Tiere aus der Serengeti wird eine Schulterhöhe von 79 bis 93 cm angegeben bei einem nahezu identischen Körpergewicht. Der Sexualdimorphismus ist deutlich ausgeprägt mit größeren männlichen im Vergleich zu weiblichen Tieren. Charakteristisch sind der generell schlanke Körperbau mit gerader Rückenlinie, die langen, schlanken Beine und der gestreckte Kopf. Das Körperfell besitzt am Rücken, Nacken und an den oberen Seiten eine rotbraune Färbung mit teils auffälligem Glanz. Die unteren Seiten und die Beinaußenseiten sind heller gefärbt. Der Bauch und die Beininnenseiten erscheinen dagegen weißlich. Die Haare liegen dicht am Körper an und werden auf dem Rücken durchschnittlich 1,2 cm, am Bauch 1,5 cm lang. Ihre Basen sind weißlich, der breitere oberer Teil ist rötlichbraun gefärbt. Der Kopf zeigt sich ebenfalls rötlichbraun, jedoch treten oberhalb der Augen, am Maul und an der Kehle weißliche Flecken auf. Die Ohren erreichen eine Länge von 13 bis 16 cm, die Innenseiten heben sich durch ihre weißliche Färbung von den schwarzen Spitzen ab. Abweichend von der nahe verwandten Schwarznasenimpala (Aepyceros petersi) fehlt der Schwarzfersenantilope weitgehend die auffallende schwarze Gesichtszeichnung. Auf beiden Seiten des Gesäßes zieht sich jeweils ein schwarzer Streifen entlang, der sich teilweise auf dem Oberschenkel fortsetzt. Zusätzliche dunklere Flecken finden sich an den Beininnenseiten. Ein auffallendes und namensgebendes Merkmal bilden die dunklen Haarbüschel an den Fersen, die eine Drüse, die sogenannte Metatarsaldrüse, bedecken. Die Einzelhaare werden hier bis zu 2,5 cm lang. Die schwarzen Hufe sind bei ausgewachsenen Tieren 4,0 bis 5,2 cm lang und setzen sich manchmal durch ein schmales helleres Band ab. Die Schwanzspitze ist schwarz, die dunkle Färbung zieht sich über die Rückseite des Schwanzes bis zur Wurzel. Die Unterseite bildet mit ihren weißlichen, mitunter 5 bis 10 cm langen Haaren einen deutlichen Kontrast dazu.[1][2][3] Gelegentlich treten Individuen mit schwarzer Rückenfärbung auf. Diese Farbvariante wird durch eine Mutation des ASIP-Gens hervorgerufen, welches die Färbung des Fellkleids bei einigen Säugetieren codiert.[4]
Hörner kommen nur bei männlichen Individuen vor. Sie sind stark geriffelt, lediglich die Spitzen zeigen sie sich auf rund 10 cm Länge glatt. Sie steigen am Kopf steil auf, schwingen dann seit- sowie rückwärts und sind an den Spitzen wieder aufwärts gerichtet, so dass die Form insgesamt an eine Leier erinnert. Je nach Population können die Spitzen nach außen oder innen gerichtet sein oder parallel stehen. Die Länge variiert von 37 bis 86 cm Länge, das längste bekannte Horn maß knapp 92 cm und stammt von einem Tier aus der Masai Mara in Kenia. Weibliche Tiere besitzen zwei Paar Zitzen in der Leistengegend.[1][2][3]
Schädel- und Gebissmerkmale
Der Schädel ist durchschnittlich 26 cm lang und an den Hornansätzen 8,9 cm breit.[5] Auffallend sind das Fehlen der Voraugengrube (Fossa praeorbitalis) und das Auftreten einer Lücke zwischen dem Mittelkieferknochen und dem Oberkiefer. Letzteres ist ebenfalls bei den Böckchen (Nesotragus) belegt und entstand wohl durch die Streckung des Gesichtsschädels. Im Stirnbein treten große Hohlkammern auf. Die Zahnformel lautet: , das Gebiss setzt sich demzufolge aus 32 Zähnen zusammen. Die jeweils äußeren beiden unteren Schneidezähne und der Eckzahn sind jeweils nadel- bis stiftartig geformt und bilden so einen Zahnkamm. Die Backenzähne sind generell hochkronig (hypsodont).[6][1][2][3]
Verbreitung und Lebensraum
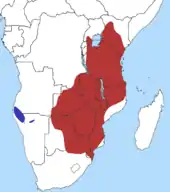
Die Schwarzfersenantilope ist im östlichen und südlichen Afrika verbreitet. Ihr Vorkommen reicht im Norden vom zentralen Kenia und dem südwestlichen Uganda südlich bis nach Mosambik und in das nördliche Südafrika sowie westlich bis in das nordöstliche Namibia und das südöstliche Angola. Hier im südwestlichen Bereich des natürlichen Auftretens der Schwarzfersenantilope trennt der über 300 km breite Streifen des Ovambolands die Antilopenart von ihrer Schwesterform, der Schwarznasenimpala.[7][1][3] In einzelnen Regionen wie in Burundi wurden die lokalen Bestände der Schwarzfersenantilope ausgerottet, über den Status der Population im äußersten Südosten der Demokratischen Republik Kongo liegen keine Informationen vor. Die Tiere bewohnen Savannenlandschaften durchsetzt mit leichtem Baumbestand sowie lichte Waldgebiete, die jeweils Zugang zu Wasserquellen bieten. Häufig bevorzugen sie Habitate mit Akazienbeständen auf nährstoffreichem Boden, die qualitativ hochwertige Gräser und vor allem in der Trockenzeit auch weiche Pflanzennahrung zur Verfügung stellen. Im südlichen Afrika tritt die Schwarzfersenantilope auch in Regionen mit Mopane-Pflanzengesellschaften auf. Nachweise liegen, wenn auch seltener, zudem aus Gebieten mit Langfäden und Myrobalanen sowie mit Baikiaea vor. Häufig nutzt sie kurzgrasige Landschaften in Gewässernähe, teilweise auch Brandrodungsflächen mit frischem Grasbewuchs oder Übergangsregionen zwischen offenen Savannen und Waldsavannen. Da die Schwarzfersenantilope weniger gut an trockenheiße Klimate angepasst ist, sind schattige Baumkronen und vor allem von Gewässern Voraussetzung für die Anwesenheit der Tiere, vollständig offene Gebiete meiden die Tiere weitgehend. In der Regel halten sie sich nicht weiter als zwei bis fünf Kilometer zur nächsten Süßwasserquelle auf. Wüstenartige Regionen kann die Schwarzfersenantilope nur bei permanent zugänglichen Wasserquellen bewohnen. In Gebirgslandschaften ist die Art weitgehend abwesend. Am Kilimandscharo beträgt die maximale Höhenverbreitung rund 1700 m über den Meeresspiegel in KwaZulu-Natal rund 1400 m. Die Populationsdichte variiert beträchtlich und reicht von einem Individuum je Quadratkilometer im Mkomazi-Nationalpark in Tansania über 7 im Kruger-Nationalpark in Südafrika und 53 im Lake-Mburo-Nationalpark in Uganda bis zu 214 Tieren auf einer vergleichbar großen Fläche im Akagera-Nationalpark in Ruanda. Die Daten für letzteren beziehen sich auf die 1970er Jahre, in den 1990er Jahren kam es hier zu einem dramatischen Einbruch der Bestandszahlen um rund 75 bis 80 %.[8][1][2][3]
Lebensweise
Territorialverhalten

Die Schwarzfersenantilope lebt in einem komplexen Sozialsystem. Weibliche Tiere und deren Nachwuchs formen Herden, die je nach Landschaft und Jahreszeit unterschiedlich groß sind. Im Hwange-Nationalpark in Simbabwe bestehen die Herden aus 4 bis 150 Individuen, die durchschnittliche Gruppengröße in offenen Savannenlandschaften beträgt hier zwischen 12,2 und 15,4 Tieren, in mehr geschlossenen Buschregionen verringert sie sich auf etwa 7,3. Die größten Herden treten während der Regenzeit und im Übergang zur Trockenzeit im Januar auf, wenn durchschnittlich 23,4 Individuen eine Gruppe formen. In der Trockenzeit im November setzt sich eine Gruppe aus durchschnittlich weniger als 10 Tieren zusammen. Generell ist die Bindung in den Herden relativ groß, eine erkennbare Rangordnung besteht nicht. Männliche Tiere können als territoriale Einzelgänger, in Junggesellengruppen oder innerhalb der Herden auftreten. Die Junggesellengruppe bestehen aus Individuen unterschiedlichen Alters (junge Tiere und ausgewachsene Alttiere) mit altersbezogener Hierarchie. Allerdings ist die Bindung zwischen den einzelnen Mitgliedern hier weniger stark ausgeprägt als bei den Herden. Dies betrifft hauptsächlich die Fortpflanzungsphase, wenn einzelne Individuen territorial und aggressiv werden. Nach der Paarungszeit vermischen sich Junggesellengruppen teilweise mit den Herden. Über das Jahr gesehen kommt es somit häufig zu einem Wechsel innerhalb der Herdenstruktur, so dass sich die Gruppengröße mitunter täglich ändert. Auch wandern vereinzelt Tiere zu benachbarten Herden ab oder stoßen von diesen hinzu.[9][10][1][2][3]
Ausgesprochene Territorialität herrscht unter Männchen während der Fortpflanzungsphase vor. Dominante Individuen verlassen dann die Junggesellengruppen und etablieren Reviere. Häufig werden die Territorien in Gebieten mit qualitativ hochwertiger Nahrung angelegt, während Wasserstellen zumeist neutrales Gelände darstellen. Ihre Grenzen sind weitgehend stabil. Sie werden mit Sekreten aus den Drüsen am Vorderkopf durch Reiben an der Vegetation markiert. Urin- und Kotmarken spielen dem gegenüber nur eine untergeordnete Rolle. Ein Revieranspruch wird außerdem durch ein lautes und sehr auffälliges Röhren ausgedrückt, das bis zu 2 km weit hörbar erschallt, wodurch die Schwarzfersenantilope zu den lautesten Antilopen der afrikanischen Savannen gehört. Es besteht aus einer Serie von Schnaub- und Blöklauten in kurzen Wiederholungen. Währenddessen halten die Tiere den Schwanz erhoben und stehen oder laufen beziehungsweise galoppieren herum.[11] Die Anzahl territorialer Tiere ist zu Beginn der Fortpflanzungsphase höher als zum Ende hin. Mit verantwortlich dafür ist eine zunehmend schlechtere Kondition unter den Männchen im Verlauf der Paarungszeit infolge einer geringeren Nahrungsaufnahme.[12] Dies führt auch dazu, dass die einzelnen Territorien anfänglich kleiner sind. Allerdings ist die Größe der Reviere zusätzlich abhängig von der Populationsdichte einer Region. So nehmen sie in der Sengwa-Region in Simbabwe mit seiner hohen Anzahl an Schwarzfersenantilopen 8,5 bis 11 ha ein, in der weniger dicht besiedelten Serengeti in Tansania hingegen rund 17 ha. Im Vergleich dazu beanspruchen territoriale Männchen in Limpopo ein Areal von etwa 21 ha. Die Territorien werden hier zwischen 7 und 99 Tage gehalten.[9][13][1][2][3]
Nichtterritoriale Männchen und Junggesellengruppen wiederum bewegen sich in Aktionsräumen, die entsprechend im Sengwa-Gebiet zwischen 40 und 90 ha groß sind, in Limpopo zwischen 34 und 59 ha. Auffallend ist hier, dass die Ausdehnung mit zunehmenden Individualalter der Tiere abnimmt. Dies hängt wahrscheinlich mit der initialen Trennung jungerwachsener Tiere von der mütterlichen Herde zusammen, während ältere Individuen ein eher stabiles Schweifgebiet etabliert haben oder territoriale Eigenschaften zeigen.[14] Deutlich größer sind noch einmal die Aktionsräume der Herden. Sie erstrecken sich in der Sengwa-Region über 80 bis 180 ha, für die Serengeti werden Werte von durchschnittlich 297 ha angegeben. Durch ihre große Ausdehnung überlappen sie sich mit mehreren Revieren territorialer Männchen. Letztere erheben dann Anspruch auf die Paarung beim Durchzug einer Herde durch ein entsprechend besetztes Territorium. Die Schweifgebiete der Herden zeigen im Randbereich ebenfalls geringe Überschneidungen zueinander.[9][14][13][1][2][3]
.jpg.webp)
Die Schwarzfersenantilope ist weitgehend tagaktiv, teilweise kommen aber auch nächtliche Aktivitäten etwa in Bereichen stärkerer menschlicher Beeinflussungen vor.[15] Ein Großteil der aktiven Zeit verbringen die Tiere fressend oder wandernd. Nach Untersuchungen in südöstlichen Afrika verwenden die Tiere rund 30 % ihrer aktiven Zeit mit der Nahrungsaufnahme, wobei es keine Unterschiede zwischen Männchen und Weibchen oder den Jahreszeiten gibt. Dagegen investieren Männchen rund 20 % in wachsames Herumstreunen, Weibchen hingegen nur rund 10 %. Wanderungsbewegungen zu den verschiedenen Nahrungsquellen beanspruchen etwa 8 bis 9 % der aktiven Zeit bei beiden Geschlechtern. Nachts ruhen die Tiere liegend, vor allem in offenen Landschaften. Weitere Aktivitäten bestehen im Wiederkäuen oder in der Fellpflege. Vor allem bei den Ruhe- und Wiederkäuphasen ließen sich ebenfalls weniger geschlechtsspezifische oder saisonal bedingte Unterschiede feststellen. Beides nimmt zwischen 8 und 11 % der Zeit in Anspruch.[16] Bezüglich der Fellpflege stellt das gegenseitige Putzen (allo-grooming) eine Besonderheit dar, da es sowohl bei weiblichen als auch männlichen ausgewachsenen Tieren vorkommt. Dies erfolgt in jeweils einer wechselnden Abfolge von sechs bis zwölf Bissen. Zum Einsatz kommt dabei der speziell geformte Zahnkamm bestehend aus den unteren Schneide- und Eckzähnen. Höchstwahrscheinlich werden bei der gegenseitigen Pflege Parasiten von Körperstellen entfernt, an die ein Individuum selbst nicht herankommt. Das Verhalten ist bemerkenswert, da dies bei den männlichen Tieren unter nichtverwandten Artgenossen stattfindet, was von andere Huftieren nicht bekannt ist. Auffälliger Weise erhalten dabei dominante Individuen nicht mehr Aufmerksamkeit als untergeordnete. Generell beschäftigen sich Männchen aber weniger mit der Fellpflege als Weibchen, erstere verwenden rund elf Minuten eines Zwölf-Stunden-Tages, letztere rund 40 Minuten. Der geringere Zeitaufwand bei den männlichen Individuen ist wohl der stärkeren Konkurrenz untereinander und dem größeren Engagement in die Fortpflanzung verschuldet. Dadurch weisen Männchen auch häufig einen größeren Befall mit Parasiten auf.[17][18][1][2][3]
Ernährung
.jpg.webp)
Die Schwarzfersenantilope ernährt sich herbivor sowohl von harten als auch weichen Pflanzen (mixed feeder). Sie bevorzugt dadurch Gräser, Blätter, Zweige, Früchte und Blüten. Im Jahresdurchschnitt setzt sich die Nahrung zu je 45 % aus Gräsern beziehungsweise Blättern/Zweigen und zu 10 % aus Früchten zusammen. Der jeweilige genaue Anteil der einzelnen Bestandteile variiert aber weitgehend mit der Jahreszeit. Nach Untersuchungen im südlichen Afrika fressen die Tiere frische Gräser vor allem in der Regenzeit, so dass ihr Anteil auf rund 75 % ansteigt. Während der Trockenzeit fällt er auf bis zu 10 % ab und es dominieren weiche Pflanzen in der Nahrung.[19][20] Ähnliches erbrachten Beobachtungen in der Serengeti im östlichen Afrika. Dahingegen führten Isotopenanalysen an Tieren aus dem Akagera-Nationalpark in Ruanda zu dem Ergebnis, dass diese sich sowohl in der Regen- als auch in der Trockenzeit überwiegend von Gräsern ernähren mit einem durchschnittlichen Anteil von gut 86 %. Die Variationsbreiten über das Jahr lagen bei lediglich rund 10 %.[21][1][2][3]
Der gebietsweise Wechsel von vorwiegend weicher zu harter Pflanzennahrung kann laut Felduntersuchungen im Lake-Mburo-Nationalpark in Uganda bereits vor Ende der Trockenzeit stattfinden, bevorzugt an Wasserstellen oder auf frischen Brandflächen wo besonders zeitig frische Gräser sprießen.[22] Die Zusammensetzung der Nahrung wird aber nicht nur durch die Jahreszeiten geprägt, sondern auch durch das Geschlecht und den sozialen Status. Dadurch das dominante Männchen häufig Gebiete mit nährstoffreichen Gräsern besetzen und Zeit sowie energetische Kosten in die Verteidigung der Territorien investieren, vernachlässigen sie die Suche nach qualitativ hochwertigen, aber weiter gestreuten weichen Pflanzen. Dies resultiert in einem höheren Anteil an harter Pflanzennahrung bei territorialen männlichen Tieren (knapp 70 %) gegenüber weiblichen oder Junggesellen (jeweils etwas über 50 %).[23] Darüber hinaus ergeben sich auch lokal Unterschiede, wie etwa bei Felduntersuchungen im Kruger-Nationalpark aufgezeigt wurde. Im nördlichen Teil des Schutzgebietes fressen die Schwarzfersenantilopen weniger Gras als im südlichen. Die Anteile schwanken in ersterer Region zwischen 41 und 44 %, in letzterer zwischen 63 und 82 %. Die differierenden Nahrungszusammensetzungen sind mit dem geringeren Anteil an Grasvegetation in den Mopane-Gebieten des nördlichen Kruger-Nationalparks im Vergleich zu den von Marula-Bäumen und Senegalia-Büschen durchsetzten südlichen erklärbar.[24][1][2][3]
Zu den bevorzugten Grasarten im Nahrungsspektrum der Schwarzfersenantilope gehören unter anderem Hundszahngräser, Fingerhirsen und Rispenhirsen sowie Vertreter der Gattungen Themeda und Sporobolus. Unter den Baum- und Gebüschpflanzen, an denen die Tiere besonders häufig fressen, dominieren Akazien, gefolgt von Langfäden, dem Farbkätzchenstrauch, Sternbüschen und Hirtenbäumen. Allein im Nylsvley-Naturreservat im Transvaal setzt sich die Nahrung aus rund zwei Dutzend Gras- und knapp vier Dutzend weicheren Pflanzenarten zusammen.[19] Die täglich aufgenommene Menge beträgt rund 1 bis 1,1 kg.[20] Sofern möglich trinkt die Schwarzfersenantilope täglich. Die Tiere können aber auch eine gewisse Zeit ohne Flüssigkeitsaufnahme auskommen.[11][1][2][3]
Fortpflanzung

Die Dauer der Paarungszeit hängt weitgehend von den klimatischen Bedingungen ab. Sie kann im östlichen Afrika mit seinem stärker ausgeglichenen tropischen Klima fast ganzjährig erfolgen. Ein Höhepunkt findet sich zum Ende der Regenzeit von Januar bis Februar. Im südlichen Afrika ist sie stärker eingeschränkt, da die Brunft der Weibchen unter anderem durch die variierende Tageslänge beeinflusst wird. Hauptsächlich verpaaren sich die Tiere hier in der Trockenzeit zwischen April und Juni. Weibchen können prinzipiell zweimal jährlich in die Brunft kommen, doch ist zumeist die erste mit einer erfolgreichen Befruchtung verbunden. Während der Brunft sind dominante Männchen aggressiv und sensitiv gegenüber anderen Geschlechtsgenossen und ihren Bewegungen oder Gebaren. Sie laufen häufig herum und präsentieren ihren verdickten Nacken und ihre gut entwickelten Hörner. Verbunden ist dies teilweise mit zurückgefalteten Ohren, einem erhobenen Schwanz und niedriger oder hoher Kopfhaltung. Letzteres drückt dominantes oder unterwürfiges Verhalten aus. Auseinandersetzungen zwischen zwei dominanten Individuen werden durch Schiebewettstreite mit den Hörnern ausgetragen. Das markante Röhren der Männchen nimmt an Intensität zu, je weiter die Brunft fortgeschritten ist. Männliche Tiere folgen brünftigen weiblichen, schnüffeln an ihren Geschlechtsorganen und drücken ein Flehmen aus. Während dieser Partnerwerbung röhren die Männchen nicht. Der Abstand zwischen den beiden Geschlechtern schrumpft dabei kontinuierlich. Der Paarungsakt beginnt mit dem Aufsitzen des Männchens auf dem Weibchen, was meist nur rund zehn Sekunden dauert, aber mehrfach wiederholt wird. Nach erfolgter Begattung verliert das Männchen sehr schnell Interesse am Weibchen.[11][1][2][3]
_(16441921332).jpg.webp)
Das Weibchen bringt nach einer Tragzeit von 195 bis 215 Tagen (27 bis 28 Wochen) meist ein, selten auch zwei Junge abseits der Herde in hohem Gras oder im Gebüsch zur Welt. Der überwiegende Teil der Geburten grenzt sich auf ein sehr kurzes Zeitfenster zu Beginn der Regenzeit (im südlichen Afrika vom November bis Januar) ein. Im Chobe-Nationalpark in Botswana gebären die Weibchen ihren Nachwuchs innerhalb eines Zeitraums von nur zwei Wochen, so dass die Geburten hier stark synchronisiert sind. Möglicherweise ist dies eine Reaktion auf die starke Saisonalisierung des Klimas der Region und damit eine nur kurze Verfügbarkeit qualitativ hochwertiger Nahrung.[25] Das Geschlechtsverhältnis ist bei der Geburt ausgeglichen, verschiebt sich aber im Laufe der Zeit zugunsten der weiblichen Tiere. Bei der Geburt wiegt ein Junges rund 3,5 bis 5 kg. Das Jungtier bleibt zuerst im Gras versteckt. In einem Alter von rund zwei Tagen wird es von der Mutter tagsüber zur Herde geführt, die Nacht verbringt es aber weiterhin abseits der ausgewachsenen Herdenmitglieder im hohen Gras verborgen. Häufig verstecken mehrere Muttertiere ihre Jungen im gleichen Bereich. Erst nach rund einer Woche wird der Nachwuchs nicht mehr von der Herde isoliert. Das Verhalten vermittelt zwischen Antilopenarten, die ihren Nachwuchs weitgehend vollständig absondern, und solchen, die ihn direkt in die Herde einbinden. Das Jungtier wächst relativ schnell. Nach rund sechs Monaten wiegt es unabhängig vom Geschlecht etwa 24 bis 25 kg. Zwischen der 17. und 25. Lebenswoche kommt es zur Entwöhnung. In der Zeit darauf zeichnet sich ein kleiner Gewichtseinbruch ab, was eventuell mit der Ernährungsumstellung in dieser Phase in Verbindung steht. Danach folgt bis zum zwölften Lebensmonat ein weiterer starker Anstieg der Wachstumskurve. Junge männliche Tiere wiegen dann gut 32 kg, weibliche 27 kg. In der Folgezeit fällt das Wachstum dann deutlich geringer aus.[26] Während des Aufenthalts in der Herde bilden Junge häufig Gemeinschaften, sogenannten „Kindergartengruppen“, die typisch für Impalas sind. Innerhalb dieser tragen sie Spiele in Form von Galoppwettstreiten oder Ringkämpfen mit den Hörnern aus.[11] Die Bindung zum Muttertier lässt gleichzeitig nach. Im Alter von 18 Monaten sind die jungen Weibchen geschlechtsreif. Bei den Männchen erfolgt dies etwa im gleichen Zeitraum, doch können sie sich erst beim Erreichen der vollständigen Körpergröße und der Ausprägung territorialen Verhaltens gegenüber Geschlechtsgenossen durchsetzen und somit fortpflanzen, was etwa im Alter von rund vier Jahren abgeschlossen ist. In der Regel verbleibt der weibliche Nachwuchs in der mütterlichen Herde, der männliche wird im Alter von rund einem Jahr vertrieben. Die Lebenserwartung in freier Wildbahn liegt bei 13 bis 14 Jahren für weibliche und rund 10 Jahren für männliche Tiere. Weibliche Individuen sind bis ins hohe Alter fruchtbar. In der Regel bringt es jährlich ein Junges zur Welt, die Fortpflanzungsrate liegt somit über die Lebensspanne eines Weibchens gesehen bei rund 95 %. In Gefangenschaft wurden einzelne Tiere bis zu 25 Jahre alt.[1][2][3]
Fressfeinde, Kommensalen und Parasiten

Zahlreiche Fressfeinde stellen der Schwarzfersenantilope nach. Die bedeutendsten sind Leoparden, Geparden, Löwen, Afrikanische Wildhunde und Tüpfelhyänen, selten auch Schabrackenschakale.[27] Im südlichen Afrika hat der Leopard den größten Anteil an der Mortalitätsrate der Schwarzfersenantilope. Je nach Region können zwischen 21 und 51 % der durch Beutegreifer erlegten Tiere auf die Großkatze entfallen, im Kruger-Nationalpark liegt der Anteil bei 34 %. Der Afrikanische Wildhund wiederum ist für 10 bis 22 % der getöteten Schwarzfersenantilopen verantwortlich, Angaben für den Kruger-Nationalpark belaufen sich auf das untere Limit. Der Löwe, die Tüpfelhyäne und der Gepard haben mit jeweils 5 bis 8 % dagegen einen eher geringen Einfluss auf die lokalen Populationen. Für den Löwen ist anzunehmen, dass dieser als besonders großes Raubtier eher auf große Beute im Bereich von 190 bis 550 kg spezialisiert ist.[28][29][30][31] Andere Beutegreifer wie Adler stellen teilweise auch Jungtieren nach, so der Kampfadler, für den die Schwarzfersenantilope nach verschiedenen Untersuchungen im südlichen und östlichen Afrika zur Hauptnahrungsquelle unter den Säugetieren gehört. Im Masai Mara fallen die Antilopen weiblichen Greifvögeln deutlich häufiger zum Opfer als männlichen, der Gesamtanteil liegt bei 13,6 %. Im südlichen Afrika stellt die Schwarzfersenantilope rund 4 % der erlegten Beute.[32][33] Die Gefahr, einem Prädatoren zum Opfer zu fallen, ist für die Schwarzfersenantilope in waldreicheren Landschaften größer als in der offenen Savanne. In der Regel reagiert ein Individuum auf einen weiter entfernten Beutegreifer mit Schnauben und entfernt sich langsam. Bei sehr nahen Fressfeinden rennt es davon und überwindet in weiten Sprüngen bis zu 12 m. Dabei vollführt die Schwarzfersenantilope charakteristische Kicks mit den Hinterbeinen, die teilweise ins Leere verlaufen, wodurch die Vorderbeine zweimal den Boden berühren, bevor die Hinterbeine nachfolgen. Herden mit Jungtieren versuchen durch erhöhte Aufmerksamkeit einer Begegnung mit Beutegreifern zu entgehen. Mitunter tritt die Schwarzfersenantilope auch assoziiert mit Gruppen von Pavianen wie dem Anubispavian auf, so unter anderem in der Serengeti beobachtet. Dies minimiert für die Schwarzfersenantilope unter Umständen die Gefahr der Nachstellung durch größere Raubtiere,[34] ist aber möglicherweise auch mit höheren Risiken für die Antilopenart verbunden, da die Affen gelegentlich selbst deren Jungtiere erbeuten.[35][1][2][3]
_on_Impala_(6002394739).jpg.webp)
Die Schwarzfersenantilope ist Wirt zahlreicher Parasiten. Äußere Parasiten finden sich vor allem bei den Zecken, unter anderem in den Gattungen Amblyomma, Boophilus und Rhipicephalus. Die Intensität des Zeckenbefalls ist abhängig von der Jahreszeit und der Populationsdichte und wirkt sich auf ausgewachsene Tiere stärker aus als auf Jungtiere. Generell sind Männchen häufiger betroffen als Weibchen, was als Ausdruck der hohen energetischen Kosten der Fortpflanzung gewertet werden kann. In der Paarungszeit tragen männliche Tiere bis zu sechsmal so viel Parasiten wie weibliche. Herbei wirkt sich unter anderem die zurückgehende gegenseitige Fellpflege aus.[36] Des Weiteren kommen verschiedene Läuse vor, so beispielsweise Damalinia und Linognathus. Letztere können an Jungtieren verstärkt auftreten und sind bei ausgewachsenen Individuen häufiger bei Weibchen als bei Männchen zu finden.[37] Häufig pickt der Madenhacker Parasiten aus dem Fell der Schwarzfersenantilope, wobei er sich auf die Stellen des größten Befalls, der Bereich um Ohren, Kopf und Nacken, konzentriert.[38][1][2][3]
Innere Parasiten sind mit verschiedensten Würmern vertreten, allein in Zimbabwe wurden über drei Dutzend verschiedene Arten bei der Schwarzfersenantilope nachgewiesen. Hierzu zählen unter anderem Fadenwürmer, Bandwürmer und Saugwürmer. Bedeutende Gattungen stellen etwa Impalaia, Haemonchus, Cooperioides, Stilesia oder Pneumostrongylus dar. Letztere ließ sich bei Untersuchungen in Eswatini bei 85 % aller Individuen in den Lungen belegen.[39][40][41][42] Wiederum anhand von Analysen an Kotproben von Tieren aus Sambia ergab sich, dass der Befall mit Würmern in der Regenzeit deutlich höher ist als in der Trockenzeit. Einzelne Fadenwürmer wie etwa Strongyloides, aber auch Kokzidien, konnten nur in der feuchten Jahresphase nachgewiesen werden.[43] Darüber hinaus wurde gelegentlich Milzbrand dokumentiert.[28][1][2][3]
Systematik
Innere Systematik der Impalas nach Lorenzen et al. 2006[44]
|


Die Schwarzfersenantilope ist eine Art aus der Gattung der Impalas (Aepyceros). Als Teil der Familie der Hornträger (Bovidae) wird die Gattung zur Unterfamilie der Antilopinae und zur eigenen Tribus der Aepycerotini gezählt, die wiederum mit den Böckchen (Nesotragus) näher verwandt ist.[45][46][47] Die Impalas umfassen zwei auf das östliche und südliche Afrika beschränkte Arten der Antilopen. Als besondere Kennzeichen können die leierartigen, stark gerippten und nur bei männlichen Individuen ausgebildeten Hörner sowie das Fehlen von Duftdrüsen in Gesicht, Füßen und im Leistenbereich herausgestellt werden. Ansonsten gleichen die Tiere weitgehend den anderen Antilopen.[48] In der Regel wurden die Impalas als lediglich zu einer Art gehörig angesehen und in Unterarten aufgeteilt: die Schwarzfersenantilope (A. m. melampus), die eine weite Verbreitung im östlichen und südöstlichen Afrika erreicht und mehrere Subpopulationen einschließt, sowie die Schwarznasenimpala (A. m. petersi), die endemisch im südwestlichen Teil des Kontinents auftritt.[49] Einzelne Autoren betrachteten jedoch im ersten und zweiten Drittel des 20. Jahrhunderts die Schwarznasenimpala mitunter als eigenständige Art. Hierzu gehörte unter anderem Henriette Oboussier, die Mitte der 1960er Jahre neben morphologischen Unterschieden auch abweichende Verhaltensweisen hervorhob.[50][7] Verschiedene molekulargenetische Studien aus dem Beginn der 2000er Jahre zeigten dann auf, dass sich beide Hauptpopulationen der Impalas deutlich unterscheiden. Unter anderem kommt es im Etosha-Nationalpark in Namibia, wo die Schwarznasenimpala natürlich auftritt, die Schwarzfersenantilope allerdings künstlich eingeführt worden war, nicht zu Hybridisierungen.[51][52] Dies nahmen Colin P. Groves und Peter Grubb im Jahr 2011 zum Anlass, die Gattung in ihrer Revision der Huftiersystematik in zwei Arten aufzuspalten.[2][53] In einer weiteren genetischen Untersuchung aus dem Jahr 2006 konnten innerhalb der Schwarzfersenantilope zwei mehr oder weniger getrennte Linien heraus differenziert werden, die einerseits die Tiere des östlichen, andererseits die des südlichen Afrikas umfassen. Zusätzlich erwies sich die Population des Samburu-Gebietes in Kenia als genetisch deutlich verschieden. Die östliche und südliche Gruppe entstanden wohl durch Isolation der beiden Populationen voneinander, nachdem sie sich von einer gemeinsamen Ursprungsgruppe getrennt hatten. Diese Ausgangspopulation bestand möglicherweise im Pleistozän im südlichen Afrika, wie es auch für einige andere, teils an trockene Lebensräume angepasste Huftiere belegt ist.[44] Innerhalb der südlichen Linie der Schwarzfersenantilope lässt sich außerdem eine hohe genetische Diversität belegen. Bewirkt wird dies wohl durch Wanderungs- und Ausbreitungsbarrieren wie etwa die Drakensberge, wodurch zum Beispiel zwischen den Beständen der südafrikanischen Regionen KwaZulu und Limpopo ein genetischer Unterschied von bis zu 3,6 % besteht.[54] Im nördlichen Südafrika treten gelegentlich Tiere auf, die phänotypisch der Schwarznasenimpala entsprechen, genetisch aber zur Schwarzfersenantilope gehören. Inwiefern Genfluss zur deutlich abgetrennten Population der Schwarznasenimpala in Namibia besteht, ist bisher ungeklärt.[55]
In der forschungsgeschichtlichen Vergangenheit wurden mehrere Unterarten der Schwarzfersenantilope beschrieben. Teilweise waren im Verlauf des 20. Jahrhunderts bis zu knapp einem halben Dutzend anerkannt. Die Unterscheidung erfolgte häufig anhand der Hornform und der Gesichtszeichnung. Eine morphometrische Analyse aus dem Jahr 2007 kam zu dem Schluss, dass wenigstens drei der angenommenen Unterarten unterscheidbar sind. Hierzu gehören etwa die Nominatform A. m. melampus aus Südafrika, A. m. johnstoni aus Malawi und Sambia und A. m. suara aus dem östlichen Afrika. Von diesen zeigt sich A. m. johnstoni als kleinste Form mit kurzen Hörnern und schlankem Schädel, während A. m. suara auch im Vergleich zur Nominatform groß ist und weit auseinanderstehende Hornspitzen aufweist.[56] Andere Autoren sehen dies kritischer und fassen die Schwarzfersenantilope als monotypisch auf, da weder detaillierte Beschreibungen der Unterarten vorliegen noch die Verbreitungsgebiete genauer eingegrenzt wurden.[3][2][53]
Die wissenschaftliche Erstbeschreibung der Schwarzfersenantilope stammt von Martin Hinrich Lichtenstein aus dem Jahr 1812 unter der Bezeichnung Antilope melampus. Er stellte die Art in seinen Aufzeichnungen über seine Reisen durch das südliche Afrika in den Jahren 1803 bis 1806 vor und fügte der kurzen Beschreibung, in der er die großen geriffelten Hörner und die schwarzen Streifen an Schwanz und Fersen hervorhob, eine Zeichnung bei. Als Typuslokalität gab Lichtenstein das „Khoossi-Thal“ an,[57] welches heute mit Khosis nahe der Stadt Kuruman in der südafrikanischen Provinz Nordkap übereinstimmt.[49][3] Der Artname melampus ist griechischen Ursprungs und leitet sich von den Wörtern μέλας (melas) für „schwarz“ und πούς (pous) für „Fuß“ her, bezieht sich also auf die schwarzen Streifen an den Fersen.[56] Der Gattungsname Aepyceros geht auf Carl Jakob Sundevall zurück und wurde von ihm im Jahr 1845 geprägt. Er hob damit die Schwarzfersenantilope von anderen, ebenfalls unter der Bezeichnung Antilope eingestuften Formen ab. Auch diese Bezeichnung ist griechischen Ursprungs, ihr liegen die Worte αἰπύς (aipus) für „hoch“ oder „steil“ und κέρας (kéras) für „Horn“ zugrunde.[58][59] Der Name Impala ist der Sprache der Zulu entlehnt.[60] Nach Aussage Lichtensteins in seiner Erstbeschreibung nannten die Batswana das Tier P'halla.[57]
Stammesgeschichte
Impalas sind erstmals im Übergang vom Oberen Miozän zum Unteren Pliozän vor rund 5 bis 6 Millionen Jahren fassbar. Frühe Formen finden sich unter anderem mit den Arten Aepyceros afarensis und Aepyceros datoadeni aus der Awash-Region in Äthiopien[5][61] oder mit Aepyceros dietrichi aus Laetoli in Tansania[62] beziehungsweise mit Aepyceros shungurae aus Koobi Fora in Kenia. Letztere Fundstelle enthielt möglicherweise auch einzelne Reste der Schwarzfersenantilope wie einen nahezu vollständiger Schädel aus dem Burgi-Schichtglied der Koobi-Fora-Formation. Dieser weist jedoch noch Ähnlichkeiten zu Aepyceros shungurae auf, die sich unter anderem in einer generell geringeren Körpergröße, einer kürzeren Schnauze mit Anzeichen einer Voraugengrube und in weniger leierartigen Hörnern ausdrücken. Eindeutiger sind hingegen Funde aus der Olduvai-Schlucht und aus Peninj rund 70 km nordöstlich von dieser, beide Tansania. Die Fossilreste bestehen aus verschiedenen Hornfragmenten sowie Kieferresten und datieren in das Altpleistozän.[63] Aus dem südlichen Afrika sind einige Fragmente in Form von Hornteilen aus den Kalksteinbrüchen von Makapansgat überliefert.[64] Deren genaue systematische Stellung ist aber nicht eindeutig.[6]
Gefährdung und Schutz
Die größten Bedrohungen für den Bestand der Schwarzfersenantilope sind die Wilderei und die Ausbreitung land- und weidewirtschaftlicher Nutzflächen. Zusätzlich erfolgt auch eine aktive Jagd sowohl für Trophäen als auch als Nahrungsressource. Die Schwarzfersenantilope gehört im südlichen Afrika neben den verschiedenen Springböcken zu den am stärksten bejagte Antilopen. Das Fleisch wird häufig als Trockennahrungsmittel (Biltong) verwendet und gelangt ebenso als Wildfleisch in den Export. Hoher Jagddruck und menschliche Aktivitäten im Allgemeinen beeinflussen auch das Verhalten der Tiere etwa in Form von einem Wechsel von Tages- zu Nachtaktivtäten oder kürzeren Ruhephasen.[15][65] In einigen Bereichen des Verbreitungsgebietes ist die Art bereits ausgerottet. Dennoch gilt sie als weit verbreitet, die Gesamtpopulation setzt sich möglicherweise aus rund 2 Millionen Individuen zusammen. Die IUCN sieht den Bestand der Schwarzfersenantilope daher momentan als „nicht gefährdet“ (least concern) an. Sie kommt in zahlreichen Naturschutzgebieten vor, hervorzuheben wären die Masai Mara in Kenia, die Serengeti in Tansania, das Okavangodelta in Botswana, der Hwange-Nationalpark in Simbabwe sowie der Kruger-Nationalpark in Südafrika. Rund ein Viertel der Gesamtpopulation verteilt sich heute auf die Schutzgebiete. Etwa die Hälfte befindet sich dem gegenüber im Besitz privater Farmen, wo die Tiere teilweise der Jagd dienen. Insgesamt wird so der Bestand der Schwarzfersenantilope als stabil und leicht ansteigend bewertet. Des Weiteren sind verschiedene Gruppen der Schwarzfersenantilope auf Wildfarmen in Namibia und im nördlichen Südafrika anthropogen eingeführt worden, ebenso in zwei Schutzgebieten in Gabun.[52][66][67]
Literatur
- Hervé Fritz und Mathieu Bourgarel: Aepyceros melampus Impala. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume VI. Pigs, Hippopotamuses, Chevrotain, Giraffes, Deer and Bovids. Bloomsbury, London, 2013, S. 480–487
- Colin P. Groves und David M. Leslie Jr.: Family Bovidae (Hollow-horned Ruminants). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 444–779 (S. 624–625)
- Walter Leuthold: Observations on the social organization of impala (Aepyceros melampus). Zeitschrift für Tierpsychologie 27 (6), 1970, S. 693–720
- Rudolf Schenkel: On sociology and behaviour in impala (Aepyceros melampus suara Matschie). Zeitschrift für Säugetierkunde 31, 1966, S. 177–205
- J. T. du Toit: Ruminantia. In: J. D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Sub-region. Cambridge University Press, 2005, S. 616–714 (S. 702–706)
Einzelnachweise
- J. T. du Toit: Ruminantia. In: J. D. Skinner und Christian T. Chimimba (Hrsg.): The Mammals of the Southern African Sub-region. Cambridge University Press, 2005, S. 616–714 (S. 702–706)
- Colin P. Groves und David M. Leslie Jr.: Family Bovidae (Hollow-horned Ruminants). In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 444–779 (S. 624–625)
- Hervé Fritz und Mathieu Bourgarel: Aepyceros melampus Impala. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume VI. Pigs, Hippopotamuses, Chevrotain, Giraffes, Deer and Bovids. Bloomsbury, London, 2013, S. 480–487
- Susan M. Miller, Alan J. Guthrie und Cind K. Harper: Single base-pair deletion in ASIP exon 3 associated with recessive black phenotype in impala (Aepyceros melampus). Animal Genetics 47, 2016, S. 510–515
- Denis Geraads, René Bobe und Kaye Reed: Pliocene Bovidae (Mammalia) from the Hadar formation of Hadar and Ledi-Geraru, Lower Awash, Ethiopia. Journal of Vertebrate Paleontology 32 (1), 2012, S. 180–197
- Alan William Gentern: Bovidae. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, Los Angeles, London, 2010, S. 741–796 (S. 765–766)
- Eugene Jaubert: Observations on the habitat preferences and population dynamics of the Black-faced impala Aepyceros petersi Bocage, 1875 in South West Africa. Madoqua Ser. 1 3, 1971, S. 55–65
- Bob Mandinyenya, Norman Monks, Peter J. Mundy, Allan Sebata und Albert Chirima: Habitat use by mixed feeder: impala Aepyceros melampus in a heterogeneous protected area. Journal of Tropical Ecology 34, 2018, S. 378–384, doi:10.1017/S026646741800038X
- Walter Leuthold: Observations on the social organization of impala (Aepyceros melampus). Zeitschrift für Tierpsychologie 27 (6), 1970, S. 693–720
- Martyn G. Murray: Structure of association in impala, Aepyceros melampus. Behavioral Ecology and Sociobiology 9, 1981, S. 23–33
- Rudolf Schenkel: On sociology and behaviour in impala (Aepyceros melampus suara Matschie). Zeitschrift für Säugetierkunde 31, 1966, S. 177–205
- A. F. Van Rooyen: Variation in body condition of impala and nyala in relation to social status and reproduction. South African Journal of Wildlife Research 23 (2), 1993, S. 36–38
- C. M. Oliver, J. D. Skinner und D. Van der Merwe: Territorial behaviour in southern impala rams (Aepycerus melampus Lichtenstein). African Journal of Ecology 45, 2006, S. 142–148
- Martyn G. Murray: Home range, dispersal and the clan system of impala. African Journal of Ecology 20 (4), 1982, S. 253–269
- William-Georges Crosmary, Marion Valeix, Hervé Fritz, Hillary Madzikanda und Steeve D. Côté: African ungulates and their drinking problems: trophy hunting and predation constrain access to surface water. Animal Behaviour 83, 2012, S. 145–153
- Muposhi Victor Kurauwone, Muvengwi Justice, Utete Beven, Kupika Olga, Chiutsi Simon und Tarakini Tawanda: Activity budgets of impala (Aepyceros melampus) in closed environments: The Mukuvisi Woodland Experience, Zimbabwe. International Journal of Biodiversity 2013, S. 270454, doi:10.1155/2013/270454
- Benjamin L. Hart und Lynette A. Hart: Reciprocal allogrooming in impala, Aepyceros melampus. Animal Behaviour 44, 1992, S. 1073–1083
- Michael S. Mooring und Benjamin L. Hart: Differential grooming rate and tick load of territorial male and female impala, Aepyceros melampus. Behavioral Ecology 6 (1), 1994, S. 94–101
- R. H. Monro: Observations on the feeding ecology of impala. South African Journal of Zoology 15 (2), 1980, S. 107–110
- H. H. Meissner, Elsje Pieterse und J. H. J. Potgieter: Seasonal food selection and intake by male impala Aepyceros melampus in two habits. South African Journal of Wildlife Research 26 (2), 1996, S. 56–63
- Sandi R. Copeland, Matt Sponheimer, Clive A. Spinage, Julia A. Lee-Thorp, Daryl Codron und Kaye E. Reed: Stable isotope evidence for impala Aepyceros melampus diets at Akagera National Park, Rwanda. African Journal of Ecology 47, 2009, S. 490–501
- Torsten Wronsky: Fire induced changings in the foraging behaviour of impala Aepyceros melampus in Lake Mburo National Park, Uganda. African Journal of Ecology 41, 2003, S. 56–60
- Torsten Wronsky: Feeding ecology and foraging behaviour of impala Aepyceros melampus in Lake Mburo National Park, Uganda. African Journal of Ecology 40, 2002, S. 205–211
- M. Sponheimer, C. C. Grant, D. J. de Rutter, J. A. Lee-Thorp, D. M. Codron und J. Codron: Diets of Impala from Kruger National Park: evidence from stable carbon isotopes. Koedoe 46 (1), 2003, S. 101–106
- S. R. Moe, L. P. Rutina und J. T. du Toit: Trade-off between resource seasonality and predation risk explains reproductive chronology in impala. Journal of Zoology 273, 2007, S. 237–243
- N. Fairall und H. H. Braack: Growth and development in the Impala Aepyceros melampus. Koedoe 19, 1976, S. 83–88
- Jan F. Kamler, James L. Foght und Kai Collins: Single black-backed jackal (Canis mesomelas) kills adult impala (Aepyceros melampus). African Journal of Ecology 48, 2009, S. 847–848
- H. P. Cronje, B. K. Reilly und I. D. Macfadyen: Natural mortality amoung four common ungulate species on Letaba Ranch, Limpopo Province, South Africa. Koedoe 45 (1), 2002, S. 79–86
- Matt W. Hayward und Graham I. H. Kerley: Prey preferences of the lion (Panthera leo). Journal of Zoology 276, 2005, S. 309–322
- P. J. Funston und M. G. L. Mills: The influence of lion predation on the population dynamics of common large ungulates in the Kruger National Park. South African Journal of Wildlife Research 36 (1), 2006, S. 9–22
- Monika B. Lehmann, Paul J. Funston, Cailey R. Owen und Rob Slotow: Feeding behaviour of lions (Panthera leo) on a small reserve. South African Journal of Wildlife Research 38 (1), 2008, S. 66–78
- Richard Stratton Hatfield: Diet and space use of the Martian eagle (Polemaetus bellicosus) in the Maasai Mara region of Kenya. University of Kentucky, 2018, S. 1–69
- Vincent N. Naude, Lucy K. Smyth, Eleanor A. Weideman, Billi A. Krochuk und Arjun Amar: Using web-sourced photography to explore the diet of a declining African raptor, the Martian eagle (Polemaetus bellicosus). The Condor 121, 2019, S. 1–9, doi:10.1093/condor/duy015
- R. Baenninger, Richard D. Estes und S. Baldwin: Anti-predator behaviour of baboons and impalas toward a cheetah. East African Wildlife Journal 15, 1977, S. 327–329
- Christian Kiffner, John Kioko, Cecilia Leweri und Stefan Krause: Seasonal patterns of mixed species groups in large East African mammals. PLoS ONE 9 (12), 2014, S. 113446, doi:10.1371/journal pone.113446
- G. J. Gallivan, J. Culverwell, R. Girdwood und G. A. Surgeoner: Ixodid ticks of impala (Aepyceros melampus) in Swaziland: effect of age class, sex, body condition and management. South African Journal of Zoology 30 (4), 1995, S. 178–186
- L. A. Durden und I. G. Horak: Linognathus weisseri n. sp. (Phthiraptera: Linognathidae) of impalas, Aepyceros melampus: description and biology. Onderstepoort Journal of Veterinary Research 71, 2004, S. 59–66
- Michael S. Mooring und Peter J. Mundy: Interactions between impala and oxpeckers at Matobo National Park, Zimbabwe. African Journal of Ecology 34, 1996, S. 54–65
- R. J. Ortlepp: Haemonchus krugeri sp. nov. (Nematoda: Trichostrongyloidea) from an impala (Aepyceros melampus). Onderstepoort Journal of Veterinary Research 31 (1), 1964, S. 53–58
- Lynda M. Gibbons, Marie-Claude Durette-Desset und P. Daynès: A review of the genus Impalaia Mönnig, 1923 (Nematoda: Trichostrongyloidea). Annales de Parasitologie 52 (4), 1977, S. 435–446
- G. J. Gallivan, I. K. Barker, R. M. R. Alves, J. Culverwell und R. Girdwood: Observation on the lungworm, Pneumostrongylus calcaratus, in impala (Aepyceros melampus) from Swaziland. Journal of Wildlife Diseases 25 (1), 1989, S. 76–82
- G. J. Gallivan, I. K. Barker, J. Culverwell und R. Girdwood: Prevalence of hepatic helminths and associated pathology in impala (Aepyceros melampus) in Swaziland. Journal of Wildlife Diseases 32 (1), 1996, S. 137–141
- K. S. Nalubamba, N. B. Mudenda und M. R. Malamo: ASingle seasonal survey of gastrointestinal parasites in captive wild impala antilope on a game facility south of Lusaka, Zambia. Journal of Helminthology 86, 2012, S. 418–425
- Eline D. Lorenzen, Peter Arctander und Hans R. Siegismund: Regional Genetic Structuring and Evolutionary History of the Impala Aepyceros melampus. Journal of Heredity 97 (2), 2006, S. 119–132, doi:doi:10.1093/jhered/esj012
- M. V. Kuznetsova und M. V. Kholodova: Revision of Phylogenetic Relationships in the Antilopinae Subfamily on the Basis of the Mitochondrial rRNA and β-Spectrin Nuclear Gene Sequences. Doklady Biological Sciences 391 (1–6), 2003, S. 333–336
- Eva V. Bärmann und Tim Schikora: The polyphyly of Neotragus – Results from genetic and morphometric analyses. Mammalian Biology 79, 2014, S. 283–286
- Juan P. Zurano, Felipe M. Magalhães, Ana E. Asato, Gabriel Silva, Claudio J. Bidau, Daniel O. Mesquita und Gabriel C. Costa: Cetartiodactyla: Updating a time-calibrated molecular phylogeny. Molecular Phylogenetics and Evolution 133, 2019, S. 256–262
- Jonathan Kingdon: Tribe Aepycerotini Impala. In: Jonathan Kingdon, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume VI. Pigs, Hippopotamuses, Chevrotain, Giraffes, Deer and Bovids. Bloomsbury, London, 2013, S. 477–479
- Don E. Wilson und DeeAnn M. Reeder: Mammal Species of the World. Johns Hopkins University Press, Baltimore, 2005 ISBN 0-8018-8221-4 ()
- Henriette Oboussier: Zur Kenntnis der Schwarzfersenantilope (Impala) Aepyceros melampus unter besonderer Berücksichtigung des Großhirnfurchenbildes und der Hypophyse. Ergebnisse der Forschungsreisen nach Süd-Angola und Ostafrika. Zeitschrift für Morphologie und Ökologie der Tiere 54, 1965, S. 531–550
- Louise Grau Nersting und Peter Arctander: Phylogeography and conservation of impala and greater kudu. Molecular Ecology 10, 2001, S. 711–719
- Eline D. Lorenzen und Hans R. Siegismund: No suggestion of hybridization between the vulnerable black‐faced impala (Aepyceros melampus petersi) and the common impala (A. m. melampus) in Etosha National Park, Namibia. Molecular Evolution 13 (10), 2004, S. 3007–3019
- Colin P. Groves und Peter Grubb: Ungulate Taxonomy. Johns Hopkins University Press, 2011, S. 1–317 (S. 108–280)
- Patrick Schwab, Paul V. Debes, Thorsten Witt, Günther B. Hartl, San San Hmwe, Frank E. Zachos und J. Paul Grobler: Genetic structure of the common impala (Aepyceros melampus melampus) in South Africa: phylogeography and implications for conservation. Journal of Zoological Systematics and Evolutionary Research 50 (1), 2012, S. 76–84, doi:10.1111/j.1439-0469.2011.00638.x
- J. Paul Grobler, Kyla N. Hayter, Christiaan Labuschagne, E. J. Nel und Willem G. Coetzer: The genetic status of naturally occurring black-nosed impala from northern South Africa. Mammalian Biology 82, 2017, S. 27–33
- C. Bastos-Silveira und A. M. Lister: A morphometric assessment of geographical variation and subspecies in impala. Journal of Zoology 271 (3), 2007, S. 288–301
- Martin Hinrich Lichtenstein: Reisen im südlichen Africa: in den Jahren 1803, 1804, 1805 und 1806. Zweiter Theil. Berlin, 1812, S. 1–661 (S. 544) ()
- Carl Jakob Sundevall: Methodisk öfversigt af Idislande djuren, Linnés Pecora. Kongl. Svenska vetenskapsakademiens handlingar Serie 3, 32–33, 1844–1845, S. 267–330 (S. 271) ()
- T. S. Palmer: Index Generum Mammalium: A List of the Genera and Families of Mammals. North American Fauna 23, 1904, S. 82, ()
- D. T. Cole: Old Tswana and New Latin. Botswana Notes and Records 23, 1991, S. 175–191, ()
- Denis Geraads, Stephanie Melillo und Yohannes Haile-Selassie: Middle Pliocene Bovidae from Hominid-bearing sites in the Woranso-Mille area, Afar region, Ethiopia. Palaeontologia Africana 44, 2009, S. 59–70
- Alan William Gentry: Bovidae. In: T. Harrison (Hrsg.): Paleontology and Geology of Laetoli: Human Evolution in Context. Volume 2: Fossil Hominins and the Associated Fauna. Springer Science+Business Media, 2011, S. 363–465 (S. 375–379)
- Alan William Gentry und Anthea Gentry: Fossil Bovidae (Mammalia) of Olduvai Gorge, Tanzania, Part 1. Bulletin of the British Museum (Natural History) 29, 1977–1978, S. 289–446 (S. 416) ()
- L. H. Wells und B. S. Cooke: Fossil Bovidae from the Limeworks quarry, Makapamsgat, Potgietersus. Palaeontologia Africana 4, 1957, S. 1–55 (S. 36–37)
- T. Setsaas, L. Hunninck, C. R. Jackson ,R .May und E. Røskaft: The impacts of human disturbances on the behaviour and population structure of impala (Aepyceros melampus) in the Serengeti ecosystem, Tanzania. Global Ecology and Conservation 16, 2018, S. e00467, doi:10.1016/j.gecco.2018.e00467
- IUCN SSC Antelope Specialist Group: Aepyceros melampus. The IUCN Red List of Threatened Species 2016. e.T550A50180828 (), zuletzt abgerufen am 28. September 2019
- IUCN SSC Antelope Specialist Group: Aepyceros melampus ssp. melampus. The IUCN Red List of Threatened Species 2017. e.T136944A50198224 (), zuletzt abgerufen am 28. September 2019
Weblinks
- Aepyceros melampus in der Roten Liste gefährdeter Arten der IUCN 2019.2. Eingestellt von: IUCN SSC Antelope Specialist Group, 2016. Abgerufen am 24. September 2019.
- Aepyceros melampus ssp. melampus in der Roten Liste gefährdeter Arten der IUCN 2019.2. Eingestellt von: IUCN SSC Antelope Specialist Group, 2016. Abgerufen am 24. September 2019.