Gefitinib
Gefitinib (Handelsname Iressa, AstraZeneca) ist ein als Tablette einzunehmendes Medikament aus der Wirkstoffklasse der Tyrosinkinase-Inhibitoren. Die übliche Dosierung beträgt 250 mg täglich.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
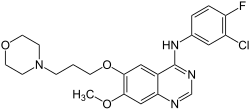 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Gefitinib | |||||||||||||||||||||
| Andere Namen |
N-(3-Chlor-4-fluorphenyl)-7-methoxy-6-[3-(morpholin-4-yl)propoxy]chinazolin-4-amin (IUPAC) | |||||||||||||||||||||
| Summenformel | C22H24ClFN4O3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes, kristallines, nicht hygroskopisches Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XE02 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 446,90 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
leicht löslich in Eisessig und in Dimethylsulfoxid, löslich in Pyridin, schwer löslich in Tetrahydrofuran und schwach löslich in Methanol, Ethanol, Essigsäureethylester, 2-Propanol und Acetonitril[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wirkmechanismus
Gefitinib hemmt vor allem die Tyrosinkinasen aus der EGFR-Familie (Epidermal Growth Factor Receptor, Rezeptor für den Epidermiswachstumsfaktor). In einigen Tumoren sind EGF-Rezeptoren überexprimiert. Eine Hemmung der EGF-Rezeptoren führt zur Verlangsamung des Tumorwachstums oder sogar zur Tumorregression.
Studienlage zur Anwendung
In den Jahren 2009 und 2010 wurden Therapiestudien zur Behandlung von Patienten mit nicht-kleinzelligem Bronchialkarzinom veröffentlicht, bei denen die Gabe von Gefitinib mit herkömmlichen Chemotherapien verglichen wurden. Es zeigte sich, dass eine Behandlung mit Gefitinib bei einer Untergruppe dieser Patienten besser wirksam war, als eine Behandlung mit einer „Standard“-Chemotherapie aus Carboplatin/Cisplatin und Taxol.[3][4] Allerdings war Gefitinib nur dann besser wirksam, wenn die entsprechenden Patienten Mutationen im EGFR-Gen aufwiesen. Lagen solche Mutationen nicht vor, dann war Gefitinib schlechter wirksam als die Standard-Therapie. Diese Mutationen waren häufiger bei weiblichen Patienten, Patienten, die nie geraucht hatten, und Patienten mit Adenokarzinomen zu finden.
Diese Ergebnisse führten dazu, dass die American Society of Clinical Oncology in ihren Leitlinien zur Behandlung nicht-kleinzelliger Bronchialkarzinome 2009 empfahl, bei Patienten mit EGFR-Mutationen Gefitinib einzusetzen.[5]
Am 24. Juni 2009 erteilte die Europäische Kommission dem Unternehmen AstraZeneca AB eine Genehmigung für das Inverkehrbringen von Iressa in der gesamten Europäischen Union für die Behandlung nicht-kleinzelliger Bronchialkarzinome mit aktivierenden EGFR-Mutationen.[6]
Unerwünschte Nebenwirkungen
Die möglichen Nebenwirkungen von Gefitinib sind im Wesentlichen Hautausschläge und Diarrhö.
Einzelnachweise
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station, NJ, USA, 2006, ISBN 0-911910-00-X.
- Sicherheitsdatenblatt bei Caymanchem, abgerufen am 26. Mai 2020.
- T. S. Mok, Y. L. Wu, S. Thongprasert, C. H. Yang, D. T. Chu, N. Saijo, P. Sunpaweravong, B. Han, B. Margono, Y. Ichinose, Y. Nishiwaki, Y. Ohe, J. J. Yang, B. Chewaskulyong, H. Jiang, E. L. Duffield, C. L. Watkins, A. A. Armour, M. Fukuoka: Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. In: N Engl J Med. 361(10), 2009, S. 947–957. PMID 19692680.
- T. Mitsudomi, S. Morita, Y. Yatabe, S. Negoro, I. Okamoto, J. Tsurutani, T. Seto, M. Satouchi, H. Tada, T. Hirashima, K. Asami, N. Katakami, M. Takada, H. Yoshioka, K. Shibata, S. Kudoh, E. Shimizu, H. Saito, S. Toyooka, K. Nakagawa, M. Fukuoka; West Japan Oncology Group: Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. In: Lancet Oncol. 11(2), 2010, S. 121–128. PMID 20022809.
- C. G. Azzoli, S. Baker Jr, S. Temin, W. Pao, T. Aliff, J. Brahmer, D. H. Johnson, J. L. Laskin, G. Masters, D. Milton, L. Nordquist, D. G. Pfister, S. Piantadosi, J. H. Schiller, R. Smith, T. J. Smith, J. R. Strawn, D. Trent, G. Giaccone; American Society of Clinical Oncology: American Society of Clinical Oncology Clinical Practice Guideline update on chemotherapy for stage IV non-small-cell lung cancer. In: J Clin Oncol. 27(36), 2009, S. 6251–6266. PMID 19917871.
- EMEA: Zusammenfassung des EPAR für die Öffentlichkeit: Iressa - Gefitinib (PDF; 39 kB).