Reticulomyxa filosa
Reticulomyxa filosa ist eine Art aus der Gruppe der einzelligen Foraminiferen und der einzige Vertreter ihrer Gattung aus der Ordnung der Allogromiida. Diese 1949 erstbeschriebene Art aus der Gruppe der Protisten ist eine der wenigen Foraminiferen-Arten, die nicht im Meer, sondern im Süßwasser lebt. Darüber hinaus besitzt sie – anders als die Mehrheit der Foraminiferen – auch kein Gehäuse.
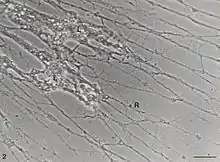
| Reticulomyxa filosa | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
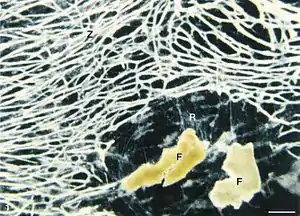
Dunkelfeldaufnahme des Zellkörpers (Z) von Reticulomyxa filosa. Rechts unten befinden sich Futterpartikel (Weizenkeime, (F)) in ein feines Netz von Reticulopodien (R) eingebettet. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Reticulomyxa | ||||||||||||
| Nauss, 1949 | ||||||||||||
| Wissenschaftlicher Name der Art | ||||||||||||
| Reticulomyxa filosa | ||||||||||||
| Nauss, 1949 | ||||||||||||
Die Art diente seit ihrer Wiederentdeckung in den frühen 1980er Jahren als Modellorganismus für zellbiologische Forschungen, seit der Jahrtausendwende auch für molekulargenetische Analysen zu systematischen Zwecken. Durch die in diesem Rahmen geleistete Arbeit ist die Art für einen Einzeller ungewöhnlich gut erforscht. Besonderheiten zeigten sich dabei insbesondere hinsichtlich der ungewöhnlichen Weise der Vermehrung, der Ausbildung zweier verschiedener Ruhestadien sowie der sehr leistungsfähigen Wege des Transports von Organellen innerhalb der Zelle.
Merkmale
Die Zellen sind von einer Schleimhülle umgebene, annähernd unbewegliche vielkernige Plasmodien ohne Gehäuse oder proteinöse Hülle mit variabler, netzartiger Gestalt. Ihr Durchmesser liegt in der Regel bei rund 1 bis 3 Zentimetern, sie können eine maximale Ausdehnung von bis zu 12 (nach anderen Angaben bis zu 25[1]) Quadratzentimetern erreichen. Der Organismus lässt sich in zwei Bereiche unterteilen, einen Zentralbereich und einen Peripheriebereich. Letzterer wird durch die strahlenförmig aus dem bis zu 6 Millimeter im Durchmesser messenden Zentralbereich herausgehenden langen, fadenförmigen Retikulopodien gebildet. Diese sind entlang der untereinander vielfach vernetzten (Anastomosie) Hauptstränge im Mittel um 100 (40 bis 250[1]) Mikrometer dick, verjüngen sich aber bei feinen Ausläufern bis auf 1 Mikrometer Dicke. Insgesamt können sie eine Länge des Zehnfachen des Durchmessers des Zentralbereichs erreichen.[2]
Das Zytoplasma ist grob- bis feinkörnig und weiß bis schwach rosa. Während der vegetativen Phase enthält es sehr viele nicht kontraktile Vakuolen, eine Differenzierung in Endo- und Ektoplasma fehlt.[3]
Ultrastruktur
Die Zelle enthält im Zentralbereich viele Tausend Zellkerne mit einem Durchmesser von 5 bis 6 Mikrometer sowie Diktyosome mit starken Zisternenstapeln.[2]
Das Zytoskelett besteht fast nur aus Mikrotubuli, der Gehalt an Aktin ist niedrig. Ein Zentrosom fehlt ebenso wie ein Mikrotubulusorganisationszentrum im konventionellen Sinn, letzteres befindet sich stattdessen kragenförmig am äußersten Ende der Mikrotubuli. Die Mikrotubuli fungieren als Schienen für den Antrieb einer bidirektionalen Körnchenströmung, die in der Mitte der Pseudopodien vom Zentralbereich weg-, in ihrer Peripherie aber zu ihm hinführt. Die Organellen bewegen sich dabei auf den Mikrotubuli gleitend.[4] Der Auf- und Abbau von Mikrotubuli in Reticulomyxa geschieht mit bemerkenswert hoher Geschwindigkeit, beim Aufbau der Retikulopodien wurden Streckungsgeschwindigkeiten von bis zu 6,5 Mikrometer/Sekunde gemessen, beim Abbau Geschwindigkeiten von bis zu 19,5 Mikrometer/Sekunde. Außergewöhnlich ist, dass für den Transport von Organellen in beide Richtungen bereits ein einziger Mikrotubulus hinreichend ist, wahrscheinlich da das enthaltene Motorprotein Dynein in beide Richtungen arbeiten kann.[5][6]
Ruhestadium und Zyste
Reticulomyxa filosa verfügt über zwei verschiedene Ruhestadien, von denen aber nur eines behüllt und damit eine Zyste im strengen Sinn ist. Warum die Art zwei verschiedene Formen von Ruhestadien ausbildet, ist nicht bekannt. Als mögliche Ursachen gelten jahreszeitlich bedingte Abläufe[7] oder unterschiedliche Funktionen (evtl. stellt das unbehüllte Ruhestadium ein Ausbreitungsstadium dar[2]).
Unbehülltes Ruhestadium
Dieses Ruhestadium, das durch Nahrungsmangel, extremen Nährstoffüberschuss oder Kälte ausgelöst wird, entsteht, indem die Plasmodien sich zusammenziehen und dann fragmentieren. Die entstehenden Zellen haben einen Durchmesser von 50 bis 100 Mikrometer. Außer übergroßen Exozytosevesikeln und fehlenden Mikrotubuli – stattdessen jedoch zahlreichen zu Parakristallen aggregierten helikalen Filamenten – weisen die Zellen keinen Unterschied zu aktiven Zellen auf. Ein Stoffwechsel ist weiterhin vorhanden.[8][7]
Ein Übergang aus dem Ruhestadium in die Zystenform ist nicht möglich. Aber bereits wenige Minuten, nachdem normale Bedingungen herrschen, werden die Ruhestadien wieder aktiv und beginnen mit dem Aufbau eines neuen retikulopodialen Netzes.[7]
Zyste
Die echte Zyste bildet sich als Ergebnis von Nahrungsmangel. Die Plasmodie zieht sich zu einer wurstförmigen Gestalt zusammen und zerfällt danach in mehrere ovale bis kugelförmige Plasmaabschnitte.[2] Das Zellbild ist dabei zu Beginn annähernd unverändert, nur Mikrotubuli fehlen weitgehend und helikale Filamente vollständig. Im Lauf der nächsten zwei Tage beginnt dann die eigentliche Encystierung. Auf der Zelloberfläche bilden sich viele schlauch- bis keulenförmige Fortsätze, die 20 bis 40 Nanometer dick und rund 50 Nanometer lang sind, sie sind vermutlich an der Bildung der Hülle beteiligt. Die Hülle ist in dieser Phase rund 100 Nanometer stark und besteht aus feinen Fibrillen.[7]
Nach Ablauf von drei Tagen hat die Hülle bereits eine Dicke von 400 Nanometer. Parallel hat der Abbau vieler Organellen des Plasmas begonnen, selbst die Zahl der Zellkerne reduziert sich. Auch das zuvor vorhandene raue endoplasmatische Retikulum fehlt nun. Als Folge des Abbaus werden dunkle, sich ungeordnet bewegende Restkörper gebildet.[7]
Nach rund zehn Tagen ist die Encystierung beendet. Die aus der Mutterzelle hervorgegangenen Zysten sind nun 50 bis 200 Mikrometer groß, kugelförmig oder oval bis bohnenförmig und liegen oft nah beieinander. Sie sind von einer 20 bis 30 Mikrometer dicken, gelatinösen Schicht umgeben. Die Zystenwand ist 1 bis 2 Mikrometer dick und wird von innen durch eine Schicht 50 Nanometer dicker Fibrillen weiter verstärkt. Um die Restkörper haben sich Granula aggregiert. In den rund 500 vorhandenen 3,5 Mikrometer großen Zellkernen[2] fehlen die Nucleoli, weder Mikrotubuli noch Tubulin-Parakristalle sind aufzufinden. Die Zysten sind jetzt geschützt gegen Austrocknung und Temperaturen von bis zu −16 °C. Sie bleiben über Monate hinweg keimfähig.[2] Erst wenn über mehrere Tage hinweg gute Bedingungen herrschen, aktivieren sich die Zysten wieder. Sie lösen durch Enzyme die Zystenhülle punktuell auf[8], verlassen sie und bilden erneut Retikulopodien.[7]
Lebensweise
Reticulomyxa filosa wächst aquatisch bis semiaquatisch im Detritus von Süßgewässern. Die Zentralbereiche liegen vorzugsweise in vermutlich von Substrat oder Pflanzen verdeckten kleinen Nischen oder Hohlräumen, aus denen nur die Spitzen der Retikulopodien herausragen.
Ernährung
Reticulomyxa filosa sind Allesfresser, neben aus dem Detritus stammenden Nährstoffpartikeln ernähren sie sich auch von kleineren ein- und mehrzelligen Lebewesen wie z. B. Cyanobakterien, Bakterien, Rädertierchen, Grünalgen und selten auch Wimpertierchen. Zwar sind die Abläufe noch nicht bis ins Einzelne dokumentiert, aber vermutlich werden die entsprechenden Partikel aufgenommen, indem die Spitzen der Retikulopodien über die Partikel gestülpt werden oder indem mehrere der Retikulopodien das jeweilige Objekt umfließen, sich miteinander vereinigen und so die Nahrung einschließen. Bei mehrzelligen bzw. zellkolonialen Beutetieren werden einzelne Zellen aus dem Organismus herausgelöst. Nach dieser Phagozytose werden die Nahrungsvakuolen mittels der Körnchenströmung in den Zentralbereich transportiert. Bereits unterwegs beginnt die Verdauung, wird aber erst im Zentralbereich abgeschlossen, wo die Nährstoffe dann zur Verfügung stehen. Anfallende Exkremente werden durch die Oberflächen der Hauptstränge ausgeschieden, wo sie eine feste Schutzschicht ergeben.[2]
Fortpflanzung
Sexualprozesse von Reticulomyxa filosa sind nicht bekannt, dokumentiert ist nur eine Vermehrung durch Teilung der Zelle. Die Zellteilung geschieht dabei auf eine einzigartige Art und Weise.
Während des Wachstums des Organismus, insbesondere des Zentralbereichs, entstehen kontinuierlich neue Zellkerne. Die Zunahme von Zytoplasma und Zellkernen korreliert miteinander. Die Kernteilungen innerhalb der Zelle sind nach bisherigen Beobachtungen synchronisiert, erfolgen innerhalb weniger Minuten, nicht aber in regelmäßigen Abständen. Anders als bei den meisten Protisten bleibt die Kernhülle während der Teilung weitgehend erhalten und wird nur für die Spindelmikrotubuli durchlässig. Auch werden die der Kernhülle angelagerten Nukleoli nicht aufgelöst, sondern den resultierenden Tochterkernen mitgegeben.[2]
Wenn die Zelle die Ressourcen ihrer Umgebung erschöpft hat, tritt sie in die letzte Stufe der Vermehrung ein, die sogenannte Migrationsphase. Am Anfang steht dabei eine Art „Selbstreinigung“, indem die Zelle das Zytoplasma per Exozytose weitgehend von Reststoffen befreit. Die bisherige bidirektionale Körnchenströmung wird dann unidirektional und das gesamte Zytoplasma, einschließlich jenes des Zentralbereichs strömt nach außen. Bereits nach nur rund fünfzehn Minuten ist das Zytoplasma dann auf die äußersten Enden der Retikulopodien verteilt, wo sich so in der Regel drei oder vier neue Zentralbereiche bilden. Mit zunehmendem Wachstum der Tochterzellen kann es dann an gemeinsamen Kreuzungspunkten auch zur erneuten Verschmelzung der Plasmodiennetze kommen.[2]
Forschungsgeschichte
Reticulomyxa filosa wurde im Sommer 1937 in einer Pfütze voller Laub in New York City entdeckt und 1949 von der Botanikerin Ruth N. Nauss aufgrund einiger Merkmale als Schleimpilz erstbeschrieben, wenngleich sie auch eine Verwandtschaft zu den Foraminiferen in Betracht zog. Der Name wurde von Libbie H. Hyman vorgeschlagen und verweist auf die sehr langen, fadenförmigen Retikulopodien.[3] Im Jahr 1982 konnte sie dann in einem Fischbecken in den Tropenhäusern des Botanischen Gartens der Ruhr-Universität Bochum sowie kurz darauf in einem Laboraquarium in Berkeley wiedergefunden und isoliert werden. Trotz weiterer Funde gelang aber erst 1993 die Isolation aus einem nicht unmittelbar durch den Menschen beeinflussten Habitat, dem Möwensee bei Fürstenberg/Havel.[2]
Da sie sich anders als fast alle anderen Foraminiferen leicht in Kultur halten lässt und relativ schnelle Lebenszyklen aufweist, wurde sie seit ihrer Wiederentdeckung zu einem Modellorganismus insbesondere für Untersuchungen zur Motilität der Zellen.[2] Dieselben Vorteile – in Verbindung mit der allgemein seltenen Erhältlichkeit von Foraminiferen-DNA – haben dazu geführt, dass Reticulomyxa filosa seit der ersten Studie 1999 in vielen molekulargenetischen Arbeiten zu den Foraminiferen verwandt wurde[9][10], gelegentlich auch als Repräsentant[11][12] für die gesamte Gruppe. Im Jahr 2014 wurde das vollständige Genom der Art veröffentlicht[13], was unerwartet schwierig war, da es einen sehr hohen Anteil an repetitiven Sequenzen und auf Genomverdoppelung zurückgehenden Pseudogenen aufweist. Es ist erst der zweite Vertreter der Rhizaria, von dem eine vollständige Sequenz vorliegt.
Systematik
Die systematische Position von Reticulomyxa filosa war bis zum Ende des 20. Jahrhunderts unklar. Die Merkmale ließen sowohl eine Einordnung bei den Foraminiferen wie auch bei den Schleimpilzen zu. Bisherige Systematiken der Foraminiferen, die meist auf morphologischen Merkmalen der Gehäuse basieren, berücksichtigten Reticulomyxa meist nicht.[3]
Erst molekulargenetische Untersuchungen konnten klären, dass es sich bei der Art um eine Foraminifere handelt.[14] Spätere Untersuchungen bestätigten dies und festigten ihre vermutete Einordnung in die Allogromiida. Dessen ungeachtet gilt ihre genaue Position innerhalb der Foraminiferen auch anhand molekulargenetischer Ergebnisse als bisher nicht ausreichend geklärt, Hinweise auf eine basale Position von Reticulomyxa zu allen anderen Foraminiferen abseits einiger Allogromia-Arten gelten als nicht gefestigt.[15] Da sie sich phylogenetisch in der unmittelbaren Nähe einiger anderer gehäuseloser Arten wie auch von Arten mit agglutinierten Gehäusen befindet, gilt als wahrscheinlich, dass das ursprünglich vorhandene Gehäuse entwicklungsgeschichtlich im Rahmen der Anpassung an Süßwasserhabitate wieder verloren ging.[16]
Offensichtlich eng verwandt ist die Art auch mit der 1983 entdeckten und 2006 erstbeschriebenen Wobo gigas. Von Reticulomyxa filosa unterscheidet sie sich vor allem durch eine proteinöse Hülle sowie einen weniger komplex vernetzten Zentralbereich. Wobo gigas wurde in älterer Literatur als eine weitere, bis dato unbeschriebene Reticulomyxa-Art geführt.[1][17]
Weblinks
- Video: Bewegung, Nahrungsaufnahme und Fortpflanzung bei Reticulomyxa filosa. Institut für den Wissenschaftlichen Film (IWF) 1987, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.3203/IWF/C-1639.
Nachweise
- Norbert Hülsmann: Biology of the genus Reticulomyxa (Rhizopoda). In: Journal of Eukaryotic Microbiology, Bd. 31, 1984, S. 55a
- Norbert Hülsmann: Bewegung, Nahrungsaufnahme und Fortpflanzung bei Reticulomyxa filosa (Rhizopoda). Begleitpublikation zum Film C 1639, IWF Wissen und Medien gGmbH, 2006, ISSN 0073-8417
- Ruth N. Nauss: Reticulomyxa filosa gen. et spec. nov., a new primitive plasmodium. In: Bulletin of the Torrey Botanical Club, Bd. 76, 1949, S. 161–173
- Donald D. Orokos, Richard W. Cole, Jeffrey L. Travis: Organelles Are Transported on Sliding Microtubules in Reticulomyxa. In: Cell Motility and the Cytoskeleton, 2000, Bd. 47:4, S. 296–306
- Manfred Schliwa, Takashi Shimizu, Ron D. Vale, Ursula Euteneuer: Nucleotide Specificities of Anterograde and Retrograde Organelle Transport in Reticulomyxa Are Indistinguishable. In: Journal of Cell Biology, 1991, Bd. 112, No. 6, S. 1199–1203
- Ralf N. Breuker: Cytoskelettkomponenten des plasmodialen Rhizopoden Reticulomyxa filosa., 1997, Dissertation zur Erlangung des Grades eines Doktors der Naturwissenschaften der Abteilung für Biologie an der Ruhr-Universität Bochum, „Einleitung“, Online
- Ralf N. Breuker: Cytoskelettkomponenten des plasmodialen Rhizopoden Reticulomyxa filosa., 1997, Dissertation zur Erlangung des Grades eines Doktors der Naturwissenschaften der Abteilung für Biologie an der Ruhr-Universität Bochum, „Cystenbildung“, Online
- Ralf N. Breuker: Cytoskelettkomponenten des plasmodialen Rhizopoden Reticulomyxa filosa. 1997, Dissertation zur Erlangung des Grades eines Doktors der Naturwissenschaften der Abteilung für Biologie an der Ruhr-Universität Bochum, „Cysten und Ruhestadien“, Online
- Maria Holzmann, Andrea Habura, Hannah Giles, Samuel S. Bowser, Jan Pawlowski: Freshwater Foraminiferans Revealed by Analysis of Environmental DNA Samples. In: Journal of Eukaryotic Microbiology, 50(2), 2003, S. 135–139
- Jerome Flakowski, Ignacio Bolivar, Jose Fahrni, Jan Pawlowski: Actin Phylogeny Of Foraminifera. In: Journal of Foraminiferal Research, Bd. 35, Heft 2, S. 93–102, 2005
- John M. Archibald, David Longet, Jan Pawlowski, Patrick J. Keeling: A Novel Polyubiquitin Structure in Cercozoa and Foraminifera: Evidence for a New Eukaryotic Supergroup. In: Molecular Biology and Evolution, 20(1):62–66, 2003
- David Longet, John M. Archibald, Patrick J. Keeling and Jan Pawlowski: Foraminifera and Cercozoa share a common origin according to RNA polymerase II phylogenies. In: International Journal of Systematic and Evolutionary Microbiology (2003), 53, 1735–1739
- Gernot Glöckner, Norbert Hülsmann, Michael Schleicher, Angelika A. Noegel, Ludwig Eichinger, Christoph Gallinger, Jan Pawlowski, Roberto Sierra, Ursula Euteneuer, Loic Pillet, Ahmed Moustafa, Matthias Platzer, Marco Groth, Karol Szafranski, Manfred Schliwa (2014): The Genome of the Foraminiferan Reticulomyxa filosa. Current Biology Volume 24, Issue 1: p11–18. doi:10.1016/j.cub.2013.11.027
- Jan Pawlowski, Ignacio Bolivar, Jose F. Fahrni, Colomban De Vargas, Samuel S. Bowser: Molecular evidence that Reticulomyxa filosa is a freshwater naked foraminifer. In: Journal of Eukaryotic Microbiology, 1999, Bd. 46, S. 612–617
- David Longet, Jan Pawlowski: Higher-level phylogeny of Foraminifera inferred from the RNA polymerase II (RPB1) gene. In: European Journal of Protistology 43 (2007) 171–177
- Jan Pawlowski, Maria Holzmann, Cédric Berney, José Fahrni, Andrew J. Gooday, Tomas Cedhagen, Andrea Habura, Samuel S. Bowser: The evolution of early Foraminifera. In: Proceedings of the National Academy of Sciences, Bd. 100, No. 20, 2003, S. 11494–11498
- Norbert Hülsmann: Bewegung, Nahrungsaufnahme und Fortpflanzung bei Wobo gigas gen. et spec. nov. (Rhizopoda), Begleitpublikation zum Film C 1638, IWF Wissen und Medien gGmbH, 2006, ISSN 0073-8417