Acantharia
Die Acantharia, häufig auch Acantharea geschrieben, sind ein aus rund 140 Arten bestehendes Taxon einzelliger, eukaryotischer Lebewesen, die zu den Strahlentierchen (Radiolaria) gehören. Alle Arten leben im Meer als äußerst häufiger Teil des Zooplanktons in den obersten Meeresschichten. Sie weisen ein mathematisch regelmäßig gebautes Skelett aus dem Mineral Coelestin (=Strontiumsulfat) auf und haben große Bedeutung für den Strontiumkreislauf im Meer.
| Acantharia | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Acantharia-Arten | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Acantharia | ||||||||||||
| Haeckel, 1881 |
Ökologie, Biologie und insbesondere der Lebenszyklus der Tiere sind bisher nur unzureichend bekannt.
Merkmale
Acantharia sind kugelförmig oder länglich-rund, gelegentlich abgeflacht und haben einen Durchmesser von 0,05 bis 5 Millimeter.[1]
Skelett
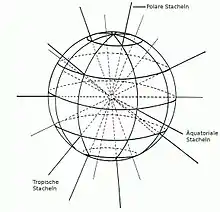
Die Zelle hat ein Skelett aus 20 (bei den Holacanthida 10) Stacheln, die aus monokristallinem, rhombischen Strontiumsulfat bestehen, einem unter den Protisten einzigartigen Baumaterial.[1]
Die stets gleiche Anordnung der Stacheln erfolgt mit mathematischer Regelmäßigkeit, aus der gedachten „Sphäre“ der runden Zelle treten die Spitzen der jeweiligen Viererreihen dann auf 60°N, 60°S, 30°N, 30°S und 0° geographischer Breite und 0°, 90°, 180° und 270° (polare bzw. äquatoriale Spitzen) bzw. 45°, 135°, 225° und 315° (tropische Spitzen) geographischer Länge hervor (siehe Abbildung).[1]
Diese Regelmäßigkeit erkannte erstmals Johannes Müller und formulierte sie 1858 im nach ihm benannten „Müller’schen Gesetz“:
„Man erhält daher […] für die Acanthometren mit 20 Stacheln dieselbe Formel, dass zwischen zwei stachellosen Polen 5 Gürtel von Stacheln stehen, jeder von 4 Stacheln, alle nach dem gemeinschaftlichen Centrum der ganzen Sphäre gerichtet, und dass die Stacheln jedes Gürtels mit dem vorhergehenden alterniren.[2]“
Zelle
Der Zellkörper besteht aus dem zentralen Endoplasma und dem peripheren Ektoplasma. Das den Zellkern und die meisten Organellen enthaltende Endoplasma ist meist braun, rot oder schwarz pigmentiert, bei allen Arten außer denen der Arthracantida ist die Konzentration des pigmentierten Endoplasmas im Zentrum besonders dicht, so wird die Zelle nach außen hin mit zunehmendem Anteil des transparenten Ektoplasmas immer klarer.[1]
Endo- und Ektoplasma werden durch eine Kapselwand getrennt, ein fibrilläres Geflecht, das Öffnungen für zytoplasmatische Ausstülpungen sowie die Axopodien aufweist. Bei den Arthracantida ist die Kapselwand deutlich dicker als bei den anderen Ordnungen, bei denen die Kapselwand teilweise kaum erkennbar ist.[1]
Als „Außenhaut“ des Ektoplasmas und so zugleich der gesamten Zelle dient der periplasmatische Cortex, ebenfalls ein fibrilläres Maschenwerk. Er besteht aus zwanzig mittels elastischer Verbindungsstücke miteinander verbundenen Polygonen, die jeweils um einen der Skelettstacheln angeordnet sind.[1]
Kapselwand und periplasmatischer Cortex liegen an den Stacheln aneinander an. Im schmalen Zwischenraum von Kapselwand und Cortex befinden sich die Myoneme, an der Kapselwand sowie dem Stachel verankerte fibrilläre Bündel aus Proteinen, die flach, bandförmig, kurz zylindrisch oder dreieckig und 5 bis 90 Mikrometer lang sind. Je nach Art finden sich zwischen 40 und 1200 Myoneme, also 2 bis 60 Stück je Stachel. Sie dienen als bewegungserzeugende Organellen und können drei Bewegungen auslösen: Eine langsame wellenförmige, dann eine schlagartige Kontraktion, die den periplasmatischen Cortex bis an die Spitze der Stachel drücken kann sowie eine langsame, nachfolgende Entspannung. Wenn ein Individuum alle Myoneme gleichzeitig aktiviert, führt das zu einer schlagartigen Vergrößerung des Zellvolumens. Diese alle zehn bis zwanzig Minuten beobachtbare Bewegung befördert wahrscheinlich den Auftrieb.[1]
Als Organellen finden sich im Endoplasma große Mitochondrien mit röhrenförmigen Cristae, ein raues endoplasmatisches Retikulum, Ribosomen, Dictyosomen, Peroxisomen sowie den Kinetozysten der Sonnentierchen ähnelnde Extrusome. Die Zellkerne sind normalerweise zahlreich vorhanden, klein und rund oder länglich-rund, die Ausnahme bilden einige Arten der Ordnung der Symphyacanthida mit einem einzelnen sehr großen und vermutlich polyploiden Kern.[1]
Bei fast allen Arten außer denen der Arthracanthida weist das Endoplasma mit zunehmendem Alter Lithosomen auf. Das sind kleine, ovale, doppelbrechende Plättchen, die vom Golgi-Apparat erzeugt werden. An die Zelloberfläche transportiert, wird aus ihnen im Rahmen der Enzystierung vor der Gametogenese die Außenhaut der Zyste gebildet, die Myoneme werden dabei abgesondert.[1]
Axopodien
Wie alle Strahlentierchen und auch die Sonnentierchen besitzen die Acantharia Axopodien, besonders lange, dünne und gerade Zellfortsätze, die aus der Zelloberfläche hervorstehen. Sie werden aus einer dünnen Zytoplasma-Schicht sowie der Zellmembran gebildet und durch eine spezielle Struktur aus bei Holacanthida dodekagonal, ansonsten hexagonal zu Axonemen angeordneten Mikrotubuli verfestigt, die kleinen, im Endoplasma gelegenen MTOCs entspringen. Im Zytoplasma sind Organellen wie Extrusome, Mitochondrien sowie verschiedene Typen von Vesikeln enthalten. Die Axopodien dienen dem Beutefang und reagieren auf Reize, sie ziehen sich bei chemischen wie physischen (Temperatur, Berührung) Reizen zurück und bauen sich dann langsam wieder auf.[1]
Lebenszyklus
Der Lebenszyklus der Acantharia ist nicht vollständig bekannt. Probleme bei der Beobachtung bereitet, dass man die Tiere unter Laborbedingungen weder kultivieren noch längere Zeit am Leben erhalten kann.[3]
Außer dem beschriebenen Trophontenstadium sind aus Einzelbeobachtungen frisch gefangener Tiere nur stark einskelettierte Zysten sowie Schwärmerstadien bekannt. Durch letztere werden zehntausende einkernige, begeißelte Schwärmer freigesetzt. Über andere Lebensstadien liegen keine Erkenntnisse vor. Allerdings konnte überraschenderweise in Tiefen unter 900 m, also deutlich unterhalb der Zone, in der Acantharia leben, sowohl in Proben des Wassers wie auch des Meeresbodens DNA von Acantharia nachgewiesen werden. Es wird vermutet, dass es sich hierbei um Spuren bisher unbekannter Lebensstadien der Acantharia handelt, da die Trophonten sich dort mikroskopisch nicht nachweisen lassen.[3]
Lebensweise
Verbreitung
Acantharia gehören zum sogenannten Zooplankton, sind also nicht selbst Photosynthese betreibende Teile des Planktons im Meer. Sie sind in allen Ozeanen weltweit verbreitet, insbesondere jedoch in tropischen und subtropischen Gewässern, nur zerstreut hingegen finden sie sich in gemäßigten oder gar polaren Breiten. Küstengebiete werden weitgehend gemieden, ebenso eutrophe Gewässer. Insbesondere aufgrund ihrer photosynthetisierenden Symbionten leben sie hauptsächlich in den lichtdurchfluteten wenigen hundert Metern nahe der Oberfläche, an ruhigen Tagen sammeln sich große Acantharia in umfangreichen Gruppen nur wenige Meter darunter. Die höchsten Bestandsdichten finden sich in 50 bis 200 Meter Meerestiefe, zum Zweck der Gametogenese lassen sich einige Arten jedoch in Tiefen von 300 bis 400 Meter sinken.[4] Selten fanden sich einige wenige Individuen auch mehrere tausend Meter tief auf dem Meeresboden.[1]
Klare saisonale Abhängigkeiten gibt es vermutlich nicht, einige Untersuchungen dazu erbrachten Häufungen in Frühling und Sommer, anderen Beobachtungen zufolge konnten im Frühling Häufungen beobachtet werden, im Sommer dagegen schienen sie seltener zu sein. In Küstenregionen konnten scheinbare saisonale Häufungen im Zusammenhang mit dem regelmäßig wiederkehrenden Austausch eutrophen Küstenwassers durch oligotrophes Wasser aus der offenen See festgestellt werden, in durchgängig oligotrophen Gewässern der Tropen und Subtropen sind sie ein ganzjährig häufiger Bestandteil des Mikroplanktons.[1]
Die Tiere sind in oberflächennahem Wasser sehr häufig, Stichproben im Nordatlantik ergaben für die oberen 20 Meter eine Dichte von bis zu 16 Exemplaren pro Liter, zwischen 40 und 120 Meter noch immer rund 10 Exemplare pro Liter. Damit sind sie rund 10- bis 16-mal häufiger als beispielsweise planktische Foraminiferen. Bei manchen Proben machten Acantharia mehr als 30, gelegentlich sogar mehr als 70 % aller Lebewesen der Probe aus.[5][4]
Beutefang
Mittels des sehr dynamisch sich verändernden und reizempfindlichen hohlraumreichen Netzwerks aus anastomosierenden Zytoplasmafortsätzen sowie mit den Axopodien werden vor allem Kleinstlebewesen wie Diatomeen, Silikoflagellaten, Coccolithophoriden und Tintinniden erbeutet, aber auch kleine Mollusken. Daneben konnten auch Spuren äußerst kleiner Beute wie Cyanobakterien oder anderer Bakterien nachgewiesen werden, unklar ist allerdings, ob diese Beute gezielt abgeweidet wird oder nur „Beifang“ darstellt.[1]
Zooxanthellen
Bei vielen Acantharia-Arten finden sich fakultativ Zooxanthellen als Symbionten, die den Acantharia durch ihre Photosynthese Energie liefern. Dabei weisen in den Beständen nur die größenmäßig mittleren rund 50 % aller Individuen Zooxanthellen auf, den jeweils größten wie den kleinsten Individuen fehlen sie. Alle Arthracanthida-Arten weisen sie jedoch in bestimmten Phasen des Lebenszyklus auf. Die Zooxanthellen fehlen bei Gamonten sowie jungen Trophonten. Sie werden während oder unmittelbar vor der Gametogenese aufgenommen, während des Trophonten-Stadiums nimmt ihre Zahl dann zu. Vor dem Erreichen des reproduktiven Stadiums werden sie aber abgestoßen.[1]
Bei den Zooxanthellen handelt es sich meist um Haptophyta oder Dinoflagellaten. In einem Wirt können dabei auch mehrere Symbionten-Arten gleichzeitig auftreten. Auch nahe der Oberfläche können sie weiterhin Kohlenstoff fixieren, teilweise in Mengen, die deutlich über dem Bedarf des Wirts liegen. Häufig finden sich im Endoplasma auch parasitierende Dinoflagellaten der Gattung Amoebophrya.[1]
Rolle im marinen Elementkreislauf
Da das von den Acantharia zum Skelettbau verwandte Strontiumsulfat wasserlöslich ist, müssen die Tiere kontinuierlich Material dazu aus dem Meerwasser aufnehmen. Mit ihrem Tod sinkt die Hülle herab und löst sich in Wasserschichten um 900 m rapide auf. Aufgrund der hohen Anzahl an Tieren findet so ein kontinuierlicher Transfer von Strontium aus höheren in tiefere Wasserschichten statt, so dass die höheren gegenüber den tieferen Schichten regelrecht mit Strontium abgereichert sind. Acantharia gelten daher als die wichtigste biologische Komponente des marinen Strontium-Kreislaufs. Ähnliches gilt – wenngleich in geringerer Menge – für das Element Barium, das rund 0,4 % der Skelette ausmacht. Während des Skelettbaus reichern Acantharia zusätzlich auch Spurenelemente wie Blei, Zink, Kupfer und Eisen in signifikanter Menge an und „transportieren“ sie ebenfalls per Auflösung des Skeletts in mittlere Meeresschichten.[6][4]
Systematik
Seit Ernst Haeckels monographischer Bearbeitung der Strahlentierchen anhand der Challenger-Funde 1887 galten die Acantharia als eine von drei Untergruppen der Radiolaria. Ihre genaue systematische Position war zeitweise umstritten. Wladimir Schewiakoff trennte sie 1926 ganz aus den Radiolaria heraus, diese Ansicht setzte sich aber nicht durch.[7]
Molekulargenetische Untersuchungen festigten die Zuordnung der Gruppe zu den Radiolaria. Auch die traditionelle Aufstellung als eigene Gruppe konnte im Wesentlichen bestätigt werden. Die innere Systematik der Gruppe gilt hingegen als nicht mehr haltbar und bedarf einer Revision.[8][3]
Die Gruppe umfasst nach traditioneller Klassifikation rund 140 Arten in 50 Gattungen und wird in 4 Ordnungen mit 18 Familien unterteilt. Als Merkmal zur Unterscheidung der vier Ordnungen dienen die unterschiedlichen Verbindungen der Stachelansätze:[9][1]
- Ordnung Arthracanthida
- Unterordnung Sphaenacantha
- Acanthometridae
- Dorataspidae
- Phractopeltidae
- Diploconidae
- Lithopteridae
- Hexalaspidae
- Unterordnung Phyllacantha
- Phyllostauridae
- Stauracanthidae
- Dictyacanthidae
- Unterordnung Sphaenacantha
- Ordnung Symphyacanthida
- Ordnung Chaunacanthida
- Ordnung Holacanthida
Fossilbericht
Da sich die mineralischen Skelette von Acantharia im Meerwasser schnell wieder auflösen, gibt es kaum Fossilien der Gruppe. Die wenigen erhaltenen Funde reichen nur bis ins Eozän zurück (Chiastolus amphicopium).[10]
Nachweise
- Colette Febvre, Jean Febvre, Anthony Michaels: Acantharia. In: John J. Lee, G. F. Leedale, P. Bradbury (Hrsg.): An Illustrated Guide to the Protozoa. Band 2. Allen, Lawrence 2000, ISBN 1-891276-23-9, S. 783–803.
- Johannes Müller: Über die Thalassicollen, Polycystinen und Acanthometren des Mittelmeeres, Abhandlungen der Königlichen Akademie der Wissenschaften zu Berlin, 1858, S. 12
- Ilana C. Gilga, Linda A. Amaral-Zettler, Peter D. Countwaya, Stefanie Moorthi, Astrid Schnetzer, David A.Caron: Phylogenetic Affiliations of Mesopelagic Acantharia and Acantharian-like Environmental 18S rRNA genes off the Southern California Coast. In: Protist, 2010, (zum Zugriffszeitpunkt in press), doi:10.1016/j.protis.2009.09.002
- Patrick De Deckker: On the celestite-secreting Acantharia and their effect on seawater strontium to calcium ratios. In: Hydrobiologia 517, S. 1–13, 2004
- Elsa Massera Bottazzi, Bruno Schreiber, Vaughan T. Bowen: Acantharia in the Atlantic Ocean, Their Abundance and Preservation. In: Limnology and Oceanography, Bd. 16, Nr. 4, S. 677–684, 1971
- G. W. Brass: Trace Elements in Acantharian Skeletons. In: Limnology and Oceanography, Bd. 25, Nr. 1, S. 146–149, 1980
- Stephane Polet, Cédric Berney, José Fahrni, Jan Pawlowski: Small-Subunit Ribosomal RNA Gene Sequences of Phaeodarea Challenge the Monophyly of Haeckel’s Radiolaria. In: Protist, Bd. 155, 2004, S. 53–63
- Jan Pawlowski, Fabien Burki: Untangling the Phylogeny of Amoeboid Protists. In: Journal of Eukaryotic Microbiology, 56:1, S. 16–25, 2009
- Klaus Hausmann, Norbert Hülsmann, Renate Radek: Protistology, 3. Aufl., Schweizerbart, 2003, S. 171, ISBN 3-510-65208-8
- Arthur Shackleton Campbell: Radiolaria. In: Treatise on Invertebrate Paleontology, Part D Protista 3 (Chiefly Radiolarians And Tintinnines), 1954, S. D30-D42