NaK (Legierung)
NaK ist die Bezeichnung für eine Legierung, die aus Natrium und Kalium besteht und ein Eutektikum bildet, d. h. die Gemische aus beiden Komponenten haben einen niedrigeren Schmelzpunkt als die der reinen Stoffe. Sie ist in einem weiten Konzentrationsbereich bei Raumtemperatur flüssig und ist gelegentlich zur Kühlung von Kernreaktoren verwendet worden.

Eigenschaften
Physikalische Eigenschaften
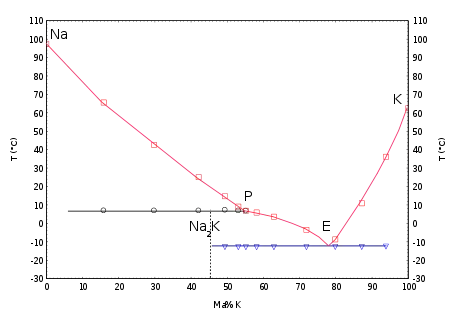
(Na: Natrium rein, K: Kalium rein, E: Eutektikum, P: Peritektikum, Blau: eutektische Mischung, Schwarz: Na2K, inkongruente Schmelze, Rot: Überschusskomponente)
NaK-Mischungen mit einem Kaliumgehalt von 45 % bis 89 % sind bei Raumtemperatur flüssig. Das Eutektikum liegt bei einer Konzentration von 22 % Natrium und 78 % Kalium vor. Es hat einen Schmelzpunkt von −11 °C und einen Siedepunkt von 785 °C.[2] Die Dichte der Legierung ist mit 0,866 g/cm³ (bei 21 °C) geringer als die von Wasser. Die Grenzflächenspannung ist sehr hoch, so dass die Flüssigkeit die Neigung hat, große Tropfen zu bilden. Die Wärmekapazität beträgt etwa ein Viertel jener des Wassers, die thermische Leitfähigkeit ist jedoch wesentlich größer.
Chemische Eigenschaften
NaK reagiert wie seine Bestandteile Natrium und Kalium sehr leicht mit Wasser und Sauerstoff. Bei Lagerung unter Luft bildet sich ein Belag aus gelbem Kaliumhyperoxid, der brandfördernd ist. Da es aus Alkalimetallen besteht, wirkt es stark reduzierend.
Weitere Legierungen
Weitere sehr niedrige Schmelztemperaturen haben Cs77K23 mit −37,5 °C, Cs95Na5 mit −30 °C und Na8Rb92 mit −5 °C. Die Legierung aus 11,8 % Natrium, 47,4 % Kalium und 40,8 % Cäsium hat mit −79,4 °C eine noch niedrigere Schmelztemperatur.
Herstellung
Industriell wird NaK durch Destillation hergestellt.[3] Hierbei werden flüssiges Natrium und Kaliumchlorid einer Destillationskolonne kontinuierlich zugeführt. In der Reaktionszone reagiert das Kaliumchlorid mit dem Natrium, so dass Natriumchlorid und Kalium entstehen. Im darüberliegenden Verstärkungsteil der Kolonne wird das leichtersiedende Kalium angereichert und über Kopf als Gemisch mit Natrium in beliebiger Konzentration abgezogen.
Verwendung
Kühlmittel in Kernreaktoren
NaK kann zur Kühlung von mit schnellen Neutronen arbeitenden Kernreaktoren dienen. Der niedrige Schmelzpunkt erübrigt eine externe Heizung zum Flüssighalten des Kühlmittels, wenn der Reaktor abgeschaltet ist. Die sowjetischen RORSAT-Satelliten nutzten als Energiequelle einen Kernreaktor mit NaK-Kühlung.
Chemische Verfahren
NaK kann als Katalysator in verschiedenen Reaktionen eingesetzt werden, wie z. B. bei der Herstellung von Ibuprofen. Bei der Vermischung mit Wasser entsteht Wasserstoff (Wasserspaltung).[4]
Trocknungsmittel
Aufgrund der hohen Reaktivität mit Wasser und des flüssigen Zustandes kann NaK als Entwässerungsmittel eingesetzt werden, um Restfeuchte aus Lösemitteln, wie Ether z. B. Tetrahydrofuran, abzutrennen.
Einzelnachweise
- G.L.C.M. van Rossen, H. van Bleiswijk: Über das Zustandsdiagramm der Kalium-Natriumlegierungen, in: Z. anorg. allg. Chem., 1912, 74, S. 152–156. doi:10.1002/zaac.19120740115
- MSDS (PDF; 21 kB) Callery Chemical Company, 3. Januar 2000
- Jackson, C.B.; Werner, R.C.: The Manufacture of Potassium and NaK In: Advances in Chemistry, Vol. 19, January 1, 1957 doi:10.1021/ba-1957-0019.ch018
- Manfred Klell, Helmut Eichlseder, Alexander Trattner: Wasserstoff in der Fahrzeugtechnik: Erzeugung, Speicherung, Anwendung, Springer-Verlag 2018, 324 Seiten, Seite 103