Diamantan
Diamantan (auch Congressan) ist eine Kohlenwasserstoff-Verbindung der organischen Chemie, die der Gruppe der Diamantoide zugeordnet ist. Wie alle Diamantoide hat es eine käfigartige Struktur, die sich im Kristallgitter eines Diamanten wiederfinden lässt. Aufgrund dieser besonderen Struktur ist der farblose Feststoff ein Forschungsgegenstand der Chemie.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
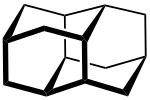 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Diamantan | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C14H20 | ||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 188,31 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,21 g·cm−3 (bei Normalbedingungen)[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
272 °C[4] | ||||||||||||
| Löslichkeit |
| ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte
Adamantan wurde 1933 als einfachstes Diamantoid von dem slowakischen Chemiker Stanislav Landa entdeckt und faszinierte einige Chemiker aufgrund seiner besonderen käfigartigen Struktur. Dazu gehörte auch der Schweizer Chemiker Vladimir Prelog, dem die Synthese von Adamantan 1944 erstmals gelang.[8] Er machte die Struktur eines C14-Körpers, der sich im Diamantenkristallgitter finden lässt und zwei Adamantan-Einheiten enthält, zum Emblem des 19. IUPAC-Kongresses im Jahre 1963. Da diese Verbindung zu diesem Zeitpunkt unbekannt war, wurde sie zunächst Congressan genannt.[9] Auf der Konferenz wurde zur Synthese des Congressans aufgerufen.[10]
Chris Cupas, Paul von Ragué Schleyer und David J. Trecker synthetisierten Congressan 1965 mit einer Ausbeute von 1 % erstmals – durch Isomerisierung eines Gemisches von Norbornen-[2+2]-Dimeren unter katalytischer Wirkung von Aluminiumchlorid.[11] Ein Jahr später wurde eine weitere organische Verbindung mit drei Adamantan-Bausteinen gefunden, woraufhin diese adamantolgen Verbindungen der neuen Gruppe der Diamantoide zugeordnet wurden. Für die Vertreter dieser Gruppe wurde eine einfache, allgemeingültige Nomenklatur entwickelt:[12]
- Adamantan
- Congressan (mit zwei Adamantan-Bausteinen) wurde in Diamantan umbenannt.
- Die neue Verbindung mit drei Adamantan-Bausteinen wurde Triamantan genannt.
- usw.
1966 wurde Diamantan erstmals aus Erdöl isoliert.[13] Im selben Jahr wurde eine neue Synthesevariante entwickelt, durch die Diamantan mit einer Ausbeute von 10 % gebildet werden kann.[10] 1970 gelang es schließlich Diamantan in ausreichend großer Menge zu synthetisieren,[14] sodass der Stoff ab diesem Zeitpunkt einfacher erforscht werden konnte.
Vorkommen
Diamantan kommt hauptsächlich im unverarbeiteten Erdöl sowie in Gaskondensaten vor. Es wird vermutet, dass der Stoff im natürlichen Prozess der Katagenese entsteht.[15][16]
Gewinnung und Darstellung
Aufgrund seiner besonders großen thermischen Stabilität kann Diamantan beim Hydrocracken vom Erdöl zu Erdgas isoliert werden.[15] Nach einem Verfahren von Paul von Ragué Schleyer kann Diamantan durch die Umlagerung von verschiedenen pentacyclischen Tetradecanen unter der katalytischen Wirkung von Lewis-Säuren dargestellt werden. Es hat sich herausgestellt, dass die Diamantan-Synthese über hydriertes Binor-S (3a,3b) am besten geeignet ist. Hier werden ca. 70 % Diamantan erhalten.[10]
Die Synthese beginnt mit der Herstellung von Binor-S (Heptacyclo[8.4.0.02,12.03,7.04,6.05,9.011,13]tetradecan, 2) durch Dimerisierung von Norbornadien (1) unter katalytischer Wirkung von Cobaltbromid-Triphenylphosphin und Bortrifluoriddiethyletherat. Im nächsten Schritt erfolgt die Hydrierung zu Tetrahydro-Binor-S-Isomeren (3a–3d) unter Verwendung einer Lösung aus Eisessig und Salzsäure mit einem Platin(IV)-oxid-Katalysator in einer Wasserstoff-Umgebung. Aus sterischen Gründen bilden sich dabei hauptsächlich die Isomere 3a und 3b. Unter der katalytischen Wirkung von Aluminiumbromid in Cyclohexan oder Kohlenstoffdisulfid kommt es zu einer Umlagerung, bei der das Hauptprodukt Diamantan (4) gebildet wird. Die Ausbeute beträgt hier ca. 70 %.[10][14][17]
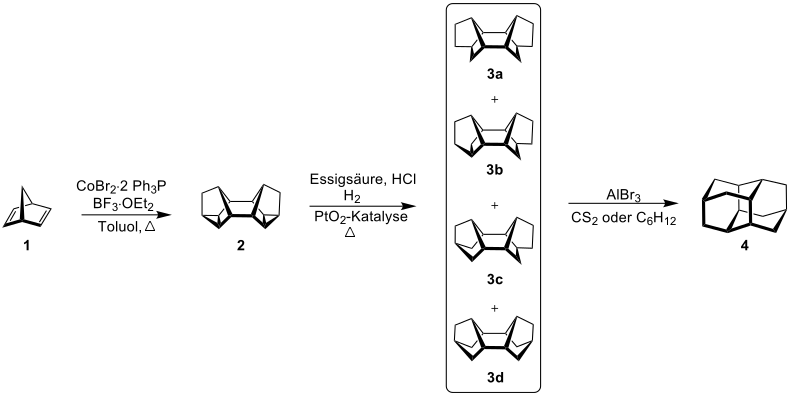
Eigenschaften
Wie es bei den Diamantoiden bekannt ist, lassen sich ihre Strukturen als Untereinheiten im Diamanten-Kristallgitter wiederfinden. Dies gilt auch für Diamantan:
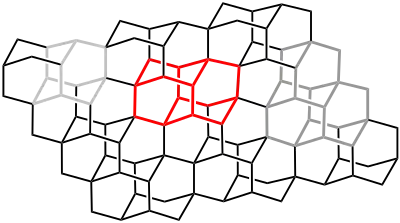
Aus dieser besonderen Struktur resultiert ein – im Vergleich zu anderen Kohlenwasserstoffen – hoher Schmelzpunkt von 244 °C sowie eine beträchtliche chemische und thermische Stabilität.
| Standardbildungsenthalpie | Quelle |
|---|---|
| [18] | |
| [18] |
Derivate des reaktionsträgen Diamantans können leicht hergestellt werden, indem z. B. eine Lösung des hydrierten Binor-S (3a,3b) mit Aluminiumchlorid und Dichlormethan erhitzt und nach einigen Stunden mit Acetylchlorid versetzt wird. Das Resultat sind 1-Chlordiamantan (5) und 4-Chlordiamantan (6), die im Verhältnis 1:1 entstehen. Durch Hydrolyse werden die jeweiligen Alkohole gebildet.[19]
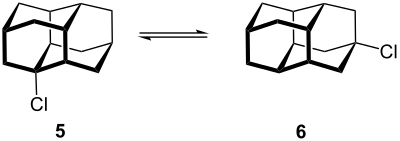
Verwendung
Das Anwendungsgebiet von Diamantan ist vielfältig, weil es u. a. chemisch und thermisch stabil ist, die physikalischen Eigenschaften bei hohen Temperaturen beibehält und sich gut in organischen Lösungsmitteln löst. So wird Diamantan dafür genutzt, um die thermische Stabilität von Polymeren zu verbessern und um duroplastische Harze herzustellen. In der Nanotechnologie sind Diamantoide (z. B. Adamantan und Diamantan), wegen ihrer geringen Größe und ihrer Eigenschaften wichtige molekulare Bausteine. Auch in der Entwicklung von Medikamenten sowie des Drug Targetings spielen Diamantoide eine große Rolle. Als Beispiel sei hier 1,6-Diamindiamantan genannt, welches Anti-Tumor-Aktivität und antibakterielle Aktivität aufweist.[2]
Einzelnachweise
- Eintrag zu Diamantane bei TCI Europe, abgerufen am 5. Juni 2017.
- G. A. Mansoori: Diamondoid Molecules. In: Advances in Chemical Physics. Band 136, 2007, S. 207–258; (PDF)
- P. R. Schreiner, L. V. Chernish, P. A. Gunchenko, E. Y. Tikhonchuk, H. Hausmann, M. Serafin, S. Schlecht, J. E. P. Dahl, R. M. K. Carlson, A. A. Fokin: Overcoming lability of extremely long alkane carbon-carbon bonds through dispersion forces. In: Nature. Band 477, Nr. 7364, 2011, S. 308–311, doi:10.1038/nature10367.
- W. S. Wingert: G.c.-m.s. analysis of hydrocarbons in Smackover petroleums. In: Fuel, Band 71, Nr. 1, 1992, S. 37–43, doi:10.1016/0016-2361(92)90190-Y.
- Y. C. Chan, K. K. H. Choy, A. H. C. Chan, K. M. Ng, S. Liu, S. F. Sciamanna, J. E. Dahl, R. M. K. Carlson: Solubility of Diamantane, Triamantane, Tetramantane, and Their Derivatives in Organic Solvents. In: Journal of Chemical & Engineering Data. Band 53, Nr. 8, 2008, S. 1767–1771, doi:10.1021/je800277a.
- P. Karasek, J. Planeta, M. Roth: Solubilities of Adamantane and Diamantane in Pressurized Hot Water. In: Journal of Chemical & Engineering Data. Band 53, Nr. 3, S. 816–819, doi:10.1021/je700709m.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- V. Prelog, R. Seiwerth: Über die Synthese des Adamantas. In: Berichte der deutschen chemischen Gesellschaft. Band 74, Nr. 10, 1941, S. 1644–1648, doi:10.1002/cber.19410741004.
- V. Prelog: Conformation and reactivity of medium-sized ring compounds. In: Pure and Applied Chemistry. Band 6, Nr. 4, 1963, S. 545–560, doi:10.1351/pac196306040545.
- T. M. Gund, E. Osawa, W. Van Zandt Jr., P. v. R. Schleyer: Diamantane. 1. Preparation of Diamantane. Physical and Spectral Properties. In: Journal of Organic Chemistry. Band 39, Nr. 20, 1974, S. 2979–2987, doi:10.1021/jo00934a009.
- C. Cupas, P. v. R. Schleyer, D. J. Trecker: Congressane. In: Journal of the American Chemical Society. Band 87, Nr. 4, 1965, S. 917–918, doi:10.1021/ja01082a042.
- B. C. Anderson, O. Vogl, D. M. Simons: Synthesis of Hexaoxadiamantanes. In: Tetrahedron Letters. Band 7, Nr. 4, 1966, S. 415–418, doi:10.1016/S0040-4039(00)72956-X.
- S. Hála, S. Landa, V. Hanuš: Isolierung von Tetracyclo[6.3.1.02,6.05,10]dodecan und Pentacyclo[7.3.1.14,12.02,7.06,11]tetradecan (Diamantan) aus Erdöl. In: Angewandte Chemie, Band 78, Nr. 23, 1966, S. 1060–1061, doi:10.1002/ange.19660782309.
- T. M. Gund, E. Osawa, W. Van Zandt Jr., P. v. R. Schleyer: A Convenient, High-Yield Preparation of Diamantane (Congressane). In: Tetrahedron Letters. 1970, Band 11, Nr. 44, S. 3877–3880, doi:10.1016/S0040-4039(01)98613-7.
- J. E. Dahl, J. M. Moldowan, K. E. Peters, G. E. Claypool, M. A. Rooney, M. E. Michael, M. R. Mello, M. L. Kohnen: Diamondoid hydrocarbons as indicators of natural oil cracking. In: Nature. Band 399, 1999, S. 54–57, doi:10.1038/19953.
- A. I. A. Petrov, O. A. Arefjey, Z. V. Yakubson: Hydrocarbons of Adamantane Series as Indices of Petroleum Catagensis Process. In: Advances in Organic Geochemistry 1973 – Actes du 6e Congrès International de Geochimie Organique 18–21 Septembre 1973 Rueil-Malmaison. Éditions Technips, Paris 1974, ISBN 2-7108-0258-9, S. 517–522.
- T. M. Gund, W. Thielecke, P. v. R. Schleyer: Diamantane: PENTACYCLO[7.3.1.14,12.02,7.06,11]TETRADECANE[Butanetetraylnaphthalene, 3,5,1,7-[1,2,3,4]-decahydro-]. In: Organic Synthesis, Band 53, 1973, S. 30, doi:10.15227/orgsyn.053.0030.
- T. Clark, T. M. Knox, M. A. McKervey, H. Mackle, J. J. Rooney: Thermochemistry of bridged-ring substances. Enthalpies of formation of some diamondoid hydrocarbons and of perhydroquinacene. Comparisons with data from empirical force field calculations. In: Journal of the American Chemical Society. Band 101, Nr. 9, 1979, S. 2404–2410, doi:10.1021/ja00503a028.
- T. Courtney, D. E. Johnston, M. A. McKervey, J. J. Rooney: The Chemistry of Diamantane. Part 1. Synthesis and Some Functionalisation Reactions. In: Journal of the Chemical Society. 1972, S. 2691–2696, doi:10.1039/P19720002691.