Cyclohexylbenzol
Cyclohexylbenzol ist eine cycloaliphatisch-aromatische Verbindung, bei der ein Cyclohexan- mit einem Benzolring verknüpft ist. Die Verbindung wird als hochsiedendes Lösungsmittel, als Wärmeträgerflüssigkeit, als Additiv für Lithium-Ionen-Akkumulatoren, sowie als Molekülbaustein für Flüssigkristalle eingesetzt. Phenylcyclohexan wurde intensiv als industrielle Alternative zu Cumol in der Hockschen Phenol-Synthese als Ausgangsstoff für Phenol und Cyclohexanon bearbeitet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
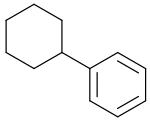 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cyclohexylbenzol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H16 | ||||||||||||||||||
| Kurzbeschreibung |
klare farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 160,26 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[2] und Glycerin[3], löslich in Ethanol und Diethylether[2], in Aceton, Benzol, Hexan, Xylol und Tetrachlorkohlenstoff[3] | ||||||||||||||||||
| Brechungsindex |
1,5329 (20 °C, 589 nm)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
Zur Darstellung von Phenylcyclohexan wurden seit Beginn des letzten Jahrhunderts zahlreiche Labormethoden publiziert, wie z. B. durch Friedel-Crafts-Alkylierung von Benzol mit Cyclohexylchlorid unter Katalyse mit Aluminiumchlorid.[6] Synthese und Eigenschaften von Cyclohexylbenzol durch (partielle) Hydrierung von Biphenyl wurden bereits 1903 beschrieben.[4]
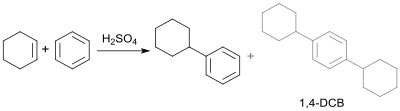
Als Nebenprodukt entsteht 1,4-Dicyclohexylbenzol (1,4-DCB)[7] durch zweifache Alkylierung des Benzols.
Für Laboransätze eignet sich eine Vorschrift aus Organic Syntheses, nach der Cyclohexen mit Benzol in Gegenwart von konzentrierter Schwefelsäure mit Ausbeuten von 65 bis 68 % zu Cyclohexylbenzol (CHB) reagiert.[8]
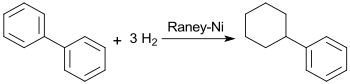
Nach einer modernen Prozessvorschrift[9] wird Cyclohexylbenzol bei der Hydrierung von Biphenyl mit Raney-Nickel mit Ausbeuten von über 98 % erhalten.
Bei der von ExxonMobil[10][11] intensiv betriebenen Suche nach Alternativen zum Cumolhydroperoxid-Verfahren zur Herstellung von Phenol wurde Cyclohexylbenzol als potentieller Ausgangsstoff identifiziert. Friedel-Crafts-Alkylierung von Benzol unter hydrierenden Bedingungen mit intermediär entstehendem Cyclohexen (auch als Hydroalkylierung bezeichnet) in Gegenwart von sauren Zeolithen vom MCM-22-Typ[12] liefert in einem kontinuierlichen Prozess Cyclohexylbenzol in brauchbaren Selektivitäten und Ausbeuten.
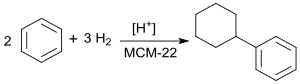
Tatsächlich entsteht ein komplexes Stoffgemisch, das als Nebenprodukte Cyclohexan, 1,4-Dicyclohexylbenzol (1,4-DCB) durch zweifache Alkylierung, sowie Bicyclohexyl[13] durch Hydrierung des Zielprodukts enthält. Außerdem erschweren Verunreinigungen wie u. a. Methylcyclopentan und Methylcyclopentylbenzol, die aus dem Stoffgemisch wegen geringer Siedepunktsunterschiede nur schwer abtrennbar sind, die destillative Aufarbeitung.
Eigenschaften
Cyclohexylbenzol ist eine farblose, ölige Flüssigkeit von angenehmem Geruch, die sich in vielen organischen Lösungsmitteln, aber praktisch nicht in Wasser löst.[3]
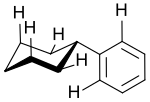
Anhand von 1H-NMR-spektroskopischen Untersuchungen konnte gezeigt werden, dass das äquatorial-parallele Konformer, bei dem die Ebene des Benzolrings quasi das Cyclohexanmolekül halbiert, die stabilste Form des Cyxlohexylbenzols ist.[14]
Anwendungen
Cyclohexylbenzol eignet sich als unpolares und hochsiedendes organisches Lösungsmittel und als thermisch bis 330 °C beständige Wärmeträgerflüssigkeit, die als technisches Produkt noch < 10 % des bei vollständiger Hydrierung von CHB entstehenden Bicyclohexyls enthält.[15] Phenylcyclohexan wirkt als Elektrolytzusatz in Lithium-Ionen-Akkumulatoren zum Schutz vor Überladung der Batterie.[16]
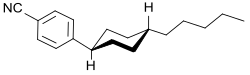
Die Phenylcyclohexylgruppe ist ein wesentliches Strukturelement der pharmakologisch aktiven Arylcyclohexylamine und von meist nematischen Flüssigkristallen (engl. Liquid Crystals, LC), die in 4- und 4‘-Stellung unterschiedliche Substituenten tragen können. Eine typische Verbindung ist 4-(trans-4-Pentylcyclohexyl)-benzontril (61204-01-1)[17], die in vielen LC-Mischungen Verwendung findet.[18]
Die Standardroute zur Massenchemikalie Phenol ist das von Heinrich Hock entwickelte Cumolhydroperoxid-Verfahren, das pro Tonne Phenol jeweils knapp 0,6 Tonnen des Koppelprodukts Aceton liefert.[19] Da die Nachfrage nach Aceton meist unter dem Angebot liegt und durch Verfahrensumstellungen, z. B. für Methylmethacrylat, weiter rückläufig ist, wurde bereits seit den 1980er-Jahren nach Alternativprozessen für Phenol unter Vermeidung von Aceton geforscht. Eine naheliegende Alternative als Ausgangsstoff stellt Phenylcyclohexan dar, dessen Hydroperoxid bei der sauren Spaltung Phenol und Cyclohexanon liefert. Cyclohexanon wird als Lösungsmittel und Ausgangsmaterial für Adipinsäure und Caprolactam, dem Monomer für Polyamid 6 benötigt.
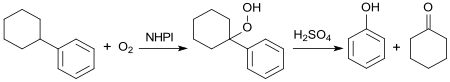
Das CHB-Hydroperoxidverfahren hat wegen der aufwendigen Reinigung des bei der Hydroalkylierung von Benzol zum Cyclohexylbenzol anfallenden Stoffgemischs bisher im industriellen Maßstab noch keine technische Nutzung gefunden.
Einzelnachweise
- Eintrag zu Phenylcyclohexane bei TCI Europe, abgerufen am 2. Januar 2022.
- William M. Haynes: CRC Handbook of Chemistry and Physics, 93th Edition. CRC Press, Boca Raton, FL, U.S.A. 2012, ISBN 978-1-4398-8050-0, S. 3–136.
- Michael D. Larrañaga, Richard J. Lewis, Sr., Robert A. Lewis: Hawley’s Condensed Chemical Dictionary, 16th Edition. John Wiley & Sons, Inc., Hoboken, NJ, U.S.A. 2016, ISBN 978-1-118-13515-0, S. 1063.
- J.F. Eijkman: Over einiger gehydreerde cyclische koolwaterstoffen. In: Chem. Weekblad. Band 1, Nr. 1, 1903, S. 7–12 (rug.nl).
- Datenblatt Phenylcyclohexane bei Sigma-Aldrich, abgerufen am 2. Januar 2022 (PDF).
- N. Kursanoff: Phenylirte Naphtene. Ueber das Phenylcyklohexan und einige seiner Derivate. In: Liebigs Ann. Chem. Band 318, Nr. 2–3, 1901, S. 309–326, doi:10.1002/jlac.19013180206.
- Externe Identifikatoren von bzw. Datenbank-Links zu p-dicyclohexylbenzene: CAS-Nummer: 1087-02-1, EG-Nummer: 214-121-3, ECHA-InfoCard: 100.012.838, PubChem: 70664, ChemSpider: 63830, Wikidata: Q27273626.
- B.B. Corson, V.N. Ipatieff: Cyclohexylbenzene In: Organic Syntheses. 19, 1939, S. 36, doi:10.15227/orgsyn.019.0036; Coll. Vol. 2, 1943, S. 151 (PDF).
- Patent WO2014053344: Verfahren zur Herstellung von Phenylcyclohexan. Angemeldet am 23. September 2012, veröffentlicht am 10. April 2014, Anmelder: BASF SE, Erfinder: M. Bock.
- Patent US8519194B2: Process for producing cyclohexylbenzene. Angemeldet am 24. November 2009, veröffentlicht am 27. August 2013, Anmelder: ExxonMobil Chemical Patents Inc., Erfinder: T.-J. Chen, F.M. Benitez, J.S. Buchanan, J.C. Cheng, J.E. Stanat.
- Patent US9108893B2: Process for producing cyclohexylbenzene. Angemeldet am 5. September 2012, veröffentlicht am 18. August 2015, Anmelder: ExxonMobil Chemical Patents Inc., Erfinder: H. Nair, C.L. Becker, J.R. Lattner, J.M. Dakka.
- S.L. Lawton, A.S. Fung, G.J. Kennedy, L.B. Alemany, C.D. Chang, G.H. Hatzikos, D.N. Lissy, M.K. Rubin, H.-K.C. Timken, S. Steuernagel, D.E. Woessner: Zeolite MCM-49: A three-dimensional MCM-22 analogue synthesized by in situ crystallization. In: J. Phys. Chem. Band 110, Nr. 9, 1996, S. 3788–3798, doi:10.1021/jp952871e.
- Externe Identifikatoren von bzw. Datenbank-Links zu Bicyclohexyl: CAS-Nummer: 92-51-3, EG-Nummer: 202-161-4, ECHA-InfoCard: 100.001.966, PubChem: 7094, ChemSpider: 6827, Wikidata: Q21099094.
- T. Schaefer, C. Beaulieu, R. Sebastian: 2-Phenyladamantane as a model for axial phenylcyclohexane. 1H NMR and molecular orbital studies of motion about the Csp2 – Csp3 bond. In: Can. J. Chem. Band 69, Nr. 3, 1991, S. 503–508, doi:10.1139/v91-075.
- Therminol® VP-3 – heat transfer fluid. Eastman, August 2020, abgerufen am 7. Januar 2022.
- N. Iwayasu, H. Honbou, T. Horiba: Overcharge protection effect and reaction mechanism of cyclohexylbenzene for lithium ion batteries. In: J. Power Sources. Band 196, Nr. 8, 2011, S. 3881–3886, doi:10.1016/j.jpowsour.2010.12.082.
- R. Eidenschink, D. Erdmann, J. Krause, L. Pohl: Substituierte Phenylcyclohexane – eine neue Klasse flüssigkristalliner Verbindungen. In: Angew. Chem. Band 89, Nr. 2, 1977, S. 103–103, doi:10.1002/ange.19770890208.
- S.M. Kelly, M. O‘Neill: Handbook of Advanced Electronic and Photonic Materials and Devices, Volume 7: Liquid Crystals, Display and Laser Materials, Chapter 1: Liquid crystals for electro-optic applications, 1st Edition. Academic Press, London 2000, ISBN 978-0-12-513745-4, S. 1–66 (elsevier.com [PDF]).
- Phenol. The Essential Chemical Industry - online, 17. Januar 2017, abgerufen am 8. Januar 2022.

