Arylcyclohexylamine
Arylcyclohexylamine, auch bekannt als Arylcyclohexamine oder Arylcyclohexanamine, sind eine chemische Klasse von (experimentellen) Arzneimitteln und Designerdrogen.
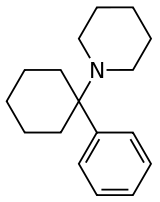
Geschichte
Es wird angenommen, dass Phencyclidin (PCP) das erste entdeckte Arylcyclohexylamin mit anerkannten anästhetischen Eigenschaften ist. In der wissenschaftlichen Literatur wurden jedoch mehrere Arylcyclohexylamine vor PCP beschrieben, beginnend mit PCA (1-Phenylcyclohexan-1-amin), dessen Synthese erstmals 1907 veröffentlicht wurde. Eticyclidin (PCE) wurde 1953 und PCMo 1954 entdeckt, wobei die letztere Verbindung als starkes Beruhigungsmittel beschrieben wurde. Arylcyclohexylamin-Anästhetika wurden bei Parke-Davis intensiv untersucht, beginnend mit der Synthese von PCP und später der verwandten Verbindung Ketamin im Jahr 1956.[1] In den 1970er Jahren wurden diese Verbindungen, insbesondere PCP und seine Analoga, aufgrund ihrer dissoziativen, halluzinogenen und euphorisierenden Wirkung als illegale Drogen konsumiert. Seitdem wurde die Stoffgruppe durch wissenschaftliche Forschung zu Stimulanzien, Analgetika und Neuroprotektiva sowie durch Chemiker auf der Suche nach neuartigen Freizeitdrogen erweitert.[2][3]
Struktur
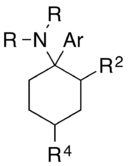
Ein Arylcyclohexylamin besteht aus einem Cyclohexylamin, das geminal zur Aminogruppe mit einer Arylgruppe substituiert ist. In den einfachsten Fällen ist die Aryleinheit ein Phenylring, gegebenenfalls mit zusätzlichen Substituenten.
Die Aminogruppe ist normalerweise nicht primär; die häufigsten N-Substituenten bei den sekundären Amine sind die Methyl- oder Ethylgruppe und bei den tertiären Aminen handelt es sich meist um Piperidin- und Pyrrolidinderivate.
Pharmakologie und Pharmakodynamik
Arylcyclohexylamine besitzen unterschiedlich NMDA-Rezeptor-antagonistische,[4][5] Dopamin-Wiederaufnahmehemmende,[6] und μ-Opioidrezeptor-agonistische Eigenschaften.[7] Zusätzlich wirken sie am Sigma-Rezeptor agonistisch,[8] an Nikotinrezeptoren antagonistisch,[9] und an Dopamin D2-Rezeptoren agonistisch.[10] Je nach Wirkstoffe wurden eine unterschiedliche pharmakologische Wirkungen beobachtet. Der Antagonismus des NMDA-Rezeptors verleiht anästhetische, krampflösende, neuroprotektive und dissoziative Wirkungen; die Blockade des Dopamintransporters vermittelt stimulierende und euphorisierende Wirkungen sowie Psychosen in hohen Dosen; und die Aktivierung des μ-Opioidrezeptors verursacht analgetische und euphorisierende Wirkungen. Die Stimulation der σ- und D2-Rezeptoren kann auch zu halluzinogenen und psychotomimetischen Wirkungen beitragen.
Arylcyclohexylamine sind vielseitige Wirkstoffe mit einem breiten Spektrum möglicher pharmakologischer Wirkungen, je nach Umfang und Bereich, in dem Strukturchemische Modifikationen durchgeführt wurden.[11][12][13][14][15][16][17][18][19] Die verschiedenen Modifikationsmöglichkeiten der chemischen Struktur ermöglichen eine "Feinabstimmung" des resultierenden pharmakologischen und pharmakodynamischen Profils. z. B. ist Benocyclidin (BTCP) ein selektiver Dopamin-Wiederaufnahmehemmer,[6] PCP ist hauptsächlich ein NMDA-Antagonist,[4] und Bromadol (BDPC) ist ein starker μ-Opioid-Agonist,[20] während PRE-084 ein selektiver Sigma-Rezeptor-Agonist ist.[21] Somit ist durch unterschiedliche Strukturkombinationen eine radikal unterschiedliche Pharmakologie und Pharmakodynamik möglich.
Liste der Arylcyclohexylamine
| Struktur | Verbindung | Arylgruppe | Amingruppe | Cyclohexylring |
|---|---|---|---|---|
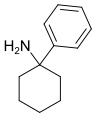 |
PCA[22] | Phenyl | NH2 | - |
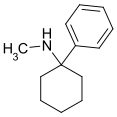 |
PCM | Phenyl | Methylamin | - |
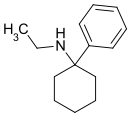 |
Eticyclidin | Phenyl | Ethylamin | - |
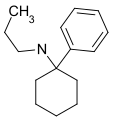 |
PCPr[23] | Phenyl | n-Propylamin | - |
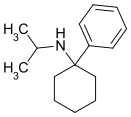 |
PCiP | Phenyl | Isopropylamin | - |
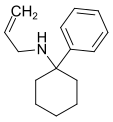 |
PCAL[24] | Phenyl | Allylamin | - |
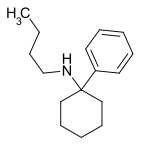 |
PCBu | Phenyl | n-Butylamin | - |
-1-phenylcyclohexylamine.svg.png.webp) |
PCEOH | Phenyl | Hydroxyethylamin | - |
-1-phenylcyclohexylamine.svg.png.webp) |
PCMEA[25] | Phenyl | Methoxyethylamin | - |
-1-phenylcyclohexylamine.svg.png.webp) |
PCEEA | Phenyl | Ethoxyethylamin | - |
-1-phenylcyclohexylamine.svg.png.webp) |
PCMPA | Phenyl | Methoxypropylamin | - |
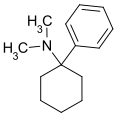 |
PCDM | Phenyl | Dimethylamin | - |
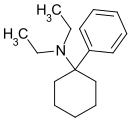 |
Dieticyclidin | Phenyl | Diethylamin | - |
cyclohexanol.svg.png.webp) |
2-HO-PCP[4] | Phenyl | Piperidin | 2-Hydroxy |
piperidine.svg.png.webp) |
2-Me-PCP[26] | Phenyl | Piperidin | 2-Methyl |
piperidine.svg.png.webp) |
2-MeO-PCP[27] | Phenyl | Piperidin | 2-Methoxy |
cyclohexanone.svg.png.webp) |
2-Keto-PCP | Phenyl | Piperidin | 2-Oxo |
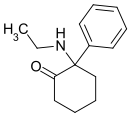 |
Eticyclidon ("O-PCE") | Phenyl | Ethylamin | 2-Oxo |
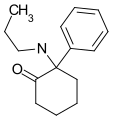 |
2-Keto-PCPr | Phenyl | n-Propylamin | 2-Oxo |
piperidine.svg.png.webp) |
4-Methyl-PCP | Phenyl | Piperidin | 4-Methyl |
cyclohexanone.svg.png.webp) |
4-Keto-PCP | Phenyl | Piperidin | 4-Oxo |
cyclohexyl)piperidine.svg.png.webp) |
2'-Cl-PCP | o-Chlorophenyl | Piperidin | - |
cyclohexyl)piperidine.svg.png.webp) |
2'-MeO-PCP | o-Methoxyphenyl | Piperidin | - |
cyclohexyl)piperidine.svg.png.webp) |
3'-F-PCP[28] | m-Fluorophenyl | Piperidin | - |
cyclohexyl)piperidine.svg.png.webp) |
3'-Me-PCP[29] | m-Tolyl | Piperidin | - |
cyclohexyl)pyrrolidine.svg.png.webp) |
3'-Me-PCPy | m-Tolyl | Pyrrolidin | - |
cyclohexyl)piperidine.svg.png.webp) |
3'-NH2-PCP | m-Aminophenyl | Piperidin | - |
cyclohexyl)piperidine.svg.png.webp) |
3'-HO-PCP | m-Hydroxyphenyl | Piperidin | - |
cyclohexyl)piperidine.svg.png.webp) |
3'-MeO-PCP | m-Methoxyphenyl | Piperidin | - |
cyclohexyl)piperidine.svg.png.webp) |
3',4'-MD-PCP | 3,4-Methylenedioxyphenyl | Piperidin | - |
cyclohexylamine.svg.png.webp) |
3'-MeO-PCE | m-Methoxyphenyl | Ethylamin | - |
cyclohexylamine.svg.png.webp) |
3'-HO-PCE | m-Hydroxyphenyl | Ethylamin | - |
-N-propylcyclohexylamine.svg.png.webp) |
3'-MeO-PCPr | m-Methoxyphenyl | n-Propylamin | - |
-N-propylcyclohexylamine.svg.png.webp) |
3'-HO-PCPr | m-Hydroxyphenyl | n-Propylamin | - |
-N-propylcyclohexylamine.svg.png.webp) |
3',4'-MD-PCPr | 3,4-Methylenedioxyphenyl | n-Propylamin | - |
cyclohexyl)pyrrolidine.svg.png.webp) |
3'-MeO-PCPy | m-Methoxyphenyl | Pyrrolidin | - |
cyclohexyl)piperidine.svg.png.webp) |
4'-HO-PCP | p-Hydroxyphenyl | Piperidin | - |
cyclohexyl)piperidine.svg.png.webp) |
Methoxydine (4'-MeO-PCP) | p-Methoxyphenyl | Piperidin | - |
cyclohexylamine.svg.png.webp) |
4'-MeO-PCE | p-Methoxyphenyl | Ethylamin | - |
cyclohexyl)piperidine.svg.png.webp) |
4'-F-PCP | p-Fluorophenyl | Piperidin | - |
cyclohexyl)pyrrolidine.svg.png.webp) |
4'-F-PCPy | p-Fluorophenyl | Pyrrolidin | - |
-2-(2-Chlorophenyl)-2-methylaminocyclohexanone.svg.png.webp) |
Arketamin | o-Chlorophenyl | Methylamin | 2-Oxo |
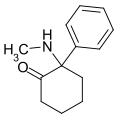 |
Deschloroketamin | Phenyl | Methylamin | 2-Oxo |
-2-(2-Chlorophenyl)-2-methylaminocyclohexanone.svg.png.webp) |
Esketamin | o-Chlorophenyl | Methylamin | 2-Oxo |
-2-methylaminocyclohexanone.svg.png.webp) |
Ketamin | o-Chlorophenyl | Methylamin | 2-Oxo |
-6-hydroxycyclohexanone.svg.png.webp) |
Hydroxynorketamin | o-Chlorophenyl | NH2 | 2-Oxo, 6-Hydroxy |
-2-ethylamino-cyclohexanone.svg.png.webp) |
Ethketamin | o-Chlorophenyl | Ethylamin | 2-Oxo |
-2-propylaminocyclohexanone.svg.png.webp) |
NPNK | o-Chlorophenyl | n-Propylamin | 2-Oxo |
-2-methyllaminocyclohexanone.svg.png.webp) |
Methoxyketamin | o-Methoxyphenyl | Methylamin | 2-Oxo |
cyclohexanone.svg.png.webp) |
oMDCK | o-Tolyl | Methylamin | 2-Oxo |
cyclohexanone.svg.png.webp) |
mMDCK | m-Tolyl | Methylamin | 2-Oxo |
-2-methylaminocyclohexanone.svg.png.webp) |
meta-Ketamin | m-Chlorophenyl | Methylamin | 2-Oxo |
-4-methylaminocyclohexanone.svg.png.webp) |
iso-Ketamine | o-Chlorophenyl | Methylamin | 4-Oxo |
-2-methylaminocyclohexanone.svg.png.webp) |
2-Fluorodeschloroketamin | o-Fluorophenyl | Methylamin | 2-Oxo |
-2-methylaminocyclohexanone.svg.png.webp) |
3-Fluorodeschloroketamin | m-Fluorophenyl | Methylamin | 2-Oxo |
-2-methylaminocyclohexanone.svg.png.webp) |
Bromoketamin | o-Bromophenyl | Methylamin | 2-Oxo |
-2-methylaminocyclohexanone.svg.png.webp) |
TFMDCK | o-Trifluoromethylphenyl | Methylamin | 2-Oxo |
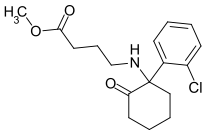 |
SN 35210[30] | o-Chlorophenyl | Carbomethoxybutylamin | 2-Oxo |
cyclohexanone.svg.png.webp) |
Methoxetamin (MXE) | m-Methoxyphenyl | Ethylamin | 2-Oxo |
-2-methylaminocyclohexanone.svg.png.webp) |
Methoxmetamin | m-Methoxyphenyl | Methylamin | 2-Oxo |
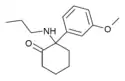 |
MXPr | m-Methoxyphenyl | n-Propylamin | 2-Oxo |
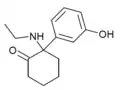 |
HXE | m-Hydroxyphenyl | Ethylamin | 2-Oxo |
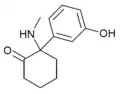 |
HXM | m-Hydroxyphenyl | Methylamin | 2-Oxo |
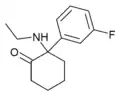 |
FXE | m-Fluorophenyl | Ethylamin | 2-Oxo |
 |
Phencyclidin (PCP) | Phenyl | Piperidin | - |
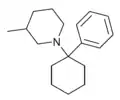 |
PC3MP | Phenyl | 3-Methylpiperidin | - |
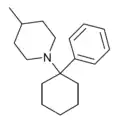 |
PC4MP | Phenyl | 4-Methylpiperidin | - |
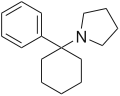 |
Rolicyclidin (PCPy) | Phenyl | Pyrrolidin | - |
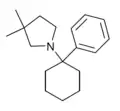 |
PCDMPy | Phenyl | 3,3-Dimethylpyrrolidin | - |
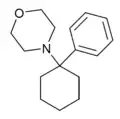 |
PCMo | Phenyl | Morpholin | - |
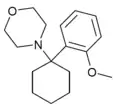 |
Methoxy-PCM[5][5] (2'-MeO-PCMo) | o-Methoxyphenyl | Morpholin | - |
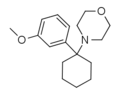 |
3'-MeO-PCMo | m-Methoxyphenyl | Morpholin | - |
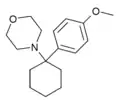 |
4'-MeO-PCMo | p-Methoxyphenyl | Morpholin | - |
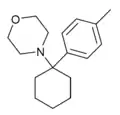 |
Methyl-PCM[31] (4'-Me-PCMo) | p-Tolyl | Morpholin | - |
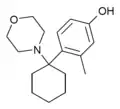 |
Hydroxy-methyl-PCM | 2-Methyl-4-hydroxyphenyl | Morpholin | - |
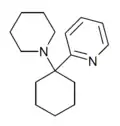 |
PYCP[32] | 2-Pyridinyl | Piperidin | - |
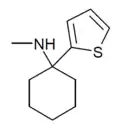 |
TCM | 2-Thienyl | Methylamin | - |
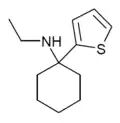 |
TCE | 2-Thienyl | Ethylamin | - |
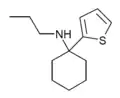 |
TCPr[33] | 2-Thienyl | Propylamin | - |
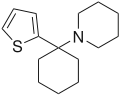 |
Tenocyclidin (TCP) | 2-Thienyl | Piperidin | - |
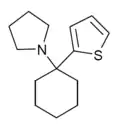 |
TCPy | 2-Thienyl | Pyrrolidin | - |
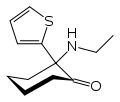 |
Tiletamin | 2-Thienyl | Ethylamin | 2-Oxo |
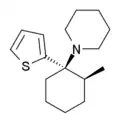 |
Gacyclidin | 2-Thienyl | Piperidin | 2-Methyl |
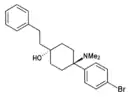 |
BDPC | p-Bromophenyl | Dimethylamin | 4-Phenethyl-4-hydroxy |
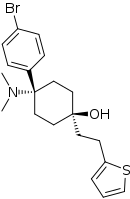 |
C-8813 | p-Bromophenyl | Dimethylamin | 4-(thiophen-2-yl)ethyl-4-hydroxy |
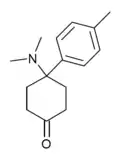 |
Dimetamin[34] | p-Tolyl | Dimethylamin | 4-Oxo |
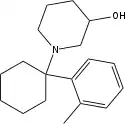 |
3''-OH-2'-Me-PCP [35] | o-Tolyl | 3-Hydroxypiperidin | - |
-4-Ph-4-OH-piperidine_structure.png.webp) |
4''-Ph-4''-OH-PCP [36] | Phenyl | 4-Phenyl-4-hydroxypiperidin | - |
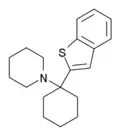 |
BTCP[37] | Benzothiophen-2-yl | Piperidin | - |
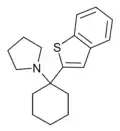 |
BTCPy[38] | Benzothiophen-2-yl | Pyrrolidin | - |
Analoge Verbindungen
Die Strukturabhängigkeit der halluzinogenen Wirkung von Phencyclidin wurde durch Variation der Cycloalkanringgröße untersucht. Es zeigt sich, dass die entsprechende Cyclopentylverbindung etwa 1/10 der halluzinogenen Wirksamkeit aufweist, während die Cycloheptyl- und Cyclooctylderivate inaktiv sind. Die homologen Verbindungen erhält man durch Umsetzung der jeweiligen Cycloalkylketonen mit Phenylmagnesiumbromid. Der resultierende Alkohol wird anschließend mit Natriumazid umgesetzt und dann mit Lithiumaluminiumhydrid zum Amin reduziert. Im letzten Schritt wird dann der Piperidinring mit 1-5-Dibrompentan aufgebaut.[39]
Weblinks
- H Morris, J Wallach: From PCP to MXE: a comprehensive review of the non-medical use of dissociative drugs. In: Drug Test Anal. 6, Nr. 7–8, 2014, S. 614–32. doi:10.1002/dta.1620. PMID 24678061.
- Synthesis and Effects of PCP Analogs
- Interview with a Ketamine Chemist
Einzelnachweise
- H. Morris, J. Wallach: From PCP to MXE: a comprehensive review of the non-medical use of dissociative drugs. In: Drug Testing and Analysis. 6, Nr. 7–8, 2014, S. 614–32. doi:10.1002/dta.1620. PMID 24678061.
- Jason Wallach, Simon D. Brandt: Phencyclidine-Based New Psychoactive Substances. In: Hans H. Maurer, Simon D. Brandt (Hrsg.): New Psychoactive Substances. Handbook of Experimental Pharmacology. Band 252. Springer, Cham 2018, ISBN 978-3-03010560-0, S. 261–303.
- Jason Wallach, Simon D. Brandt: 1,2-Diarylethylamine- and Ketamine-Based New Psychoactive Substances. In: Hans H. Maurer, Simon D. Brandt (Hrsg.): New Psychoactive Substances. Handbook of Experimental Pharmacology. Band 252. Springer, Cham 2018, ISBN 978-3-03010560-0, S. 305–352.
- Abbas Ahmadi, Ali Mahmoudi: Synthesis and Biological Properties of 2-Hydroxy-1-(1-phenyltetralyl)piperidine and Some of its Intermediates as Derivatives of Phencyclidine. In: Arzneimittelforschung. Band 55, Nr. 09, September 2005, S. 528, doi:10.1055/s-0031-1296900.
- Abbas Ahmadi, Ali Mahmoudi, Ramin Hajikhani, Moslem Naserbakht: New morpholine analogues of phencyclidine: Chemical synthesis and pain perception in rats. In: Pharmacology Biochemistry and Behavior. Band 98, Nr. 2, April 2011, S. 227–233, doi:10.1016/j.pbb.2010.12.019.
- Isabelle Chaudieu, Jacques Vignon, Michèle Chicheportiche, Jean-Marc Kamenka, Gérard Trouiller, Robert Chicheportiche: Role of the aromatic group in the inhibition of phencyclidine binding and dopamine uptake by PCP analogs. In: Pharmacology Biochemistry and Behavior. Band 32, Nr. 3, März 1989, S. 699, doi:10.1016/0091-3057(89)90020-8.
- Y. Itzhak, Simon: A novel phencyclidine analog interacts selectively with mu opioid receptors. In: The Journal of Pharmacology and Experimental Therapeutics. 230, Nr. 2, 1984, S. 383–386. PMID 6086884.
- X. S. He, L. P. Raymon: Synthesis and biological evaluation of 1-1-(2-benzobthienyl)cyclohexylpiperidine homologues at dopamine-uptake and phencyclidine- and sigma-binding sites. In: Journal of Medicinal Chemistry. 36, Nr. 9, 1993, S. 1188–1193. doi:10.1021/jm00061a009. PMID 8098066.
- V. A. Eterović, R. Lu: Determinants of phencyclidine potency on the nicotinic acetylcholine receptors from muscle and electric organ. In: Cellular and Molecular Neurobiology. 19, Nr. 6, 1999, S. 745–757. doi:10.1023/A:1006905106834. PMID 10456235.
- P. Seeman, F. Ko: Dopamine receptor contribution to the action of PCP, LSD and ketamine psychotomimetics. In: Molecular Psychiatry. 10, Nr. 9, 2005, S. 877–883. doi:10.1038/sj.mp.4001682. PMID 15852061.
- OA al-Deeb: New analgesics derived from the phencyclidine analogue thienylcyclidine. In: Arzneimittelforschung. 46, Nr. 5, Mai 1996, S. 505–8. PMID 8737636.
- A Ahmadi: Synthesis and study the analgesic effects of new analogues of ketamine on female wistar rats. In: Medicinal Chemistry. 8, Nr. 2, Dezember, S. 246–51. PMID 22385170.
- A Ahmadi: Synthesis and study on analgesic effects of 1-1-(4-methylphenyl) (cyclohexyl) 4-piperidinol and 1-1-(4-methoxyphenyl) (cyclohexyl) 4-piperidinol as two new phencyclidine derivatives. In: Arzneimittel-Forschung. 59, Nr. 4, Dezember, S. 202–6. PMID 19517897.
- A Ahmadi: Synthesis and pain perception of new analogues of phencyclidine in NMRI male mice. In: Mini Reviews in Medicinal Chemistry. 14, Nr. 1, Dezember, S. 64–71. PMID 24251803.
- A Ahmadi: Synthesis and analgesic effects of new pyrrole derivatives of phencyclidine in mice. In: Arzneimittel-Forschung. 61, Nr. 5, Dezember, S. 296–300. PMID 21755813.
- A Ahmadi: Synthesis and determination of chronic and acute thermal and chemical pain activities of a new derivative of phencyclidine in rats. In: Iranian Journal of Pharmaceutical Research. 9, Nr. 4, Dezember, S. 379–85. PMID 24381602.
- A Ahmadi: Synthesis and determination of acute and chronic pain activities of 1-1-(3-methylphenyl) (tetralyl)piperidine as a new derivative of phencyclidine via tail immersion and formalin tests. In: Arzneimittel-Forschung. 60, Nr. 1, Dezember, S. 30–5. PMID 20184224.
- R Hajikhani: Effect of phencyclidine derivatives on anxiety-like behavior using an elevated-plus maze test in mice. In: Advances in Clinical and Experimental Medicine. 21, Nr. 3, Dezember, S. 307–12. PMID 23214193.
- A Ahmadi: Synthesis and Antinociception Activities of Some Novel Derivatives of Phencyclidine with Substituted Aminobenzothiazoles. In: Mini Rev Med Chem. 17, Nr. 1, Dezember, S. 78–84. PMID 27121715.
- D. Lednicer: 4-(p-Bromophenyl)-4-(dimethylamino)-1-phenethylcyclohexanol, an extremely potent representative of a new analgesic series. In: Journal of Medicinal Chemistry. 22, Nr. 10, Dezember, S. 1157–1158. PMID 513062.
- T. Maurice: PRE-084, a sigma selective PCP derivative, attenuates MK-801-induced impairment of learning in mice. In: Pharmacology Biochemistry and Behavior. 49, Nr. 4, Dezember, S. 859–869. PMID 7886099.
- A. Thurkauf, B. De Costa, S. Yamaguchi, M. V. Mattson, A. E. Jacobson, K. C. Rice, M. A. Rogawski: Synthesis and anticonvulsant activity of 1-phenylcyclohexylamine analogs. In: Journal of Medicinal Chemistry. 33, Nr. 5, 1990, S. 1452–8. doi:10.1021/jm00167a027. PMID 2329567.
- C. Sauer, F. Peters, R. Staack, G. Fritschi, H. Maurer: Metabolism and toxicological detection of a new designer drug, N-(1-phenylcyclohexyl)propanamine, in rat urine using gas chromatography-mass spectrometry. In: Journal of Chromatography A. 1186, Nr. 1–2, 2008, S. 380–390. doi:10.1016/j.chroma.2007.11.002. PMID 18035363.
- A Kalir, S Teomy, A Amir, P Fuchs, SA Lee, EJ Holsztynska, W Rocki: N-allyl analogues of phencyclidine: chemical synthesis and pharmacological properties. In: J Med Chem. 27, Nr. 10, Dezember, S. 1267–71. doi:10.1021/jm00376a006. PMID 6481761.
- C. Sauer, F. Peters, A. Schwaninger, M. Meyer, H. Maurer: Investigations on the cytochrome P450 (CYP) isoenzymes involved in the metabolism of the designer drugs N-(1-phenyl cyclohexyl)-2-ethoxyethanamine and N-(1-phenylcyclohexyl)-2-methoxyethanamine. In: Biochemical Pharmacology. 77, Nr. 3, 2009, S. 444–450. doi:10.1016/j.bcp.2008.10.024. PMID 19022226.
- M. A. Iorio, L. Tomassini, M. V. Mattson, C. George, A. E. Jacobson: Synthesis, stereochemistry, and biological activity of the 1-(1-phenyl-2-methylcyclohexyl)piperidines and the 1-(1-phenyl-4-methylcyclohexyl)piperidines. Absolute configuration of the potent trans-(-)-1-(1-phenyl-2-methylcyclohexyl)piperidine. In: Journal of Medicinal Chemistry. 34, Nr. 8, 1991, S. 2615–2623. doi:10.1021/jm00112a041. PMID 1875352.
- A. Ahmadi, A. Mahmoudi: Synthesis with improved yield and study on the analgesic effect of 2-methoxyphencyclidine. In: Arzneimittel-Forschung. 56, Nr. 5, 2006, S. 346–350. doi:10.1055/s-0031-1296732. PMID 16821645.
- A. M. Ogunbadeniyi, A. Adejare: Syntheses of fluorinated phencyclidine analogs. In: Journal of Fluorine Chemistry. 114, 2002, S. 39–42. doi:10.1016/S0022-1139(01)00565-6.
- J. Wallach, G. D. Paoli, A. Adejare, S. D. Brandt: Preparation and analytical characterization of 1-(1-phenylcyclohexyl)piperidine (PCP) and 1-(1-phenylcyclohexyl)pyrrolidine (PCPy) analogues. In: Drug Testing and Analysis. 6, Nr. 7–8, 2013, S. 633–50. doi:10.1002/dta.1468. PMID 23554350.
- M Harvey, J Sleigh, L Voss, F Pruijn, J Jose, S Gamage, W Denny: Determination of the Hypnotic Potency in Rats of the Novel Ketamine Ester Analogue SN 35210. In: Pharmacology. 96, Nr. 5–6, 2015, S. 226–32. doi:10.1159/000439598. PMID 26352278.
- Synthesis and determination of acute and chronic pain activities of 1-[1-(4-methylphenyl) (cyclohexyl)] morpholine as a new phencyclidine derivative in rats. In: Arzneimittel-Forschung. 61, Nr. 2, 2011, S. 92–7. doi:10.1055/s-0031-1296173. PMID 21428243.
- P Zarantonello, E Bettini, A Paio, C Simoncelli, S Terreni, F Cardullo: Novel analogues of ketamine and phencyclidine as NMDA receptor antagonists. In: Bioorg Med Chem Lett. 21, Nr. 7, Dezember, S. 2059–63. doi:10.1016/j.bmcl.2011.02.009. PMID 21334205.
- J Wallach, T Colestock, B Cicali, SP Elliott, PV Kavanagh, A Adejare, NM Dempster: Syntheses and analytical characterizations of N-alkyl-arylcyclohexylamines. In: Drug Test Anal. 8, Nr. 8, 2016, S. 801–815. doi:10.1002/dta.1861. PMID 26360516.
- D Lednicer, PF VonVoigtlander, DE Emmert: 4-Amino-4-arylcyclohexanones and their derivatives, a novel class of analgesics. 1. Modification of the aryl ring. In: J Med Chem. 23, Nr. 4, Dezember, S. 424–30. doi:10.1021/jm00178a014. PMID 7381841.
- A Ahmadi, J Solati, R Hajikhani, M Onagh, M Javadi: Synthesis and analgesic effects of 1-1-(2-methylphenyl)(cyclohexyl)-3-piperidinol as a new derivative of phencyclidine in mice. In: Arzneimittel-Forschung. 60, Nr. 8, 2010, S. 492–6. doi:10.1055/s-0031-1296317. PMID 20863005.
- Y Itzhak, A Kalir, BA Weissman, S Cohen: New analgesic drugs derived from phencyclidine. In: J Med Chem. 24, Nr. 5, 1981, S. 496–9. doi:10.1021/jm00137a004. PMID 7241506.
- J. Vignon, V. Pinet, C. Cerruti, J. M. Kamenka, R. Chicheportiche: 3HN-1-(2-benzo(b)thiophenyl)cyclohexylpiperidine (3HBTCP): A new phencyclidine analog selective for the dopamine uptake complex. In: European Journal of Pharmacology. 148, Nr. 3, 1988, S. 427–436. doi:10.1016/0014-2999(88)90122-7. PMID 3384005.
- XS He, LP Raymon, MV Mattson, ME Eldefrawi, BR de Costa: Synthesis and biological evaluation of 1-[1-(2-benzo[b]thienyl)cyclohexyl]piperidine homologues at dopamine-uptake and phencyclidine- and sigma-binding sites. In: J Med Chem. 36, Nr. 9, Dezember, S. 1188–93. doi:10.1021/jm00061a009. PMID 8098066.
- Roy L. McQuinn, Edward J. Cone, Harlan E. Shannon, Tsung-Ping Su: Structure-activity relationships of the cycloalkyl ring of phencyclidine. In: Journal of Medicinal Chemistry. Band 24, Nr. 12, Dezember 1981, S. 1429, doi:10.1021/jm00144a011.