Bariumchlorat
Bariumchlorat ist ein Bariumsalz der Chlorsäure. Es besitzt die Formel Ba(ClO3)2 und gehört zur Stoffgruppe der Chlorate.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
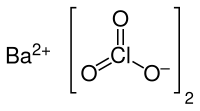 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bariumchlorat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | Ba(ClO3)2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, geruchlose Kristalle oder Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 304,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
3,18 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
gut in Wasser (256 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Im Labor lässt es sich durch Elektrolyse einer Bariumchloridlösung herstellen. Dabei kristallisiert ein Teil des Produkts aufgrund geringerer Löslichkeit aus.[3]
Es kann auch durch Reaktion von Calciumchlorat oder Natriumchlorat mit Bariumchlorid gewonnen werden.[4][5]
Ebenfalls möglich ist die Darstellung durch Reaktion von Ammoniumchlorat mit Bariumcarbonat[4]
oder durch einen Liebig-Prozess durch Reaktion von Bariumhydroxid mit Chlorgas.[4]
Aus Lösungen bildet sich das Monohydrat.[4]
Eigenschaften
Bariumchlorat ist ein farbloses Pulver, das sich ab 250 °C zersetzt.
Es ist ein starkes Oxidationsmittel. Wie alle Chlorate muss auch diese Verbindung vorsichtig gehandhabt werden. Das Monohydrat gibt bei 120 °C sein Kristallwasser ab[1], wobei die Abgabe schon bei 85 °C beginnt.[5]
Das Monohydrat besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/c (Raumgruppen-Nr. 15). Das Anhydrat eine orthorhombische Kristallstruktur die wahrscheinlich zur Raumgruppe Fd2d (Nr. 43, Stellung 3) gehört.[5]
Verwendung
In der Pyrotechnik wird Bariumchlorat nur noch selten eingesetzt.[6] Für eine grüne Flammenfärbung verwendet man heutzutage Bariumnitrat, da Zubereitungen mit Bariumchlorat auf Stoß, Schlag und Reibung heftig reagieren können.[7]
Bariumchlorat wird heute relativ selten verwendet und im Vergleich zu Kaliumchlorat und Natriumchlorat nur noch in geringeren Mengen hergestellt.
Es wird im Labormaßstab auch zur Herstellung von Chlorsäure verwendet[8] und wird auch teilweise beim Schwarzdruck eingesetzt.[9]
Einzelnachweise
- Eintrag zu Bariumchlorat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Barium chlorate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- F. Haber: Grundriss Der Technischen Elektrochemie Auf Theoretischer Grundlage. 2016, ISBN 978-4-88695-269-1, S. 441 (eingeschränkte Vorschau in der Google-Buchsuche).
- Heinrich Böttger, R. J. Meyer: Chlor. Springer-Verlag, 2013, ISBN 978-3-662-11321-9, S. 337 (eingeschränkte Vorschau in der Google-Buchsuche).
- Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 978-0-444-59553-9, S. 81 (eingeschränkte Vorschau in der Google-Buchsuche).
- Michael S. Russell: The Chemistry of Fireworks. Royal Society of Chemistry, 2009, ISBN 978-0-85404-127-5, S. 110 (eingeschränkte Vorschau in der Google-Buchsuche).
- Takeo Shimizu: Selected Pyrotechnic Publications of Dr. Takeo Shimizu Part 3 Studies on Fireworks Colored Flame Compositions. Journal of Pyrotechnics, 1997, ISBN 1-889526-11-8, S. 78 (eingeschränkte Vorschau in der Google-Buchsuche).
- Egon Wiberg: Lehrbuch der Anorganischen Chemie Mit einem Anhang: Chemiegeschichte. Walter de Gruyter, 2011, ISBN 978-3-11-023832-7, S. 124 (eingeschränkte Vorschau in der Google-Buchsuche).
- Rudolf Nietzki: Chemie der Organischen Farbstoffe. Springer-Verlag, 2013, ISBN 978-3-662-36672-1, S. 170 (eingeschränkte Vorschau in der Google-Buchsuche).


