Trifluormethanol
Trifluormethanol, auch als Perfluormethanol bezeichnet, ist ein bei Raumtemperatur instabiles farbloses Gas.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
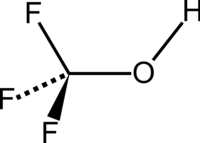 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Trifluormethanol | ||||||||||||
| Andere Namen |
Perfluormethanol | ||||||||||||
| Summenformel | CHF3O | ||||||||||||
| Kurzbeschreibung |
farbloses, instabiles Gas[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 86,01 g·mol−1 | ||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
−20 °C (extrapoliert)[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Synthese
Wie alle primären und sekundären Perfluoralkohole eliminiert Trifluormethanol in einer endothermen Reaktion[3] Fluorwasserstoff und bildet dabei Carbonylfluorid.[1]
- [3] (I)
Bei Temperaturen im Bereich von −120 °C kann Trifluormethanol aus Trifluormethoxychlorid und Chlorwasserstoff gemäß der Reaktion
- (II)
synthetisiert werden. In dieser Reaktion wird die Rekombination eines partiell positiv geladenen Chlor-Atoms (im Trifluormethoxychlorid) mit einem partiell negativ geladenen Chloratom (im Chlorwasserstoff) zu elementarem Chlor genutzt. Die unerwünschten Produkte, Edukte und Nebenprodukte Chlor, Chlorwasserstoff und Chlortrifluormethan können bei −110 °C durch Abpumpen entfernt werden. Das erhaltene Trifluormethanol hat einen Schmelzpunkt von −82 °C und einen berechneten Siedepunkt von ca. −20 °C. Der Siedepunkt liegt damit um etwa 85 Kelvin niedriger als der von Methanol. Dies lässt sich durch das Fehlen von intramolekularen H···F-Brückenbindungen erklären, die auch im Infrarot-Gasphasen-Spektrum nicht sichtbar sind.[1]
Eine einfachere Synthese nutzt die Reaktion (I), deren Gleichgewicht bei tieferen Temperaturen zum thermodynamisch bevorzugten Trifluormethanol verschoben werden kann. Wird das dabei gebildete Trifluormethanol mit Hilfe von Supersäuren, beispielsweise HSbF6 (Fluor-Antimonsäure), durch Protonierung abgefangen, so kann das Gleichgewicht weiter nach links, hin zum gewünschten Produkt, verschoben werden.[4]
Ähnlich wie bei Reaktion (I) können Trifluormethanolate (CF3O-) aus salzartigen Fluoriden (z. B. NaF) und Carbonylfluorid hergestellt werden. Wird das CF3O- Ion allerdings z. B. in wässriger Lösung von einer Säure verdrängt, so zerfällt das gebildete Trifluormethanol bei Raumtemperatur.
Vorkommen in den oberen Schichten der Atmosphäre
Während Trifluormethanol unter Normalbedingungen instabil ist, wird es in der Stratosphäre aus CF3·- und CF3O·-Radikalen durch Reaktion mit OF·- und F·-Radikalen erzeugt. Der Zerfall des dabei gebildeten Trifluormethanols ist bei den in der Atmosphäre vorherrschenden Bedingungen durch die hohe Aktivierungsenergie[3] der Reaktion vernachlässigbar.[5] Die berechnete Lebensdauer von Trifluormethanol beträgt in Höhen unterhalb von 40 km mehrere Millionen Jahre.[6][7]
Einzelnachweise
- K. Seppelt: Trifluormethanol, CF3OH. In: Angew. Chem. 1977, 89, 325.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- W. F. Schneider: Energetics and Mechanism of Decomposition of CF3OH. In: J. Phys. Chem. 100/1996, S. 6097–6103.
- K. O. Christe u. a.: Convenient Access to Trifluoromethanol. In: Angew. Chem. 119/2007, S. 6267–6270.
- K. Brudnik u. a.: Kinetics of the formation reactions of trifluoromethanol and trifluoromethyl hypohalites in the gas phase. In: Journal of Molecular Structure 656/2003, S. 333–339.
- W. F. Schneider u. a.: Atmospheric Chemistry of CF3OH: Is Photolysis Important? In: Environmental Science & Technology 29/1995, S. 247–250.
- T. J. Wellington, W. F. Schneider: The Stratospheric Fate of CF3OH. In: Environmental Science & Technology 28/1994, S. 1198–1200.
Literatur
- G. Klöter, K. Seppelt: Trifluoromethanol and Trifluoromethylamine. In: JACS 101/1979, S. 347.
- J. I. G. Cadogan, P. H. Rodes: Dictionary of organic compounds. Chapman and Hall, CRC Press, 1996, S. 6204–6205. ISBN 0-412-54090-8
- R. D. Chambers: Fluorine in organic chemistry. CRC Press, 2004, S. 254. ISBN 1-4051-0787-1.
- W. E. Doering u. a.: Cooperativity effects in cyclic trifluoromethanol trimer: an ab initio study. In: Journal of Molecular Structure: THEOCHEM 431/1998, S. 119–126.