Burgess-Reagenz
Das Burgess-Reagenz ist ein sehr mildes und syn-selektives Dehydratisierungsreagenz.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
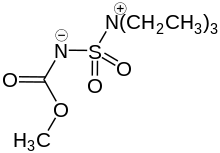 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Burgess-Reagenz | |||||||||||||||
| Andere Namen |
Methyl-N-(triethylammoniumsulfonyl)carbamat, inneres Salz | |||||||||||||||
| Summenformel | C8H18N2O4S | |||||||||||||||
| Kurzbeschreibung |
farblose, nadelförmige Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 238,30 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
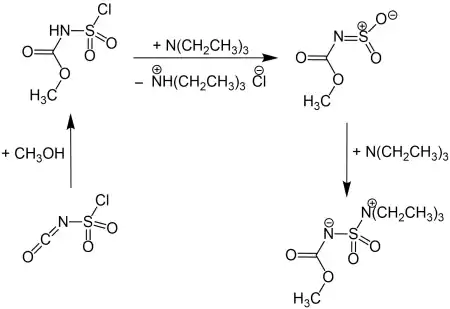
Das hier beschriebene Methylderivat, das heute unter der Bezeichnung Burgess-Reagenz auch kommerziell erhältlich ist, wurde erstmals 1970 von Crabbé und Léon hergestellt.[3] Die Synthese erfolgte allerdings nach einer Arbeitsvorschrift, die bereits 1968 von Burgess für das Ethylderivat veröffentlicht wurde.[4] Das hier beschriebene Reagenz wird aus Chlorsulfonylisocyanat mit Methanol und Triethylamin in Benzol hergestellt. Für das Ethylderivat wird nach analogem Verfahren mit Ethanol anstelle von Methanol gearbeitet.
Verwendung
Das Burgess-Reagenz findet bei der Burgess-Wasserabspaltung Anwendung. Bei dieser Namensreaktion handelt es sich um eine Dehydratisierung von sekundären und tertiären Alkoholen, um die entsprechenden Olefine in einer syn-Eliminierung gezielt zu synthetisieren.[5][6][7][8][9]
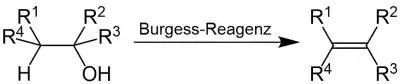
Später wurden weitere Anwendungsmöglichkeiten für das Burgess-Reagenz beschrieben.
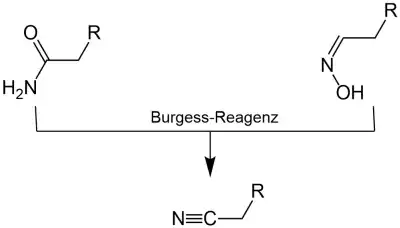
Synthese von Isonitrilen
Aber auch andere Verbindungen können mit dem Burgess-Reagenz umgesetzt werden. Zum Beispiel reagieren Formamide in einer Reaktion mit dem Burgess-Reagenz unter formaler Wasserabspaltung zu Isonitrilen:[10]

Synthese von Nitrilen
In der zweiten Hälfte der 1980er wurde das Burgess-Reagenz auch für die Wasserabspaltung primärer Amide und Oxime zu den korrespondierenden Nitrilen bei Raumtemperatur genutzt:[11][12]
Synthese von Nitriloxiden
Reagieren primäre Nitroalkane mit dem Burgess-Reagenz, lassen sich Nitriloxide synthetisieren:[13]
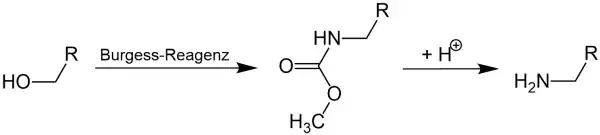
Synthese von Carbamaten
Primäre Alkohole reagieren mit dem Burgess-Reagenz zu den korrespondierenden Carbamaten, welche durch die anschließende Hydrolyse wiederum zu primären Aminen reagieren:[14]
Einzelnachweise
- Khapli, S.; Dey, S.; Mal, D. "Burgess reagent in organic synthesis." J. Indian Inst. Sci. 2001, 81, 461–476 PDF.
- Datenblatt Burgess-Reagenz bei Sigma-Aldrich, abgerufen am 14. März 2011 (PDF).
- Crabbé, P.; Léon, C. "A Novel Dehydration Reaction of Steroidal Alcohols" J. Org. Chem. 1970, 35, 2594–2596.
- Atkins, G. M.; Burgess, E. M. "The Reactions of an N-Sulfonylamine Inner Salt" J. Am. Chem. Soc. 1968, 90, 4744–4745.
- Burgess, E. M.; Penton, H. R., Jr.; Taylor, E. A. "Thermal Reactions of Alkyl N-Carbomethoxysulfamate Esters" J. Org. Chem. 1973, 38, 26–31.
- Burgess, E. M.; Penton, H. R., Jr.; Taylor, E. A.; Williams, W. M. "Conversion of primary alcohols to urethanes. Methyl n-sulfonylurethane triethylamine complexes." Org. Synth. 1973, 53, 1857.
- O'Grodnick, J. S.; Ebersole, R. C.; Wittstruck, T.; Caspi, E. "Trans dehydration of alcohols with methyl (carboxysulfamoyl)triethylammonium hydroxide inner salt." J. Org. Chem. 1974, 39, 2124–2126.
- Burgess, E. M.; Penton, H. R., Jr.; Taylor, E. A.; Williams, W. M. "Conversion of primary alcohols to urethanes via the inner salt of methyl (carboxysulfamoyl)triethylammonium hydroxide: methyl n-hexylcarbamate." Org. Synth. 1977, 56, 40–43.
- Edward M. Burgess, Harold R. Penton, Edward Alan. Taylor: Synthetic applications of N-carboalkoxysulfamate esters. In: Journal of the American Chemical Society. Band 92, Nr. 17, 1970, S. 5224–5226, doi:10.1021/ja00720a041.
- Siobhan M. Creedon, H. Kevin Crowley, Daniel G. McCarthy: Dehydration of formamides using the Burgess Reagent: a new route to isocyanides. In: Journal of the Chemical Society, Perkin Transactions 1. Nr. 6, 1998, S. 1015–1018, doi:10.1039/a708081f.
- David A. Claremon, Brian T. Phillips: An efficient chemoselective synthesis of nitriles from primary amides. In: Tetrahedron Letters. Band 29, Nr. 18, 1988, S. 2155–2158, doi:10.1016/S0040-4039(00)86697-6.
- Mild and Efficient Dehydration of Oximes to Nitriles Mediated by the Burgess Reagent. In: Synlett. Band 2000, Nr. 08, 2000, S. 1169–1171, doi:10.1055/s-2000-6752.
- Nathalie Maugein, Alain Wagner, Charles Mioskowski: New conditions for the generation of nitrile oxides from primary nitroalkanes. In: Tetrahedron Letters. Band 38, Nr. 9, 1997, S. 1547–1550, doi:10.1016/S0040-4039(97)00101-9.
- Edward M. Burgess, Harold R. Penton, E. Alan Taylor, W. Michael Williams: Conversion of Primary Alcohols to Urethanes via the Inner Salt of Methyl (Carboxysulfamoyl)Triethylammonium Hydroxide: Methyl n -Hexylcarbamate: Carbamic acid, hexyl-, methyl ester. In: Organic Syntheses. John Wiley & Sons, Inc., Hoboken, NJ, USA 2003, ISBN 978-0-471-26422-4, S. 40–40, doi:10.1002/0471264180.os056.10.
