Burgess-Wasserabspaltung
Die Burgess-Wasserabspaltung ist eine Namensreaktion in der Organischen Chemie, welche 1970 erstmals von Edward M. Burgess (1934–2018) und seinen Mitarbeitern beschrieben wurde. Bei der Reaktion handelt es sich um eine Dehydratisierung von sekundären und tertiären Alkoholen mit Hilfe des Burgess-Reagenzes, um die entsprechenden Olefine gezielt zu synthetisieren.[1]
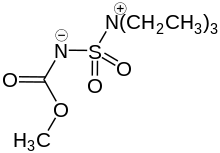
Übersichtsreaktion
Bei der Burgess-Wasserabspaltung wird ein sekundärer oder tertiärer Alkohol 1 mit dem Burgess-Reagenz und über eine syn-Eliminierung zu dem entsprechenden Alken 2 umgesetzt.[1]
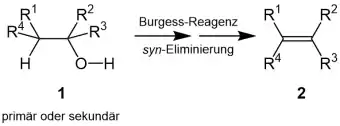
Die Reaktion bietet den Vorteil, gegenüber der Dehydratisierung, dass sie unter milden Bedingungen stattfindet. Dazu zählen niedrige Temperaturen und ein neutrales Medium. Somit können auch mit säureempfindlichen Substraten, welche anfällig sind weiter zu reagieren, nahezu quantitative Ausbeuten erzielt werden. Die Eliminierung ist syn-selektiv, wobei diese Selektivität bei sekundären Alkoholen höher ist. Tertiäre Alkohole tendieren hingegen dazu, schneller und unter milderen Bedingungen zu reagieren.[2]
Reaktionsmechanismus
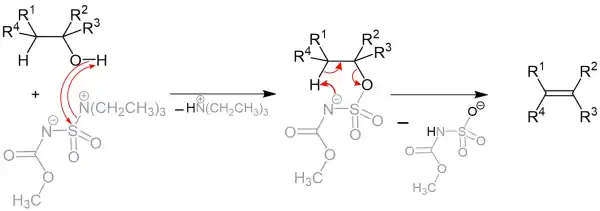
Die Zugabe des Burgess-Reagenzes zu dem Alkohol führt im vorgeschlagenen Reaktionsmechanismus zunächst zur Bildung eines Sulfamateesters. Dieser reagiert bei Erwärmung in einer stereospezifischen intramolekulare syn-Eliminierung zu dem Alken als Reaktionsprodukt, wobei als Koppelprodukt Triethylammoniumsulfonylcarbamat entsteht.[3]
Atomökonomie
Bei der Burgess-Wasserabspaltung fällt Triethylammoniumsulfonylcarbamat in stöchiometrischer Menge als Abfallstoff an, wodurch die Atomeffizienz als verhältnismäßig schlecht einzustufen ist.[3]
Modifikation
Das Burgess-Reagenz lässt sich auch mit vielen anderen funktionellen Gruppen umsetzen, wozu auch Epoxide, Alkene, Alkine, Aldehyde, Ketone, Acetale, Amide und Ester gehören. Somit ist eine effiziente Wasserabspaltung von hochfunktionellen Molekülen möglich.[3]
In der zweiten Hälfte der 1980er-Jahre wurde das Burgess-Reagenz auch für die Wasserabspaltung primärer Amide[4] und Oxime[5] zu den entsprechenden Nitrilen bei Raumtemperatur genutzt. Andere Verbindungen können auch mit dem Burgess-Reagenz dehydriert werden, wie zum Beispiel Formamide, welche Isonitrile ergeben,[6] Harnstoff, welches zu Carbodiimiden umgewandelt wird[7] und primäre Nitroalkane, welche zu Nitriloxiden reagieren.[8]
Primäre Alkohole reagieren mit dem Burgess-Reagenz zu den korrespondierenden Carbamaten, welche durch die anschließende Hydrolyse wiederum zu primären Aminen reagieren.[9]
Anwendung
Die Reaktion dient unter anderem der Herstellung von Antibiotika.[10][11] Beispielsweise spielt die Burgess-Wasserabspaltung auch bei der Herstellung des Antibiotikums Herbicidin B eine Rolle. Hier wird zunächst ein sekundärer Alkohol gebildet, welcher mit Hilfe des Burgess-Reagenzes weiter reagiert, so dass ein Enon entsteht. Dieses Enon reagiert in einem letzten Schritt weiter zum Herbicidin B.[11]
Einzelnachweise
- Edward M. Burgess, Harold R. Penton, Edward Alan Taylor: Synthetic applications of N-carboalkoxysulfamate esters. In: Journal of the American Chemical Society. Band 92, Nr. 17, 1970, S. 5224–5226, doi:10.1021/ja00720a041.
- Barbara Czakó: Strategic applications of named reactions in organic synthesis : background and detailed mechanisms. Elsevier Academic Press, Amsterdam 2005, ISBN 0-12-429785-4, S. 72–73.
- Zerong Wang: Irvine-Purdie Methylation. In: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Hoboken, NJ, USA 2010, ISBN 978-0-470-63885-9, S. 1526–1529, DOI:10.1002/9780470638859.conrr341.
- David A. Claremon, Brian T. Phillips: An efficient chemoselective synthesis of nitriles from primary amides. In: Tetrahedron Letters. Band 29, Nr. 18, 1988, S. 2155–2158, doi:10.1016/S0040-4039(00)86697-6.
- Mild and Efficient Dehydration of Oximes to Nitriles Mediated by the Burgess Reagent. In: Synlett. Band 2000, Nr. 08, 2000, S. 1169–1171, doi:10.1055/s-2000-6752.
- Siobhan M. Creedon, H. Kevin Crowley, Daniel G. McCarthy: Dehydration of formamides using the Burgess Reagent: a new route to isocyanides. In: Journal of the Chemical Society, Perkin Transactions 1. Nr. 6, 1998, S. 1015–1018, doi:10.1039/a708081f.
- Mark R. Barvian, H.D. Hollis Showalter, Annette M. Doherty: Preparation of N,N′-bis(aryl)guanidines from electron deficient amines via masked carbodiimides. In: Tetrahedron Letters. Band 38, Nr. 39, 1997, S. 6799–6802, doi:10.1016/S0040-4039(97)01598-0.
- Nathalie Maugein, Alain Wagner, Charles Mioskowski: New conditions for the generation of nitrile oxides from primary nitroalkanes. In: Tetrahedron Letters. Band 38, Nr. 9, 1997, S. 1547–1550, doi:10.1016/S0040-4039(97)00101-9.
- Edward M. Burgess, Harold R. Penton, E. Alan Taylor, W. Michael Williams: Conversion of Primary Alcohols to Urethanes via the Inner Salt of Methyl (Carboxysulfamoyl)Triethylammonium Hydroxide: Methyl n-Hexylcarbamate. In: Organic Syntheses. Nr. 56. American Cancer Society, 1977, ISBN 0-471-26422-9, S. 40–43, doi:10.1002/0471264180.os056.10.
- Francis Tavares, Jon P. Lawson, A. I. Meyers: Total Synthesis of Streptogramin Antibiotics. (−)-Madumycin II. In: Journal of the American Chemical Society. Band 118, Nr. 13, 1996, S. 3303–3304, doi:10.1021/ja954312r.
- Satoshi Ichikawa, Satoshi Shuto, Akira Matsuda: The First Synthesis of Herbicidin B. Stereoselective Construction of the Tricyclic Undecose Moiety by a Conformational Restriction Strategy Using Steric Repulsion between Adjacent Bulky Silyl Protecting Groups on a Pyranose Ring †. In: Journal of the American Chemical Society. Band 121, Nr. 44, 1999, S. 10270–10280, doi:10.1021/ja992608h.