syn-anti-Notation
syn und anti wird in der Organischen Chemie verwendet, um
- in verbrückten bicyclischen Kohlenwasserstoffen die relative Stellung zweier Substituenten zueinander zu benennen[1] und
- in Additionsreaktionen den Reaktionsablauf eindeutig zu beschreiben.[2]
syn- und anti- in bicyclischen Kohlenwasserstoffen
Die syn-anti-Isomerie beschreibt die relative Position eines Substituenten, der sich an der dritten Brücke eines Bicyclus befindet. Dieser Substituent kann zwei isomere Positionen einnehmen, die mit den Deskriptoren syn- bzw. anti- gekennzeichnet werden:
heptan_V1.svg.png.webp) 2-exo-Brom-7-syn-fluor-bicyclo[2.2.1]heptan (=syn-Isomer)
2-exo-Brom-7-syn-fluor-bicyclo[2.2.1]heptan (=syn-Isomer)heptan_V1.svg.png.webp) 2-exo-Brom-7-anti-fluor-bicyclo[2.2.1]heptan (=anti-Isomer)
2-exo-Brom-7-anti-fluor-bicyclo[2.2.1]heptan (=anti-Isomer)nonan_V1.svg.png.webp) 9-syn-Fluor-bicyclo[4.2.1]nonan (=syn-Isomer)
9-syn-Fluor-bicyclo[4.2.1]nonan (=syn-Isomer)nonan_V1.svg.png.webp) 9-anti-Fluor-bicyclo[4.2.1]nonan (=anti-Isomer)
9-anti-Fluor-bicyclo[4.2.1]nonan (=anti-Isomer)
Als syn bezeichnet man dabei jene Position, bei der dieser Substituent auf der Seite der ersten Brücke liegt. Als anti bezeichnet man die dazu entgegengesetzte Position des Substituenten.
Die Reihung der drei Brücken eines Bicyclus erfolgt dabei folgendermaßen:
Ausgehend von den zwei Brückenkopfatomen, wird zuerst die Länge jeder einzelnen Brücken bestimmt. Die Reihung erfolgt dann nach der Brückenlänge, wobei die längste als erste und die kürzeste als dritte Brücke bezeichnet wird. Falls zwei Brücken gleich lang sind, so wird die höher substituierte Brücke erst gereiht.
syn- und anti- in Additionsreaktionen
Bei Additionsreaktionen wird mit der syn-anti-Notation der Eintrittsort der beiden zu addierenden Substituenten beschrieben.
Als syn bezeichnet man jene Additionsreaktion, bei der beide Substituenten auf derselben Seite des Alkens bzw. Alkins eintreten. Als anti bezeichnet man jene Additionsreaktion, bei der jeder Substituent auf einer anderen Seite des Alkens bzw. Alkins eintritt.
Im Falle von Additionsreaktionen an Alkinen führt die syn-Addition zur Bildung der entsprechenden (Z)-Isomere (veraltet auch: cis-Isomere), und die anti-Addition führt zur Bildung der entsprechenden (E)-Isomere (trans-Isomere).
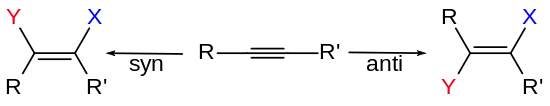
Aus Additionsreaktionen an der Doppelbindung von Cycloalkenen resultieren substituierte Cycloalkane:

Die Additionsreaktionen an die Doppelbindung von Alkenen führen zu den entsprechenden substituierten Alkanen. Damit an einer C-C-Einfachbindung eine Aussage über syn- oder anti-Konformation getroffen werden kann, müssen die anderen Positionen bei der Bildung von chiralen Produkten entsprechend unterschiedlich substituiert sein, so dass ein chirales Produkt erhalten wird. Andernfalls wären die Reaktionsprodukte durch Rotation um die C-C-Einfachbindung ineinander überführbar. Eine syn/anti-Unterscheidung wäre somit hinfällig.
syn- und anti- in Eliminierungsreaktionen
Bei Eliminierungsreaktionen entsteht in der organischen Chemie aus einer C-C-Einfachbindung eine C=C-Doppelbindung. Abhängig von der Struktur des Eduktes kann es dabei zur Ausbildung von cis- oder trans-stereoisomeren Alkenen kommen. Einen Einfluss hat dabei auch der Reaktionsmechanismus der Eliminierungsreaktion:
- bei einer zweistufigen Eliminierungsreaktion nach dem E1-Mechanismus wird die Stereochemie des Alkens erst durch die Abspaltung eines Protons aus dem zwischenzeitlich entstandenen Carbeniumion bestimmt.
- bei einer zweistufigen Eliminierungsreaktion nach dem E1cb-Mechanismus wird die Stereochemie des Alkens erst durch die Abspaltung einer Abgangsgruppe X aus dem zwischenzeitlich entstandenen Carbanion bestimmt.
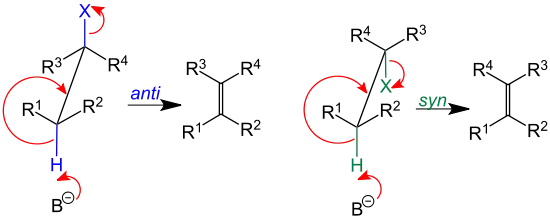
- bei einer Eliminierungsreaktion nach dem E2-Mechanismus bildet sich keine Zwischenstufe, zwei Einfachbindungen (ausgehend von benachbarten sp3-Kohlenstoffatomen) werden gebrochen und synchron entsteht die C=C-Doppelbindung eines Alkens. Aus den beiden sp3-Kohlenstoffatomen entstehen sp2-hybridisierte Kohlenstoffatome. Die zu brechenden σ-Bindungen müssen dabei in einer Ebene liegen. Das ist nur möglich bei einer gestaffelten anti-Anordnung oder bei einer ekliptischen syn-Anordnung. Bei der anti-Eliminierung stehen die σ-Bindungen anti-periplanar zueinander.[4]
Siehe auch
Einzelnachweise
- Eintrag zu endo, exo, syn, anti. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.E02094 – Version: 2.3.3.
- Chemgapedia: Glossar syn-/anti-Notation
- Joachim Buddrus: Grundlagen der Organischen Chemie, 4. Auflage, de Gruyter Verlag, Berlin, 2011, S. 286–289, ISBN 978-3-11-024894-4.
- Ulrich Lüning: Organische Reaktionen, Spektrum Akademischer Verlag Heidelberg, 3. Auflage, 2010, S. 59–61, ISBN 978-3-8274-2478-5.