Buntbarsche
Buntbarsche (Cichlidae) oder Cichliden sind eine Familie der Knochenfische aus der Gruppe der Barschverwandten (Percomorphaceae). Nach den Karpfenfischen (Cyprinidae) und den Grundeln (Gobiidae) bilden die Buntbarsche mit etwa 1700 beschriebenen Arten die drittgrößte Fisch-Familie. Viele Arten sind wegen ihres farbenprächtigen Äußeren, des komplexen Verhaltensspektrums und der einfachen Pflege beliebte Aquarienfische,[1] einige große Arten sind wichtige Speisefische.
| Buntbarsche | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Zebrabuntbarsch (Amatitlania nigrofasciata), Weibchen | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Cichlidae | ||||||||||||
| Bonaparte, 1835 |
In der Evolutionsbiologie hat die Untersuchung der Cichliden wesentlich zum Verständnis der Mechanismen der Artbildung beigetragen. Die Artenschwärme der Buntbarsche im Victoriasee und ihrer Verwandten in den benachbarten Afrikanischen Großen Seen können als Modell für eine relativ rasche Artenentwicklung betrachtet werden. Zudem sind Buntbarsche bedeutende Forschungsobjekte in der Verhaltensbiologie.[1]
Vorkommen
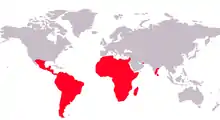
Buntbarsche bewohnen mit etwa 1100 beschriebenen Arten den größten Teil des tropischen Afrikas; weitere 200 bisher unbeschriebene Arten werden hier vermutet. Allein in den ostafrikanischen Seen Malawi, Tanganjika (350 Arten) und Viktoria (250–350 Arten) kommen jeweils mehrere hundert Arten vor. Hier stellen sie den Hauptbestandteil der Fischfauna. Etwa 570 Arten leben in Mittel- und Südamerika, vier auf Kuba und Hispaniola, eine auch in Texas. 29 Arten, die stark in ihrem Bestand gefährdet sind, leben auf Madagaskar. In Asien sind die Buntbarsche mit nur elf bis zwölf Arten vertreten: drei in Südindien und Sri Lanka, eine im Süden des Iran (Iranocichla hormuzensis) und sieben bis acht in Israel und Jordanien (Tal des Jordan). Die Buntbarsche Indiens, Madagaskars, Kubas und Hispaniolas gehen auch in Brackwasser. Coptodon guineensis kommt als einzige Buntbarschart von der Mündung des Senegal bis zur Mündung des Kunene im Meer vor.[2]
Einige Arten wurden als Neozoen weit verbreitet. Der Mosambik-Buntbarsch (Oreochromis mossambicus) und mehr noch die Niltilapie (Oreochromis niloticus) wurden aus fischereiwirtschaftlichen Gründen (Aquakultur) in vielen tropischen Länder eingeführt.[3] Ihre Verwilderung in mehreren Ländern hat negative ökologische Auswirkungen, da sie einheimische Arten verdrängen.[4] Ein weiterer Buntbarsch, der Chanchito (Australoheros facetum) aus dem Süden Brasiliens und dem Norden Argentiniens, hat sich auch in Europa, im Süden Portugals und Spaniens, verbreitet[5][6] und kommt inzwischen sogar in einigen deutschen Seen (Baden-Württemberg und Nordrhein-Westfalen) vor.[7]
Merkmale

Die Größe der Buntbarsche reicht von drei Zentimetern (Apistogramma) bis zu 80 Zentimetern (Boulengerochromis, Cichla). Ihre Grundform ist oval, etwas langgestreckt und seitlich abgeflacht, etwa so wie der Rote Buntbarsch in der Taxobox. Angepasst an ihr jeweiliges Habitat kann die Körperform jedoch auch stark von der Grundform abweichen. So sind die zwischen Stelzwurzeln im Orinoko- und Amazonasbecken lebenden Diskusfische und Skalare scheibenförmig, die Skalare weisen zudem stark erhöhte Rücken-, After- und Bauchflossen auf. Andere Buntbarsche sind hechtförmig (Crenicichla) oder langgestreckt (Teleogramma oder Julidochromis, Jagd in Felsspalten). Buntbarsche aus den Livingstonefällen oder den Sandufern des Tanganjikasee ähneln Grundeln. Zwischen diesen Extremen gibt es viele Übergangsformen. Die Maulform ist an die verschiedensten Ernährungstypen angepasst. Sie reicht von tief gespalten bei räuberischen Arten (wie Crenicichla) bis hin zu stark unterständig und auf das Abraspeln von Felsenaufwuchs spezialisiert (bei Labeotropheus).
Im Unterschied zu den meisten anderen Fischen haben Buntbarsche auf jeder Kopfseite nur ein Nasenloch. Ihre Seitenlinie ist unterbrochen, der vordere Teil läuft auf der oberen Körperhälfte parallel zur Rückenkrümmung, der hintere auf der Seitenmitte bis auf den Schwanzflossenstiel. Entlang der Seitenlinie zählt man 20 bis 50 Schuppen, in Ausnahmefällen mehr als 100. In der einzigen Rückenflosse ist deutlich ein hartstrahliger und ein weichstrahliger Teil zu unterscheiden. Sie wird von sieben bis 25 Flossenstacheln und fünf bis 30 Weichstrahlen gestützt. Die Afterflosse hat normalerweise drei Flossenstacheln (bei wenigen Arten auch vier bis neun, bei Etroplus zwölf bis fünfzehn) und vier bis fünfzehn Weichstrahlen, in Ausnahmefällen auch mehr als 30. Die Schwanzflosse ist meist abgerundet oder schließt gerade ab, in vielen Fällen, manchmal nur bei den Männchen, mit filamentartigen Auswüchsen oben und unten. Nur wenige Buntbarsche besitzen eine gegabelte Schwanzflosse.[8]
Lebensweise
Ernährung
Die Ernährungsweisen der Buntbarsche sind sehr vielfältig. So gibt es generalisierte Räuber, Planktonfresser, Aufwuchsfresser, Pflanzenfresser und Larvenfresser. In den Seen des Ostafrikanischen Grabenbruches ist die Spezialisierung bezüglich der Ernährung besonders gut zu sehen und erforscht worden.
Viele der Buntbarsche sind primär Pflanzenfresser, die sich von Algen (z. B. Petrochromis) und Pflanzen (z. B. Etroplus suratensis) ernähren. Kleine Tiere, wie Wirbellose, machen nur einen geringen Teil ihrer Nahrung aus. Detritivore, zu welchen die Gattungen Oreochromis, Sarotherodon und Tilapia gehören, fressen verschiedenes organisches Material.
Räuberisch lebende Buntbarsche fressen wenig bis gar kein Pflanzenmaterial. Eingeteilt werden die Räuber in Spezialisten und in Generalisten, die Jagd auf kleine Tiere wie Fische und Insektenlarven machen. Trematocranus ist zum Beispiel ein auf Schnecken spezialisierter Buntbarsch, während sich Pungu maclareni von Schwämmen ernährt. Ein Teil der Buntbarsche ernährt sich ganz oder teilweise von anderen Fischen. Hechtbuntbarsche (Crenicichla) sind heimliche Räuber, die sich aus einem Versteck heraus auf vorbeischwimmende Fische stürzen, während Rhamphochromis-Arten ihre Beute im offenen Gewässer verfolgen.[9] Einige Gattungen der Buntbarsche (z. B. Caprichromis) ernähren sich von den Eiern oder Juvenilen anderer Spezies.[10][11][12][13] Dafür rammen die Räuber teilweise die Köpfe von Maulbrütern, die dadurch gezwungen sind, ihre Jungtiere auszuspucken. Zu den Buntbarschen mit außergewöhnlicher Ernährungsstrategie gehören Corematodus, Docimodus, Plecodus, Perissodus und Genyochromis mento, welche sich von Schuppen und Flossen anderer Fische ernähren. Dieses Verhalten ist als Lepidophagie bekannt. Eine ebenfalls spezielle Ernährungsstrategie zeigen Nimbochromis und Parachromis, die sich tot stellen und regungslos daliegen, bis Beute heranschwimmt und geschnappt werden kann.[14][15][16]
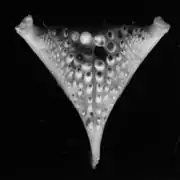
An die verschiedenen Ernährungsstrategien angepasst sind die unterschiedlichen Schlundzähne. Mit dem Kiefer wird die Nahrung aufgenommen und festgehalten, während die Schlundzähne als Kauwerkzeug dienen. Durch die verschiedenen Ernährungsstrategien ist es den Buntbarschen möglich, unterschiedliche Habitate zu besiedeln.
Schlundkiefer
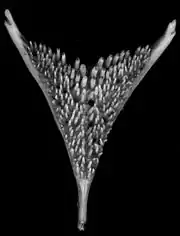
Unter anderem könnte die strukturelle Diversität des unteren Schlundkiefers ein Grund für das Auftreten der vielen Buntbarscharten sein. Die konvergente Evolution fand im zeitlichen Verlauf der Radiation statt, synchron zu den unterschiedlichen trophischen Nischen.[17]
Der Schlundkieferapparat besteht aus zwei oberen und einer einzelnen unteren Platte, welche alle eine Bezahnung aufweisen, die sich in Größe und Typ unterscheidet.[18] Die Struktur des unteren Schlundkiefers ist oft mit der Ernährungsart der Spezies assoziiert.[19]
Um Schalenweichtiere knacken zu können, muss eine erhebliche Druckkraft erzeugt werden, weshalb die Buntbarsche, welche sich von Schalenweichtieren ernähren (z. B. der Hechtbuntbarsch Crenicichla minuano), molariforme Zähne und einen verstärkten Schlundkieferknochen haben. Um schalenlose Beutetiere packen und zerbeißen zu können, benötigen die Räuber konische, zurückgebogene Zähne.[20] Bei den herbivoren Buntbarschen wurden ebenfalls strukturelle Unterschiede der Schlundkieferbezahnung gefunden. Buntbarsche, die auf Algen spezialisiert sind (z. B. Pseudotropheus), weisen eher kleine konische Zähne auf. Arten, die sich von Hülsen oder Samen ernähren, benötigen große konische Zähne für das Zerbeißen ihrer Nahrung.[21]
Zusätzlich zur Bezahnung weist auch die Form des unteren Schlundkieferknochens eine große Variation auf.
Kampfverhalten
Die männlichen Fische der Art Oreochromis mossambicus reagieren in der Regel äußerst aggressiv, wenn Artgenossen in ihr Revier eindringen. Im stets folgenden Revierkampf gegen die Eindringlinge steigt bei ihnen die Blutkonzentration von Sexualhormonen deutlich an. Die Konzentration dieser Androgene erhöht sich jedoch nicht nur bei den Kämpfern, sondern sogar bei anderen dem Kampf zuschauenden Männchen. Durch verschiedene Experimente haben portugiesische Wissenschaftler um Rui Oliviera von der Hochschule für angewandte Psychologie in Lissabon (Portugal) herausgefunden, dass die Revierkämpfer vor allem dann ihre Hormonproduktion steigern, wenn sie in einem Kampf auf Grund der geringeren Größe oder einer erkennbaren Verletzung des Rivalen gute Aussichten auf einen Sieg haben. Können sie jedoch ihre Erfolgsaussichten nicht klar einschätzen, verändert sich bei ihnen auch nicht die Hormonkonzentration.

Brutpflege

Die meisten Arten zeigen ein für Fische recht ausgeprägtes Brutpflegeverhalten sowohl für die Eier als auch für die Larven. Man unterscheidet Substratlaicher (mit Offenlaichern und Höhlenlaichern) und Maulbrüter. Buntbarsche beschützen die Eier, indem sie Feinde von Gelege und Larven fernhalten und die Eier durch „Ablutschen“ und Fächeln reinigen. Je umfassender und somit erfolgversprechender die Brutpflege ist, desto weniger Eier werden gelegt. Häufig dauert sie an, bis die Jungtiere mehrere Wochen alt sind. Bei einigen der im Tanganjikasee vorkommenden Arten sind sogar die älteren Geschwister an der Aufzucht der jüngeren beteiligt.
Je nachdem, in welcher Form sich die Elternteile an der Brutpflege beteiligen, unterscheidet man folgende Familienformen:[22][23]
- Elternfamilie: Weibchen und Männchen üben die Brutpflege gemeinsam aus, wobei das Männchen meist einen größeren Anteil an der Revierverteidigung hat – in den meisten Fällen die dauerhafteste Familienbindung im Tierreich (z. B. bei den Buntbarschen der Tribus Cichlasomatini).
- Mann-Mutter-Familie: das Weibchen übt die Brutpflege allein aus, während das Männchen das Revier verteidigt. Auch nach dem Freischwimmen der Jungfische betreut das Weibchen allein die Jungen (z. B. bei Buntbarschen der Gattung Crenicara und Telmatochromis.) Diese Familienform ist oft mit Polygamie verbunden. Dann spricht man von einer Mann-Mütter-Familie.
- Mutterfamilie: Das Weibchen übt die Brutpflege allein aus, das Männchen beteiligt sich nicht an der Brutpflege (z. B. bei den maulbrütenden Buntbarschen des Malawisees).
- Vater-Mutter-Familie: Das Weibchen übt die Brutpflege zuerst allein aus, während das Männchen das Revier verteidigt. Schwimmen die Jungfische frei, so werden sie von beiden Eltern betreut (z. B. bei offenbrütenden Buntbarschen wie der Gattung Pelvicachromis.)
Systematik
Äußere Systematik

Die Buntbarsche wurden traditionell mit einigen Familien von Meeresfischen in die Unterordnung der Lippfischartigen (Labroidei) innerhalb der Ordnung der Barschartigen (Perciformes) gestellt. Die Verwandtschaft der Familien wird durch die Anatomie der Schlund- und Kiemenregion gestützt.
DNA-Sequenzierungen lassen aber keine Verwandtschaft zwischen Lippfischen, Papageifischen und Odaciden auf der einen und Buntbarschen, Brandungsbarschen und Riffbarschen auf der anderen Seite erkennen. Die ähnliche Schädelanatomie muss unabhängig voneinander mindestens zwei Mal entstanden sein.[24]
Für die Buntbarsche, die Ährenfischverwandten, die Brandungsbarsche und Riffbarsche und einige andere mit ihnen verwandte Taxa wird deshalb eine neue systematische Gruppe innerhalb der Barschverwandten, die Ovalentaria, vorgeschlagen. Als Schwestergruppe der Buntbarsche wurde überraschenderweise Pholidichthys ermittelt, eine nur zwei Arten umfassende Gattung und Familie von aalartig langgestreckten Meeresfischen, die mit den Buntbarschen das einzelne Nasenloch auf jeder Kopfseite, ein paariges Haftorgan auf der Kopfoberseite der Larven und die intensive Brutpflege teilen.[25] Als neue Ordnung für die Buntbarsche und Pholidichthys wird in aktuellen Systematiken die nach den Cichliden benannte Ordnung Cichliformes verwendet.[26][27]
Innere Systematik
Die Buntbarsche werden in vier Unterfamilien und in eine Reihe von Triben eingeteilt. An der Basis des Stammbaums stehen die in Indien und Madagaskar lebenden Etroplinae und die madagassischen Ptychochrominae. Die weit mehr als 1200 Arten der afrikanischen Buntbarsche gehören alle zur Unterfamilie Pseudocrenilabrinae, die süd- und mittelamerikanischen zur Unterfamilie Cichlinae.[28]

(Pseudetroplus maculatus)
Folgendes Kladogramm gibt die wahrscheinlichen verwandtschaftlichen Verhältnisse wieder:
| Cichlidae |
| ||||||||||||||||||
Gattungen
Es gibt etwa 1700 Arten aus über 230 Gattungen:
Sympatrische Artbildung
Sympatrische Artbildung (das Entstehen neuer Arten im Gebiet der Ursprungsart(en)) findet sich bei Buntbarschen in isolierten Seen, z. B. in Kraterseen in Nicaragua (Apoyo, Masay)[29] und im Barombi Mbo[30] und Bermin-Kratersee (Kamerun).[31] Die Buntbarscharten dieser Seen stammen von jeweils einer eingewanderten Art ab, unterscheiden sich aber heute deutlich in ihrer Morphologie und ökologischen Nische. Eine allopatrische Artbildung kann in diesen kleinen Kraterseen ausgeschlossen werden.
Stammesgeschichte

Molekulare Daten sprechen für eine Entstehung der Familie der Cichliden vor 97 bis 78 Millionen Jahren. Die indisch-madegassischen Etroplinae sind etwa 87 bis 66 Millionen Jahre alt, die rein madegassischen Ptychochrominae 78 bis 60 und die Neuweltcichliden und die Unterfamilie Pseudocrenilabrinae trennten sich vor 70 bis 55 Millionen Jahren voneinander. Das bedeutet das die Aufspaltung in die vier Unterfamilien lange nach dem Auseinanderbrechen Gondwanas stattfand. Entweder verbreiteten sich die heute fast ausschließlich im Süßwasser und nur mit wenigen Arten auch im Brackwasser vorkommenden Buntbarsche über Meere und Meeresarme oder es gab einen unbekannten marinen Vorfahren, dessen Nachfahren nacheinander unabhängig voneinander die Kontinente besiedelte. Da die im Meere lebende Gattung Pholidichthys der engste Verwandte der Buntbarsche ist, könnte es sein, dass eine hohe Salztoleranz in der frühen Evolution der Buntbarsche noch weit verbreitet war.[32]
Der große Artenschwarm der Ostafrikanischen Großen Seen entstand vor etwa 9,5 bis 6,9 Millionen Jahren, der jüngste gemeinsame Vorfahre der Buntbarsche des Victoria- und des Malawisees lebte vor 3,1 bis 1,7 Millionen Jahren. Etwas jünger ist der Artenschwarm im kamerunischen See Barombi Mbo (2,3 bis 1,4 Millionen Jahre).[33]
Wie Fossilien von fünf Buntbarscharten (Gattung Mahengechromis) aus einem ehemaligen kleinen Kratersee aus dem Eozän (46,3–45,7 Mio. Jahre) von Tansania zeigen, bildete die Familie auch in der Vergangenheit Artenschwärme.[34]
Bedeutung für die Aquaristik
In der Mitte des 20. Jahrhunderts wurden die Seenkette im Ostafrikanischen Grabenbruch und der Viktoriasee von Aquaristen entdeckt. Die enorme Artenzahl endemischer Arten in diesen Seen führte rasch zu großer Beliebtheit in der Aquaristik. Besonders Arten aus dem Tanganjika-See und dem Malawi-See (Mbunas und Utakas, auch Nicht-Mbunas genannt) wurden nach Europa und Amerika ausgeführt.
Gehalten werden Buntbarsche am besten in reinen Cichlidenbecken, zum Beispiel einem Biotop-Aquarium. Besonders problematisch ist, dass sich viele der Arten an den im Aquarium gepflegten Pflanzen vergreifen. Aquarianern, die diese Arten halten, stehen nur eine begrenzte Anzahl von Pflanzenarten zur Verfügung. Dazu zählt unter anderem das Zwergspeerblatt.
Siehe auch: Deutsche Cichliden-Gesellschaft
Literatur
- Joseph S. Nelson: Fishes of the World. 4th edition. John Wiley & Sons, Hoboken NJ u. a. 2006, ISBN 0-471-25031-7.
- Christian Sturmbauer: Artenentstehung und adaptive radiation. In: Wilfried Westheide, Reinhard Rieger: Spezielle Zoologie. Teil 2: Wirbel und Schädeltiere. 1. Auflage, Spektrum Akademischer Verlag, Heidelberg / Berlin 2004, ISBN 3-8274-0307-3, S. 280–282.
- Kurt Fiedler: Lehrbuch der Speziellen Zoologie. Band II, Teil 2: Fische. Gustav Fischer Verlag, Jena 1991, ISBN 3-334-00339-6.
- Günther Sterba: Süsswasserfische der Welt. 2. Auflage. Urania, Leipzig/Jena/Berlin 1990, ISBN 3-332-00109-4.
- Claus Schaefer: Cichlidae. In: Claus Schaefer, Torsten Schröer (Hrsg.): Das große Lexikon der Aquaristik. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9, S. 242 f.
- Axel Meyer, Thomas D. Kocher, Pereti Basasibwaki, Allan C. Wilson: Monophyletic origin of Lake Victoria cichlid fishes suggested by mitochondrial DNA sequences. In: Nature. Band 347, Nr. 6293, 1990, S. 550–553, doi:10.1038/347550a0.
Weblinks
Einzelnachweise
- Lexikon der Biologie: Buntbarsche. Spektrum Akademischer Verlag, Heidelberg 1999 (spektrum.de).
- Coptodon guineensis auf Fishbase.org (englisch)
- Yonas Fessehaye: Natural mating in Nile tilapia (Oreochromis niloticus L.) Wageningen Institute of Animal Sciences, Wageningen 2006, ISBN 978-90-8504-540-3 (Dissertation), S. 11.
- Buntbarsche auf Fishbase.org (englisch)
- B. Elvira: Native and exotic freshwater fishes in Spanish river basins. In: Freshwater Biology. 33, 1995, S. 103–108.
- B. Elvira, A. Almodovar: Freshwater fish introductions in Spain: facts and figures at the beginning of the 21st century. In: Journal of Fish Biology. 59, 2001 (Supplement A), S. 323–331.
- O. Geiter, S. Homma, R. Kinzelbach: Bestandsaufnahme und Bewertung von Neozoen in Deutschland 2002. Bundesministerium für Umwelt, Naturschutz und Reaktorsicherheit, Forschungsbericht 296 89 901/01 UBA-FB 000215, 2002. Im Auftrag des Umweltbundesamtes (Umweltbundesamt Texte) 25 02 ISSN 0722-186X.
- Nelson: Fishes of the World. 2006, S. 390.
- The cichlid fishes of lake malawi. Abgerufen am 6. April 2016.
- A.J. Ribbink, A.C. Ribbink: Paedophagia among cichlid fishes of Lake Victoria and Lake Malawi/Nyasa. In: =South African Journal of Science. Band 93, 1997, S. 509–512.
- Kenneth R. McKaye, Thomas Kocher: Head ramming behaviour by three paedophagous cichlids in Lake Malawi, Africa. In: Animal Behaviour. Band 31, Nr. 1, 1. Februar 1983, S. 206–210, doi:10.1016/S0003-3472(83)80190-0.
- W. Wilhelm: The Disputed Feeding Behaviour of a Paedophagous Haplochromine Cichlid (Pisces) Observed and Discussed. In: Behaviour. Band 74, Nr. 3, 1. Januar 1980, ISSN 1568-539X, S. 310–322, doi:10.1163/156853980X00528.
- Ad. Konings: Paedophagy in Malawi cichlids. In: Cichlid News Magazine. Band 16, Nr. 1, 2007, S. 28–32.
- ETHELWYNN TREWAVAS: An Example of ‘Mimicry’ in Fishes. In: Nature. Band 160, Nr. 4056, S. 120, doi:10.1038/160120a0.
- David H. Eccles, D. S. C. Lewis: A revision of the genus Docimodus Boulenger (Pisces: Cichlidae), a group of fishes with unusual feeding habits from Lake Malawi. In: Zoological Journal of the Linnean Society. Band 58, Nr. 2, 1. März 1976, ISSN 1096-3642, S. 165–172, doi:10.1111/j.1096-3642.1976.tb00826.x.
- Muderhwa Nshombo: Occasional egg-eating by the scale-eater Plecodus straeleni (Cichlidae) of Lake Tanganyika. In: Environmental Biology of Fishes. Band 31, Nr. 2, 1. Juni 1991, ISSN 0378-1909, S. 207–212, doi:10.1007/BF00001022.
- Moritz Muschick, Adrian Indermaur, Walter Salzburger: Convergent Evolution within an Adaptive Radiation of Cichlid Fishes. In: Current Biology. Band 22, Nr. 24, 18. Dezember 2012, ISSN 0960-9822, S. 2362–2368, doi:10.1016/j.cub.2012.10.048, PMID 23159601 (cell.com [abgerufen am 7. April 2016]).
- Jorge R. Casciotta, Gloria Arratia: Jaws and teeth of american cichlids (Pisces: Labroidei). In: Journal of Morphology. Band 217, Nr. 1, 1. Juli 1993, ISSN 1097-4687, S. 1–36, doi:10.1002/jmor.1052170102.
- Edward D. Burress: Cichlid fishes as models of ecological diversification: patterns, mechanisms, and consequences. In: Hydrobiologia. Band 748, Nr. 1, 18. Juli 2014, ISSN 0018-8158, S. 7–27, doi:10.1007/s10750-014-1960-z.
- Edward D. Burress, Alejandro Duarte, Michael M. Gangloff, Lynn Siefferman: Isotopic trophic guild structure of a diverse subtropical South American fish community. In: Ecology of Freshwater Fish. Band 22, Nr. 1, 1. Januar 2013, ISSN 1600-0633, S. 66–72, doi:10.1111/eff.12002.
- Martin J. Genner, George F. Turner, Stephen J. Hawkins: Foraging of Rocky Habitat Cichlid Fishes in Lake Malawi: Coexistence through Niche Partitioning? In: Oecologia. Band 121, Nr. 2, 1. Januar 1999, S. 283–292, JSTOR:4222466.
- Irenäus Eibl-Eibesfeldt Grundriss der vergleichenden Verhaltensforschung. Verlag Blank, München 1999, ISBN 3-937501-02-9
- Claus Schaefer: Cichlidae. In: Claus Schaefer, Torsten Schröer (Hrsg.): Das große Lexikon der Aquaristik. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9, S. 242 f.
- Mabuchi, Miya, Azuma & Nishida: Independent evolution of the specialized pharyngeal jaw apparatus in cichlid and labrid fishes. BMC Evolutionary Biology 2007, 7:10 doi:10.1186/1471-2148-7-10
- Peter C. Wainwright, W. Leo Smith, Samantha A. Price, Kevin L. Tang, John S. Sparks, Lara A. Ferry, Kristen L. Kuhn, Ron I. Eytan, Thomas J. Near: The Evolution of Pharyngognathy: A Phylogenetic and Functional Appraisal of the Pharyngeal Jaw Key Innovation in Labroid Fishes and Beyond. In: Systematic Biology. Band 61, Nr. 6, Dezember 2012, ISSN 1076-836X, S. 1001–1027, doi:10.1093/sysbio/sys060.
- Joseph S. Nelson, Terry C. Grande, Mark V. H. Wilson: Fishes of the World. Wiley, Hoboken, New Jersey, 2016, ISBN 978-1-118-34233-6.
- Ricardo Betancur-R, Edward O. Wiley, Gloria Arratia, Arturo Acero, Nicolas Bailly, Masaki Miya, Guillaume Lecointre und Guillermo Ortí: Phylogenetic classification of bony fishes. BMC Evolutionary Biology, BMC series – Juli 2017, DOI: 10.1186/s12862-017-0958-3
- John S. Sparks, Wm. Leo Smith: Phylogeny and biogeography of cichlid fishes (Teleostei: Perciformes: Cichlidae). In: Cladistics. Band 20, Nr. 6, Dezember 2004, ISSN 1096-0031, S. 501–517, doi:10.1111/j.1096-0031.2004.00038.x.
- Marta Barluenga, Kai N. Stölting, Walter Salzburger, Moritz Muschick, Axel Meyer: Sympatric speciation in Nicaraguan crater lake cichlid fish In: Nature. 439, S. 719–723 doi:10.1038/nature04325.
- Ulrich K. Schliewen, Barbara Klee: Reticulate sympatric speciation in Cameroonian crater lake cichlids. In: Frontiers in Zoology. 2004, 1:5 doi:10.1186/1742-9994-1-5.
- Ulrich K. Schliewen, Diethard Tautz, Svante Pääbo: Sympatric speciation suggested by monophyly of crater lake cichlids Nature 368, 629–632 doi:10.1038/368629a0
- Michael Matschiner, Astrid Böhne, Fabrizia Ronco & Walter Salzburger: The genomic timeline of cichlid fish diversification across continents. Nature Communications, Volume 11, Article number: 5895 (2020) Link
- Matt Friedman, Benjamin P. Keck, Alex Dornburg, Ron I. Eytan, Christopher H. Martin, C. Darrin Hulsey, Peter C. Wainwright & Thomas J. Near: Molecular and fossil evidence place the origin of cichlid fishes long after Gondwanan rifting. In: Proceedings of the Royal Society. B 7. November 2013, Band 280, Nr. 1770 doi:10.1098/rspb.2013.1733.
- A. M. Murray (2001): The oldest fossil cichlids (Teleostei: Perciformes): indication of a 45 million-year-old species flock. In: Proc Biol Sci. 268, Nr. 1468, 7. April 2001, S. 679–684. doi:10.1098/rspb.2000.1570, PMC 1088656 (freier Volltext).
