Begomovirus
Begomovirus ist eine Gattung von Viren in der Familie Geminiviridae innerhalb des Phylums Cressdnaviricota.[1] Begomoviren sind Pflanzenviren, die in ihrer Gesamtheit ein sehr breites Wirtsspektrum haben und Zweikeimblättrige Pflanzen (Dicotyledoneae) infizieren. Weltweit sind sie für einen beträchtlichen wirtschaftlichen Schaden an vielen wichtigen Nutzpflanzen wie Tomaten, Bohnen, Kürbis, Maniok und Baumwolle verantwortlich.[2] Es gibt derzeit (Stand Mitte April 2021) 424 Arten vom International Committee on Taxonomy of Viruses (ICTV) bestätigte Spezies (Arten) in dieser Gattung, einschließlich der Typusspezies Bean Golden Yellow Mosaic Virus.[1]
| Begomovirus | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
.jpg.webp)
Begomovirus | ||||||||||||||||
| Systematik | ||||||||||||||||
| ||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||
| ||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||
| Begomovirus | ||||||||||||||||
| Links | ||||||||||||||||
|
Morphologie
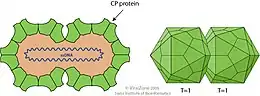
Die Viruspartikel (Virionen) der Gattung Begomovirus sind nicht umhüllt. Das Nukleokapsid ist 38 nm (Nanometer) lang und hat einen Durchmesser von 15–22 nm. Es hat die für Mitglieder der Familie Geminiviridae (deutsch informell manchmal „Zwillingsviren“ genannt[3]) typische Morphologie: Während die Partikel eine grundsätzlich ikosaedrische Symmetrie aufweisen, bestehen sie aus zwei solchen unvollständigen Ikosaedern, denen jeweils ein Scheitelpunkt fehlt und die so miteinander wie Siamesische Zwillinge verbunden sind. Es gibt 22 (zweimal elf) Kapsomere pro Nukleokapsid.[4]
Genom und Proteom
Das Genom in der Gattung Begomovirus besteht aus zirkulär geschlossener Einzelstrang-DNA (ssDNA). Gewöhnlich haben Begomoviren ein bipartites (segmentiertes) Genom: Das Genom ist dann in zwei Segmente (als DNA-A und DNA-B bezeichnet) aufgeteilt ist, die in separate Virionen (Viruspartikel) verpackt sind. In diesem Fall sind im Allgemeinen beide Segmente für eine erfolgreiche symptomatische Infektion in einer Wirtszelle erforderlich. Die DNA-B ist für ihre Replikation von der DNA-A abhängig, die bei einigen Begomoviren anscheinend bereits allein normale Infektionen verursachen kann.[4]
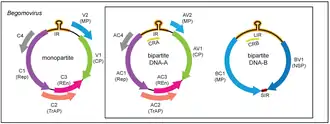

Die Proteine dieser Gattung können entweder auf dem Sense-Strang (positive Orientierung) oder auf dessen Komplement (negative Orientierung) kodiert sein.[4]
- Segment A
- Das Segment DNA-A kodiert typischerweise fünf bis sechs Proteine, darunter:
- V1 (R1) – positive Orientierung: Kapsidprotein (CP) – 29,7 kDa (KiloDalton)
- V2 – positive Orientierung: Movement-Protein (Transport-Protein: Precoat-ORF) – 12,8 kDa
- C1 (L1) – negative Orientierung: Replikations-Initiationsprotein (Rep) – 40,2 kDa
- C2 (L2) – negative Orientierung: Transkriptionsaktivator-Protein (TrAP) – 19,6 kDa
- C3 (L3) – negative Orientierung: Replikationsverstärker – 15,6 kDa
- C4 – negative Orientierung: Kann die Expression der Symptome bestimmen – 12,0 kDa
- Neben CP und Rep gibt es also eine oder mehrere Komponenten an Regulationsproteinen (Kontrolle der Genexpression), Proteinen zur Überwindung der Wirtsabwehr und Proteine zur Übertragung durch Insekten als Vektoren.
- Dieses Segment ist homolog zu den Genomen aller anderen Geminiviren.[4]
- Segment B
- V1 (R1) – positive Orientierung: Nukleares Shuttle-Protein (ein Movement-Protein) – 33,1 kDa
- C1 (L1) – negative Orientierung: weiteres Movement-Protein – 29,6 kDa
- Diese Proteine haben Funktionen bei der intra- und interzellulären Bewegung in Wirtspflanzen.[4]
Die beiden Segmente DNA-A und DNA-B zeigen wenig Übereinstimmung in der Sequenz, mit Ausnahme einer ca. 200 nt (Nukleotide) langen Region, die als „gemeinsame Region“ (englisch common region) bezeichnet wird, und in der typischerweise mehr als 85 % Übereinstimmung besteht. Diese Region enthält eine (unter Geminiviren) absolut konservierte Haarnadelstruktur und wiederholte Sequenzen (Iterons genannt). Diese stellen Erkennungssequenzen für die Bindung des Replikationsproteins (Rep) dar. Innerhalb dieser Schleife befindet sich eine Nonanukleotid-Sequenz (TAATATTAC, d. h. 9 nt lang, daher „nona“), die als Ursprung (Ori) der Einzelstrang-DNA-Replikation des Virus fungiert. Die Haarnadelstruktur selbst wird daher auch als Stammschleife (en. stem loop) bezeichnet. Sie ist eine typische Eigenschaft von Vertretern des Phylums Cressdnaviricota (Circular Rep-encoding DNA viruses).
Bei dieser Gattung kann es zu einem Austausch zwischen den Segmenten kommen, der Pseudorekombination genannt wird: Diese erfolgt üblicherweise durch einen Prozess, der als „Regulon Grafting“ bezeichnet wird. Die A-Komponente spendet ihre gemeinsame Region durch Rekombination an die eingefangene B-Komponente. Dadurch entsteht eine neue abhängige Interaktion zwischen zwei Komponenten.[7]
Übertragung
Viren der Gattung Begomovirus werden obligat durch einen Vektor übertragen, bei dem es sich um die Tabakmottenschildlaus (Bemisia tabaci) oder um ein anderes Pflanzenlaus der Mottenschildlaus-Familie Aleyrodidae (Whitefly [en]) handeln kann. Diese Vektoren ermöglichen eine schnelle und effiziente Ausbreitung des Virus, da sie in der Wahl der von ihnen parasitierten Pflanzen sehr flexibel sind. Der Vektor überträgt das Virus persistent, zirkulierend und nicht propagierend.[8]
„The Whitefly Plan“ ist ein Dokument des Landwirtschaftsministeriums der Vereinigten Staaten (USDA), mit dem ein 5-Jahres-Plan (beginnend 1992) aufgelegt wurde, um die Mottenschildläuse zu bekämpfen (Aktualisierung 2007/2009).[9]
Krankheiten
Mehrere Begomoviren verursachen auf der ganzen Welt schwere Pflanzenkrankheiten.
Begomovirus-Spezies, die Tomaten infizieren, wie das Tomato yellow leaf curl virus (TYLCV) und das (noch ICTV-unbestätigte) „Tomato Yellow Mosaic Virus“ (ToYMV), die erstmals in den späten 1980er Jahren identifiziert wurden, verursachen weltweit erhebliche wirtschaftliche Verluste.[10] In Gebieten, in denen diese Viren weit verbreitet sind, wie z. B. Trinidad, der Dominikanischen Republik, Mexiko und weiten Teilen Mittelamerikas, Israel, sowie in ganz Südostasien, einschließlich Thailand, Kambodscha, Indonesien, Indien und Sri Lanka, können diese Krankheiten bei Tomaten und anderen Nutzpflanzen (wie Paprika und Auberginen), einen geschätzten Ertragsverlust von 50–60 % verursachen. Begomoviren, die Paprika (Capsicum spp.) befallen, wie das Pepper leaf curl virus [en] und das Chilli leaf curl virus [en], verursachen ebenfalls weltweit erhebliche Verluste. Die Krankheitssymptome an der infizierten Pflanze sind typischerweise Chlorose, Blattverzerrung, Absterben (Nekrose) der Blütenknospen und Faltenbildung (en. crinkling) sowie Verkümmerung (en. stunting). In Ländern Südostasiens, in denen diese Viren in Südostasien weit verbreitet sind, darunter Thailand, Kambodscha, Indonesien, Sri Lanka und Indien, können diese Krankheiten bei Paprika und anderen Nutzpflanzen wie Tomaten, Gurken, Kürbissen, Melonen und Auberginen einen geschätzten Ertragsverlust von 40–70 % verursachen. Die Typusspezies Bean golden yellow mosaic virus (BGYMV) verursacht eine schwere Krankheit bei Bohnenarten in Mittelamerika, der Karibik und im südlichen Florida.
Systematik
Die beiden Segmente des Genoms haben eine sehr unterschiedliche molekulare Evolutionsgeschichte und stehen wahrscheinlich unter einem sehr unterschiedlichen evolutionären Druck. Das DNA-B-Segment entstand offenbar als Satellit, der vom monopartiten Vorläufer aller existierenden bipartiten Begomoviren eingefangen wurde und sich in der Folge zu einer wesentlichen Genomkomponente entwickelt hat.
Von den Begomoviren mit monopartitem (unsegmentiertem) Genom sind über 133 Spezies bekannt, sie alle stammen aus der Alten Welt. In der Neuen Welt wurden dagegen bisher keine monopartiten Begomoviren identifiziert.[11]
Da das B-Segment zwischen Begomovirus-Spezies leicht ausgetauscht werden kann (was zu neuen Spezies führt), basieren phylogenetische Analysen hauptsächlich auf dem A-Segment.[11]
Die phylogenetische Analyse der Gattung offenbart eine Reihe von Kladen (Verwandtschaftsgruppen). Die Hauptunterteilung ist zwischen den Stämmen der Alten und Neuen Welt. Die Stämme der Alten Welt können in afrikanische, indische, japanische und andere asiatische Kladen unterteilt werden, wobei eine kleine Anzahl von Stämmen außerhalb dieser Kladen gruppiert ist. Die Stämme der Neuen Welt unterteilen sich in mittel- und südamerikanische Stämme.[11]
Neben diesen Hauptgruppierungen gibt es eine Reihe kleinerer Kladen. Eine Gruppe, die eine Reihe von Hülsenfrüchten aus Indien und Südostasien infiziert (informell „Legumovirus“ genannt) und eine Gruppe von Viren, die aus Prunkwinden und anderen Spezies der Pflanzenfamilie Convolvulaceae aus Amerika, Asien und Europa isoliert wurden (informell „Sweepovirus“),[12] scheinen basal zu allen anderen Arten zu sein. Zwei Arten, die aus der Gattung Corchorus aus Vietnam isoliert wurden (informell „Corchovirus“), gehören etwas unerwartet zu den Arten der Neuen Welt.
Mit Stand 23. Juni 2021 sind vom ICTV in der Gattung Begomovirus die folgenden Spezies bestätigt:[1]
Spezies von Maniokmosaikviren der Gattung Begomovirus, Spezies:
- African cassava mosaic Burkina Faso virus (de: Burkina-Faso-Maniokmosaikvirus)
- African cassava mosaic virus [en] [es] (ACMV, de: Afrikanisches Maniokmosaikvirus)[13][14][15]
- Cassava mosaic Madagascar virus (de: Madagaskar-Maniokmosaikvirus)
- East African cassava mosaic Cameroon virus (de: Kamerun-Maniokmosaikvirus)
- East African cassava mosaic Kenya virus (de: Kenia-Maniokmosaikvirus)
- East African cassava mosaic Malawi virus (de: Malawi-Maniokmosaikvirus)
- East African cassava mosaic virus [en] (de: Ostafrikanisches Maniokmosaikvirus)
- East African cassava mosaic Zanzibar virus (de: Sansibar-Maniokmosaikvirus)
- Indian cassava mosaic virus [en] (ICMV, de: Indisches Maniokmosaikvirus)[6]
- South African cassava mosaic virus (de: Südafrika-Maniokmosaikvirus)
- Sri Lankan cassava mosaic virus (SLCMV, de: Sri-Lanka-Maniokmosaikvirus)[6]
Andere Spezies der Gattung Begomovirus, inklusive der Gruppen „Sweepovirus“ und „Corchovirus“:
- Abutilon golden mosaic virus
- Abutilon mosaic Bolivia virus (AbMBOV)
- Abutilon mosaic Brazil virus (AbMBV)[6]
- Abutilon mosaic virus [en] [fr] (AbMV)[16]
- Ageratum enation virus
- Ageratum leaf curl Sichuan virus
- Ageratum leaf curl virus
- Ageratum yellow vein Hualian virus
- Ageratum yellow vein Sri Lanka virus
- Ageratum yellow vein virus (AYVV) [en][6]
- Allamanda leaf curl virus
- Allamanda leaf mottle distortion virus
- Alternanthera yellow vein virus
vgl. Alligatorkraut - Andrographis yellow vein leaf curl virus
vgl. Kalmegh - Asystasia mosaic Madagascar virus
Asystasia gangetica - Bean bushy stunt virus
- Bean calico mosaic virus [en]
- Bean chlorosis virus
- Bean dwarf mosaic virus
- Bean golden mosaic virus [fr] (BGMV)
- Bean golden yellow mosaic virus (BGYMV, Typus)
- Bean latent virus
- Bean leaf crumple virus
- Bean white chlorosis mosaic virus
- Bean yellow mosaic Mexico virus
- Bhendi yellow vein Bhubhaneswar virus
- Bhendi yellow vein Haryana virus
- Bhendi yellow vein mosaic Delhi virus
- Bhendi yellow vein mosaic virus [en]
(de: Okra-Gelbadernmosaikvirus) - Bitter gourd yellow mosaic virus
- Blainvillea yellow spot virus
- Blechum interveinal chlorosis virus
- Blechum yellow vein virus
- Boerhavia yellow spot virus
- Cabbage leaf curl Jamaica virus
- Cabbage leaf curl virus (CaLCuV)[6]
- Capraria yellow spot virus
- Catharanthus yellow mosaic virus
- Centrosema yellow spot virus
- Chayote yellow mosaic virus
- Chenopodium leaf curl virus
- Chilli leaf curl Ahmedabad virus
- Chilli leaf curl Bhavanisagar virus
- Chilli leaf curl Gonda virus
- Chilli leaf curl India virus
- Chilli leaf curl Kanpur virus
- Chilli leaf curl Sri Lanka virus
- Chilli leaf curl Vellanad virus
- Chilli leaf curl virus [en]
- Chino del tomate Amazonas virus
- Chino del tomate virus [en]
(CdTV, alias Tomato leaf crumple virus, CdTV) - Cleome golden mosaic virus
- Cleome leaf crumple virus
(ClLCrV, teilw. verschrieben als Cleome leaf crumble virus)[6] - Clerodendron golden mosaic virus
- Clerodendron yellow mosaic virus
- Clerodendrum golden mosaic China virus [en]
- Clerodendrum golden mosaic Jiangsu virus
- Cnidoscolus mosaic leaf deformation virus
vgl. Cnidoscolus aconitifolius - Coccinia mosaic Tamil Nadu virus
- Common bean mottle virus
- Common bean severe mosaic virus
- Corchorus golden mosaic virus
- Corchorus yellow spot virus
- Corchorus yellow vein Cuba virus
- Corchorus yellow vein mosaic virus
- Corchorus yellow vein virus
- Cotton chlorotic spot virus
- Cotton leaf crumple virus
- Cotton leaf curl Alabad virus
- Cotton leaf curl Bangalore virus
- Cotton leaf curl Barasat virus
- Cotton leaf curl Gezira virus
- Cotton leaf curl Kokhran virus
- Cotton leaf curl Multan virus
- Cotton yellow mosaic virus
- Cowpea bright yellow mosaic virus
- Cowpea golden mosaic virus
- Crassocephalum yellow vein virus
- Croton golden mosaic virus
- Croton yellow vein mosaic virus
(de: Croton-Gelbadernmosaikvirus) - Cucumber chlorotic leaf virus
- Cucurbit leaf crumple virus
- Dalechampia chlorotic mosaic virus
- Datura leaf curl virus
- Datura leaf distortion virus
- Deinbollia mosaic virus
- Desmodium leaf distortion virus
- Desmodium mottle virus
- Dicliptera yellow mottle Cuba virus
- Dicliptera yellow mottle virus
- Dolichos yellow mosaic virus
- Duranta leaf curl virus
- Eclipta yellow vein virus
- Emilia yellow vein Fujian virus
- Emilia yellow vein Thailand virus
- Emilia yellow vein virus
- Erectites yellow mosaic virus
- Eupatorium yellow vein mosaic virus
(de: Wasserdost-Gelbadernmosaikvirus) - Eupatorium yellow vein virus
(de: Wasserdost-Gelbadervirus) - Euphorbia leaf curl Guangxi virus
- Euphorbia leaf curl virus
- Euphorbia mosaic Peru virus
- Euphorbia mosaic virus [en] (EuMV)[6]
- Euphorbia yellow leaf curl virus
- Euphorbia yellow mosaic virus
- French bean leaf curl virus
- Hedyotis uncinella yellow mosaic virus
- Hemidesmus yellow mosaic virus
- Hibiscus golden mosaic virus
- Hibiscus yellow vein leaf curl virus
- Hollyhock leaf curl virus
- Hollyhock yellow vein mosaic virus
(de: Stockrosen-Gelbadernmosaikvirus) - Hollyhock yellow vein virus
- Honeysuckle yellow vein virus
- Horsegram yellow mosaic virus
- Hybanthus yellow mosaic virus
- Jacquemontia mosaic Yucatan virus
- Jacquemontia yellow mosaic virus
- Jacquemontia yellow vein virus
- Jatropha leaf curl Gujarat virus
- Jatropha leaf curl virus
- Jatropha leaf yellow mosaic virus
- Jatropha mosaic India virus
- Jatropha mosaic Nigeria virus
- Jatropha mosaic virus
- Jatropha yellow mosaic virus
- Kudzu mosaic virus
- Leonurus mosaic virus (LeMV)
- Lindernia anagallis yellow vein virus
- Lisianthus enation leaf curl virus
- Ludwigia yellow vein Vietnam virus
- Ludwigia yellow vein virus
- Luffa yellow mosaic virus
- Lycianthes yellow mosaic virus
- Macroptilium bright mosaic virus
- Macroptilium common mosaic virus
- Macroptilium golden mosaic virus
- Macroptilium mosaic Puerto Rico virus
- Macroptilium yellow mosaic Florida virus
- Macroptilium yellow mosaic virus
- Macroptilium yellow spot virus
- Macroptilium yellow vein virus
- Malvastrum bright yellow mosaic virus
- Malvastrum leaf curl Philippines virus
- Malvastrum leaf curl virus
- Malvastrum yellow mosaic Helshire virus
- Malvastrum yellow mosaic Jamaica virus
- Malvastrum yellow mosaic virus
- Malvastrum yellow vein Cambodia virus
- Malvastrum yellow vein Honghe virus
- Malvastrum yellow vein Lahore virus
- Malvastrum yellow vein virus
- Malvastrum yellow vein Yunnan virus
- Melochia mosaic virus
- Melochia yellow mosaic virus
- Melon chlorotic leaf curl virus
- Melon chlorotic mosaic virus
- Melon yellow mosaic virus
- Merremia mosaic Puerto Rico virus
- Merremia mosaic virus
- Mesta yellow vein mosaic Bahraich virus
(alias Mesta yellow vein mosaic virus, MeYVMV,
de: Mesta-Gelbadernmosaikvirus)[17] - Mimosa yellow leaf curl virus
- Mirabilis leaf curl virus
- Mungbean yellow mosaic India virus
- Mungbean yellow mosaic virus [en]
- Ocimum golden mosaic virus
- Ocimum mosaic virus
- Ocimum yellow vein virus
- Okra enation leaf curl virus
- Okra leaf curl Oman virus
- Okra mottle virus (OmoV)
- Okra yellow crinkle virus
- Okra yellow mosaic Mexico virus
- Oxalis yellow vein virus
- Papaya leaf crumple virus
- Papaya leaf curl China virus
- Papaya leaf curl Guandong virus
- Papaya leaf curl virus [en]
- Papaya severe leaf curl virus 1
- Papaya severe leaf curl virus 2
- Papaya yellow leaf curl virus
- Passionfruit leaf curl virus
- Passionfruit leaf distortion virus
- Passionfruit severe leaf distortion virus
- Pavonia mosaic virus
- Pavonia yellow mosaic virus
- Pea leaf distortion virus
- Pedilanthus leaf curl virus
- Pepper blistering leaf virus
- Pepper golden mosaic virus [en]
(alias Serrano golden mosaic virus, SGMV) - Pepper huasteco yellow vein virus [en]
- Pepper leaf curl Bangladesh virus
- Pepper leaf curl Lahore virus
- Pepper leaf curl virus [en] (PepLCV)
- Pepper leaf curl Yunnan virus
- Pepper leafroll virus
- Pepper yellow leaf curl Aceh virus
- Pepper yellow leaf curl Indonesia virus
- Pepper yellow leaf curl Indonesia virus 2
- Pepper yellow leaf curl Thailand virus
- Pepper yellow leaf curl virus
- Pepper yellow vein Mali virus
- Polygala garcinii virus
- Potato yellow mosaic Panama virus
- Potato yellow mosaic virus [en] [fr] (PYMV)[6]
- Pouzolzia golden mosaic virus
- Pouzolzia mosaic Guangdong virus
- Pouzolzia yellow mosaic virus
- Premna leaf curl virus
- Pumpkin yellow mosaic virus
- Ramie mosaic Yunnan virus
- Rhynchosia golden mosaic Havana virus
- Rhynchosia golden mosaic Sinaloa virus
- Rhynchosia golden mosaic virus
- Rhynchosia mild mosaic virus
- Rhynchosia rugose golden mosaic virus
- Rhynchosia yellow mosaic India virus
- Rhynchosia yellow mosaic virus
- Rose leaf curl virus
- Sauropus leaf curl virus
- Senecio yellow mosaic virus
- Senna leaf curl virus
- Sida angular mosaic virus
- Sida bright yellow mosaic virus
- Sida chlorotic leaf virus
- Sida chlorotic mottle virus
- Sida chlorotic vein virus
- Sida ciliaris golden mosaic virus
- Sida common mosaic virus
- Sida golden mosaic Braco virus
- Sida golden mosaic Brazil virus
- Sida golden mosaic Buckup virus
- Sida golden mosaic Costa Rica virus
- Sida golden mosaic Florida virus
- Sida golden mosaic Lara virus
- Sida golden mosaic virus
- Sida golden mottle virus
- Sida golden yellow spot virus
- Sida golden yellow vein virus
- Sida interveinal bright yellow virus
- Sida leaf curl virus
- Sida micrantha mosaic virus (SimMV)[18][6]
- Sida mosaic Alagoas virus
- Sida mosaic Bolivia virus 1
- Sida mosaic Bolivia virus 2
- Sida mosaic Sinaloa virus
- Sida mottle Alagoas virus
- Sida mottle virus
- Sida yellow blotch virus
- Sida yellow golden mosaic virus
- Sida yellow leaf curl virus
- Sida yellow mosaic Alagoas virus
- Sida yellow mosaic China virus
- Sida yellow mosaic virus (SiYMV)
- Sida yellow mosaic Yucatan virus
- Sida yellow mottle virus
- Sida yellow net virus (SiYNV)
- Sida yellow vein Vietnam virus
- Sida yellow vein virus (SiYVV)[6]
- Sidastrum golden leaf spot virus
- Siegesbeckia yellow vein Guangxi virus
- Siegesbeckia yellow vein virus
- Solanum mosaic Bolivia virus
- Soybean blistering mosaic virus
- Soybean chlorotic blotch virus
- Soybean mild mottle virus
- Spilanthes yellow vein virus
- Spinach yellow vein virus
- Squash leaf curl China virus
- Squash leaf curl Philippines virus
- Squash leaf curl virus (SLCV)[6]
- Squash leaf curl Yunnan virus
- Squash mild leaf curl virus
- Stachytarpheta leaf curl virus
- Sunn hemp leaf distortion virus
- Sweet potato golden vein Korea virus
- Sweet potato leaf curl Canary virus
- Sweet potato leaf curl China virus
- Sweet potato leaf curl Georgia virus
- Sweet potato leaf curl Guangxi virus
- Sweet potato leaf curl Henan virus
- Sweet potato leaf curl Hubei virus
- Sweet potato leaf curl Sao Paulo virus
- Sweet potato leaf curl Shandong virus
- Sweet potato leaf curl Sichuan virus 1
- Sweet potato leaf curl Sichuan virus 2
- Sweet potato leaf curl South Carolina virus
- Sweet potato leaf curl virus [en]
- Sweet potato mosaic virus
- Synedrella yellow vein clearing virus
- Telfairia golden mosaic virus
- Tobacco curly shoot virus (TbCSV)[19]
- Tobacco leaf curl Comoros virus
- Tobacco leaf curl Cuba virus
- Tobacco leaf curl Dominican Republic virus
- Tobacco leaf curl Pusa virus
- Tobacco leaf curl Thailand virus
- Tobacco leaf curl Yunnan virus
- Tobacco leaf curl Zimbabwe virus
- Tobacco leaf rugose virus
- Tobacco mottle leaf curl virus
- Tobacco yellow crinkle virus
- Tomato bright yellow mosaic virus
- Tomato bright yellow mottle virus
- Tomato chino La Paz virus
- Tomato chlorotic leaf curl virus
- Tomato chlorotic leaf distortion virus
- Tomato chlorotic mottle Guyane virus
- Tomato chlorotic mottle virus
- Tomato common mosaic virus
- Tomato curly stunt virus
- Tomato dwarf leaf virus
- Tomato enation leaf curl virus
- Tomato golden leaf distortion virus
- Tomato golden leaf spot virus
- Tomato golden mosaic virus
- Tomato golden mottle virus
- Tomato golden vein virus
- Tomato interveinal chlorosis virus
- Tomato latent virus
- Tomato leaf curl Anjouan virus
- Tomato leaf curl Arusha virus
- Tomato leaf curl Bangalore virus
- Tomato leaf curl Bangladesh virus
- Tomato leaf curl Burkina Faso virus
- Tomato leaf curl Cebu virus
- Tomato leaf curl China virus [en]
- Tomato leaf curl Comoros virus
- Tomato leaf curl Diana virus
- Tomato leaf curl Ghana virus
- Tomato leaf curl Guangdong virus
- Tomato leaf curl Guangxi virus
- Tomato leaf curl Gujarat virus
- Tomato leaf curl Hainan virus
- Tomato leaf curl Hanoi virus
- Tomato leaf curl Hsinchu virus
- Tomato leaf curl Iran virus
- Tomato leaf curl Japan virus
- Tomato leaf curl Java virus
- Tomato leaf curl Joydebpur virus
- Tomato leaf curl Karnataka virus
- Tomato leaf curl Karnataka virus 2
- Tomato leaf curl Karnataka virus 3
- Tomato leaf curl Kerala virus
- Tomato leaf curl Kunene virus
- Tomato leaf curl Laos virus
- Tomato leaf curl Liwa virus
- Tomato leaf curl Madagascar virus
- Tomato leaf curl Mahe virus
- Tomato leaf curl Malaysia virus
- Tomato leaf curl Mali virus
- Tomato leaf curl Mindanao virus
- Tomato leaf curl Moheli virus
- Tomato leaf curl Namakely virus
- Tomato leaf curl New Delhi virus [fr]
- Tomato leaf curl New Delhi virus 2
- Tomato leaf curl New Delhi virus 4
- Tomato leaf curl New Delhi virus 5
- Tomato leaf curl Nigeria virus
- Tomato leaf curl Palampur virus
- Tomato leaf curl Patna virus
- Tomato leaf curl Philippines virus
- Tomato leaf curl Pune virus
- Tomato leaf curl purple vein virus
- Tomato leaf curl Rajasthan virus
- Tomato leaf curl Seychelles virus
- Tomato leaf curl Sinaloa virus
- Tomato leaf curl Sri Lanka virus
- Tomato leaf curl Sudan virus
- Tomato leaf curl Sulawesi virus
- Tomato leaf curl Taiwan virus
- Tomato leaf curl Tanzania virus
- Tomato leaf curl Toliara virus
- Tomato leaf curl Uganda virus
- Tomato leaf curl Vietnam virus
- Tomato leaf curl virus
- Tomato leaf deformation virus
- Tomato leaf distortion virus
- Tomato mild mosaic virus
- Tomato mild yellow leaf curl Aragua virus
- Tomato mosaic Havana virus
- Tomato mosaic severe dwarf virus
- Tomato mottle leaf curl virus
- Tomato mottle Taino virus
- Tomato mottle virus
- Tomato mottle wrinkle virus
- Tomato rugose mosaic virus
- Tomato rugose yellow leaf curl virus
- Tomato severe leaf curl Kalakada virus
- Tomato severe leaf curl virus
- Tomato severe rugose virus
- Tomato twisted leaf virus
- Tomato vein clearing leaf deformation virus
- Tomato wrinkled mosaic virus
- Tomato yellow leaf curl Axarquia virus
- Tomato yellow leaf curl China virus [en] (TYLCCNV)[19]
- Tomato yellow leaf curl Guangdong virus
- Tomato yellow leaf curl Indonesia virus
- Tomato yellow leaf curl Kanchanaburi virus
- Tomato yellow leaf curl Malaga virus (TYLCMalV)[6]
- Tomato yellow leaf curl Mali virus
- Tomato yellow leaf curl Sardinia virus (TYLCSV)[6]
- Tomato yellow leaf curl Shuangbai virus
- Tomato yellow leaf curl Thailand virus
- Tomato yellow leaf curl Vietnam virus
- Tomato yellow leaf curl virus [en] [fr] (TYLCV)[14]
- Tomato yellow leaf curl Yunnan virus
- Tomato yellow leaf deformation dwarf virus
- Tomato yellow leaf distortion virus
- Tomato yellow margin leaf curl virus
- Tomato yellow mottle virus
- Tomato yellow spot virus
- Tomato yellow vein streak virus
- Triumfetta yellow mosaic virus
- Velvet bean golden mosaic virus
- Velvet bean severe mosaic virus
- Verbena mottle virus
- Vernonia crinkle virus
- Vernonia yellow vein Fujian virus
- Vernonia yellow vein virus
- Vigna yellow mosaic virus
(de: Augenbohnenmosaikvirus) - Vinca leaf curl virus
- Watermelon chlorotic stunt virus
- West African Asystasia virus 1
- West African Asystasia virus 2
- West African Asystasia virus 3
- Whitefly-associated begomovirus 1
- Whitefly-associated begomovirus 2
- Whitefly-associated begomovirus 3
- Whitefly-associated begomovirus 4
- Whitefly-associated begomovirus 6
- Whitefly-associated begomovirus 7
- Wissadula golden mosaic virus
- Wissadula yellow mosaic virus
Vorgeschlagene Mitgliedsspezies (Auswahl) gemäß angegebener Referenz:
- „Acalypha yellow mosaic virus“[20]
- „Cyamopsis tetragonoloba leaf curl Sikar virus“[21]
- „Cyamopsis tetragonoloba leaf curl virus“ (CyTLCuV)[22][23]
- „Tomato yellow mosaic virus“ (ToYMV, de: „Tomaten-Gelbmosaikvirus“)[24]
- „Zinnia leaf curl virus“[25]
Anmerkung: Viele dieser Spezies findet man auch als „bigeminivrus“ bezeichnet, oft ist dann nur der letzte Namensteil ‚virus‘ durch ‚bigeminivirus‘ ersetzt. Offenbar ist „Bigeminivirus“ als ein älteres Synonym für Begomovirus zu verstehen, anders als „Legumovirus“ oder „Sweepovirus“ die ausdrücklich Teilgruppen bezeichnen. Siehe etwa Brunt et al. (1996).[26][27]
Einzelnachweise
- ICTV: ICTV Master Species List 2020.v1, New MSL including all taxa updates since the 2019 release, March 2021 (MSL #36)
- Viral Zone. ExPASy. Abgerufen am 28. April 12021.
- Martin Ackermann: Wege in die Biotechnologie – 25 Jahre Nachwuchsförderung, auf: silo.tips vom 13. März 2017. Links auf „Download PDF“ klicken!
- ICTV: ssDNA Viruses > Geminiviridae – Genus: Begomovirus, Virus Taxonomy – ICTV Report, Revision vom 24. Augst 2020
- Notes on Genus: Begomovirus, auf: dpvweb.net (via WebArchiv vom 18. Januar 2020)
- ZKBS: Stellungnahme der ZKBS zur Risikobewertung von nachfolgend aufgelisteten Vertretern der Familie der Geminiviridae als Spender- und Empfängerorganismen für gentechnische Arbeiten gemäß § 5 Absatz 1 GenTSV: …, Az.: 6790-10-98, September 2010
- Pita JS, Fondong VN, Sangaré A, Otim-Nape GW, Ogwal S, Fauquet CM: Recombination, pseudorecombination and synergism of geminiviruses are determinant keys to the epidemic of severe cassava mosaic disease in Uganda. In: J Gen Virol. 82, Nr. 3, 2001, S. 655–665. doi:10.1099/0022-1317-82-3-655. PMID 1112108.
- Funayama, Sachiko, I Terashima, T Yahara: Effects of Virus Infection and Light Environment on Population Dynamics of Eupatorium makinoi (Asteraceae). In: American Journal of Botany. 88, Nr. 4, 2001, S. 616–622. doi:10.2307/2657060. PMID 11302846.
- Jim DeQuattro, Dennis Senft, Marcia Wood: The Whitefly Plan: A five-year Update, United States Department of Agriculture (USDA): Agricultural Research Service. 6. Februar 2007/14. April 2009
- Eui-Joon Kil, Sunhoo Kim, Ye-Ji Lee, Hee-Seong Byun, Jungho Park, Haneul Seo, Chang-Seok Kim, Jae-Kyoung Shim, Jung-Hwan Lee: Tomato yellow leaf curl virus (TYLCV-IL): a seed-transmissible geminivirus in tomatoes. In: Scientific Reports. 6, Nr. 1, 8. Januar 2016, ISSN 2045-2322, S. 19013. bibcode:2016NatSR...619013K. doi:10.1038/srep19013. PMID 26743765. PMC 4705557 (freier Volltext).
- Briddon RW, Patil BL, Bagewadi B, Nawaz-ul-Rehman MS, Fauquet CM: Distinct evolutionary histories of the DNA-A and DNA-B components of bipartite begomoviruses. In: BMC Evol Biol. 10, 2010, S. 97. doi:10.1186/1471-2148-10-97. PMID 20377896. PMC 2858149 (freier Volltext).
- Camila G. Ferro, Murilo Zerbini, Jesús Navas-Castillo, Elvira Fiallo-Olivé: Revealing the Complexity of Sweepovirus-Deltasatellite–Plant Host Interactions: Expanded Natural and Experimental Helper Virus Range and Effect Dependence on Virus-Host Combination, in: MDPI Microorganisms, Band 9, Nr. 5, 10. Mai 2021, Special Issue Plant Viruses: From Ecology to Control, 1018, doi:10.3390/microorganisms9051018. Zitat: „Sweepoviruses are begomoviruses (genus Begomovirus, family Geminiviridae) with ssDNA genomes infecting sweet potato and other species of the family Convolvulaceae.“
- Krankheiten / Parasiten, auf: cassava.ch, ETH Zürich, Institut für Lebensmittel- und Ernährungswissenschaften, Januar 2009
- Helmine Braitmaier: Pflanzenviren – jenseits von Gut und Böse, auf: Universität Stuttgart: Magazi forschung leben, Ausgabe 7/2016
- B. C. Ahohuendo and S. Sarkar: Partial control of the spread of African cassava mosaic virus in Benin by intercropping / Partielle Bekämpfung der Verbreitung des Afrikanischen Maniokmosaikvirus in Benin durch Mischkultur (Partial control of the spread of African cassava mosaic virus in Benin by intercropping), in: Zeitschrift für Pflanzenkrankheiten und Pflanzenschutz (Journal of Plant Diseases and Protection), Band 102, Nr. 3, S. 249–256, 1995, ISSN 0340-8159, Eugen Ulmer GmbH & Co., Stuttgart
- Björn Krenz: Gene Silencing und das Abutilon Mosaik Virus, Dissertation, Universität Stuttgart, Fakultät Geo- und Biowissenschaften, 2007
- Arpita Chatterjee, Subrata Kumar Ghosh: Yellow Vein Mosaic Disease: A New Threat to Mesta (Hibiscus sp.) Cultivation, in: L. P. Awasthi (Hrsg.): Recent Advances in the Diagnosis and Management of Plant Diseases. Springer, New Delhi. 2015. S. 145–161. doi:10.1007/978-81-322-2571-3_13. ISBN 978-81-322-2571-3.
- NCBI: Sida micrantha mosaic virus (species)
- Yan Xie, Peijun Wu, Pei Liu, Huanran Gong, Xueping Zhou: Characterization of alphasatellites associated with monopartite begomovirus/betasatellite complexes in Yunnan, China. In: Virol. J.. 7, 2010, S. 178. doi:10.1186/1743-422X-7-178. PMID 20678232. PMC 2922188 (freier Volltext).
- NCBI: Acalypha yellow mosaic virus (species)
- NCBI: Cyamopsis tetragonoloba leaf curl Sikar virus (species)
- J. Kumar, A. Kumar, J. K. Roy, R. Tuli, J. A. Khan: Identification and molecular characterization of begomovirus and associated satellite DNA molecules infecting Cyamopsis tetragonoloba. In: Virus Genes. 41, Nr. 1, August 2010, S. 118–125. doi:10.1007/s11262-010-0482-7. PMID 20405195.
- NCBI: Cyamopsis tetragonoloba leaf curl virus (species)
- NCBI: Tomato yellow mosaic virus (species)
- NCBI: Zinnia leaf curl virus (species)
- A. A. Brunt, K. Crabtree, M. J. Dallwitz, A. J. Gibbs, L. Watson, E. J. Zurcher, E. J. (Hrsg.): Bigeminiviruses: Geminiviridae, auf: Plant Viruses Onlinee: Descriptions and Lists from the VIDE Database. Version: 20th August 1996.
- Thierry Candresse, Hervé Lapierre, Hervé Lecoq, Jean Bernard Quiot, Mark Tepfer: Classes de risques des agents phytopathologenes et insectes nuisibles aux cultures (rtf), Propositions élaborées par des groupes de spécialistes de l’I.N.R.A., Oktober 1998 (französisch)
Weblinks
- Notes on Genus: Begomovirus, auf: dpvweb.net (via WebArchiv vom 18. Januar 2020)
- Fact sheet: Tomato Yellow Leaf Curl Virus (TYLCV), AVRDC – The World Vegetable Center (via WebArchiv vom 10. Juli 2018)
- MicrobiologyBytes: Virology: Plant Viruses (via WebArchiv vom 24. Februar 2007)
- Sephra N. Rampersad: Proposed Strategies for Begomovirus Disease Management in Tomato in Trinidad, in: Plant Management Network, 6. Oktober 2003, doi:10.1094/PHP-2003-1006-01-HM
- EMBL-EBI: Viruses Genomes - Bean golden yellow mosaic virus (via WebArchiv vom 15. Mai 2011)
- SIB: Begomovirus,auf: Expasy ViralZone
- Shahid Mansoor, Rob W. Briddon, Yusuf Zafar, John Stanley: Geminivirus disease complexes: an emerging threat. In: Trends Plant Sci.. 8, Nr. 3, März 2003, S. 128–134. doi:10.1016/S1360-1385(03)00007-4. PMID 12663223.
- Rob W. Briddon, John Stanley: Subviral agents associated with plant single-stranded DNA viruses. In: Virology. 344, Nr. 1, Januar 2006, S. 198–210. doi:10.1016/j.virol.2005.09.042. PMID 16364750. PDF
- Xiomara H. Sinisterra, C. L. McKenzie, Wayne B. Hunter, Charles A. Powell, Robert G. Shatters Jr: Differential transcriptional activity of plant-pathogenic begomoviruses in their whitefly vector (Bemisia tabaci, Gennadius: Hemiptera Aleyrodidae). In: J. Gen. Virol.. 86, Nr. Pt 5, Mai 2005, S. 1525–1532. doi:10.1099/vir.0.80665-0. PMID 15831966.
- W. B. Hunter, E. Hiebert, S. E. Webb, J. H. Tsai, J. E. Polston: Location of geminiviruses in the whitefly Bemisia tabaci (Homoptera: Aleyrodidae). In: Plant Disease. 82, Nr. 10, 1998, S. 1147–1151. doi:10.1094/PDIS.1998.82.10.1147. PMID 30856777.