Barrelen
Barrelen ist eine chemische Verbindung aus der Gruppe der ungesättigten bicylischen aliphatischen Kohlenwasserstoffe. Der Name wurde 1960 im Zuge der Veröffentlichung der Erstsynthese von Howard Zimmerman wegen der tonnenförmigen Form (englisch: Barrel) der π-Elektronenwolke geprägt.[2]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
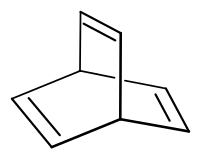 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Barrelen | ||||||||||||
| Andere Namen |
Bicyclo[2.2.2]octa-2,5,7-trien (IUPAC) | ||||||||||||
| Summenformel | C8H8 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 104,15 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Synthese
Die Synthese von Barrelen geht von Cumalinsäure 1 aus, die kupferkatalysiert bei 650 °C im Vakuum zum 2-Pyron 2 decarboxyliert. Umsetzung mit Methylvinylketon 3 in einer decarboxylierenden zweifachen Diels-Alder-Reaktion ergibt zusammen mit isomeren Nebenprodukten das bicyclische Diketon 4. Mit Hydroxylamin wird diese Verbindung in das Dioxim 5 überführt. Das Dioxim wird mit p-Tosylchlorid zum Ditosylat derivatisiert, das unter alkalischen Bedingungen in einer Beckmann-Umlagerung in das Diamid 6 übergeht. Durch alkalische Hydrolyse des Diamids erhält man das Diamin 7. Dieses wird mit Methyliodid und Natriumhydroxid in den Bis(trimethylammonium)bicyclus 8 überführt. Durch eine doppelte Hofmann-Eliminierung erhält man im letzten Schritt das Barrelen 9.[2][3]
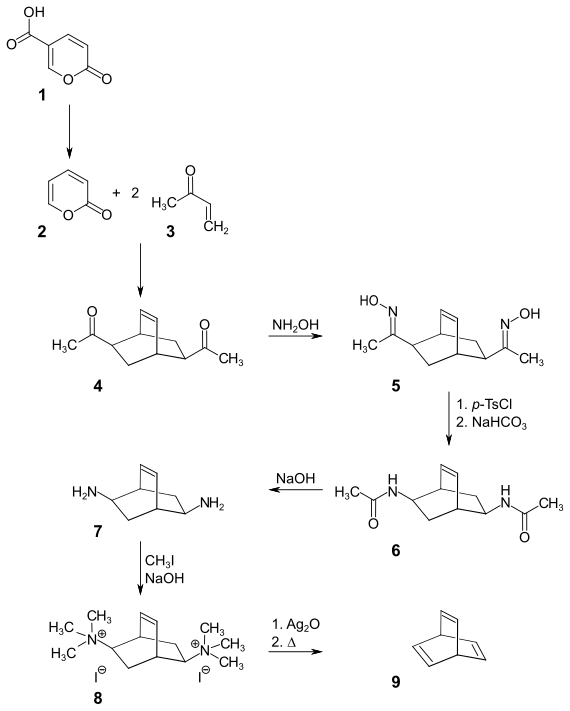
Eine Variante dieser Synthese besteht in der Verwendung von Acrylsäuremethylester anstelle des Methylvinylketons als Dienophil.[3]
Eigenschaften
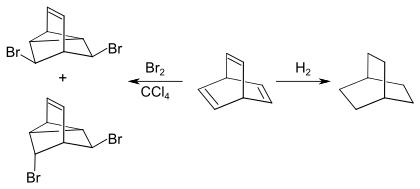
Bei der Bromierung von Barrelen in Tetrachlorkohlenstoff nimmt die Verbindung eine äquimolare Brom auf und es bildet sich ein einfach ungesättigtes tricyclisches Dibromid. Bei der katalytischen Hydrierung erhält man das gesättigte Bicyclo[2.2.2]octan[4][3]
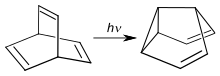
Durch photochemische Isomerisierung von Barrelen erhält man das Valenzisomer Semibullvalen und als Nebenprodukt Cyclooctatetraen.[5] Bei dieser Reaktion handelt es sich um eine Di-π-Methan-Umlagerung.[6]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Howard E. Zimmerman, Robert M. Paufler: BICYCLO[2,2,2]-2,5,7-OCTATRIENE (BARRELENE), A UNIQUE CYCLIC SIX ELECTRON PI SYSTEM. In: Journal of the American Chemical Society. Band 82, Nr. 6, März 1960, S. 1514, doi:10.1021/ja01491a071.
- Howard E. Zimmerman, Gary L. Grunewald, Robert M. Paufler, Maynard A. Sherwin: Synthesis and physical properties of barrelene, a unique Moebius-like molecule. In: Journal of the American Chemical Society. Band 91, Nr. 9, April 1969, S. 2330, doi:10.1021/ja01037a024.
- Externe Identifikatoren von bzw. Datenbank-Links zu Bicyclo[2.2.2]octan: CAS-Nummer: 280-33-1, PubChem: 9235, ChemSpider: 8880, Wikidata: Q83052931.
- Howard E. Zimmerman, Gary L. Grunewald: The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene. In: Journal of the American Chemical Society. Band 88, Nr. 1, Januar 1966, S. 183, doi:10.1021/ja00953a045.
- Thomas Laue, Andreas Plagens: Namen- und Schlagwort-Reaktionen der Organischen Chemie. 2. Auflage. B. G. Teubner, Stuttgart 1994, ISBN 978-3-519-13526-5, S. 102 (eingeschränkte Vorschau in der Google-Buchsuche).