Anilingelb
Anilingelb (p-Aminoazobenzol) ist ein gelber Azofarbstoff. Es ist ein Derivat des Azobenzols und gleichzeitig ein aromatisches Amin.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
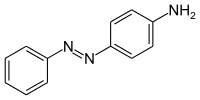 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Anilingelb | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C12H11N3 | ||||||||||||||||||
| Kurzbeschreibung |
gelbe Blättchen oder Nadeln[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 197,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,19 g·cm−3 [1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
> 360 °C [1] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend (CMR)[4] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Anilingelb war der erste synthetische Azofarbstoff.
1860 beschrieb der deutsche Chemiker Peter Grieß[6] die Synthese einer in goldgelben Plättchen kristallisierenden explosiven Substanz, die er durch Einwirken Salpetriger Säure auf eine alkoholische Anilinlösung erhalten hatte, bevor im Jahr darauf C. Mene[7] und Hugo Schiff[8] die Gewinnung eines gelben Farbstoffs beschrieben, den sie im ersten Fall wieder durch Einwirkung Salpetriger Säure auf Anilin, im zweiten Fall dagegen durch Einwirkung von Natriumstannat bzw. Natriumantimonat als Oxidationsmitteln auf Anilin gewonnen hatten.
Simpson, Maule und Nicholson, die diesen Farbstoff 1864 als zweiten Azofarbstoff (nach dem 1863 entdeckten und noch im selben Jahr auf den Markt gebrachten Anilinschwarz) in den Handel brachten, nahmen dabei zunächst an, dass das nach dem Verfahren von C. Mene hergestellte Anilingelb und die von Grieß beschriebene Substanz identisch seien. Weshalb sie dabei die explosiven Eigenschaften des letzteren komplett ignorierten, ist unbekannt.
Die Diskrepanz gab Anlass zu weiteren Untersuchungen durch Grieß selbst und Carl Alexander von Martius,[9] die zeigten, dass das von Grieß 1860 hergestellte „Diazoamidobenzol“ sich in siedender Salzsäure unter Stickstoffabspaltung in Phenol und Anilin zersetzt, während das als Oxalat des „Amidodiphenylimids“ im Handel befindliche Anilingelb unter gleichen Bedingungen weder eine Stickstoffentwicklung noch Phenol und Anilin als Zersetzungsprodukte aufweist. Hinzu kam, dass das nach dem Verfahren von Mene hergestellte Anilingelb deutlich basisch reagierte, während Grieß' „Diazoamidobenzol“ kaum basisches Verhalten an den Tag legte.
Da die ringförmige Struktur des Benzols[10] zu diesem Zeitpunkt noch weitgehend unbekannt war, konnten sie zur genauen Struktur der beiden Verbindungen keine näheren Aussagen machen, erkannten aber anhand ihrer gleichen elementaren Zusammensetzung immerhin schon ihren isomeren Charakter und die Tatsache, dass beide in dieselbe Klasse gehören wie das von Mitscherlich entdeckte gefundene Azobenzol.[11][12]
Das wichtigste Resultat dieser Untersuchungen indes war die Feststellung, dass die Entstehung des einen oder des anderen Produktes abhängig von der Temperatur war: Während in der Kälte die Bildung des explosiven „Diazoamidobenzols“ überwog, führte Zufuhr von Wärme zur Bildung des „Amidodiphenylimids“ bzw. Anilingelbs.
Aus heutiger Sicht kann man die Resultate wie folgt interpretieren:
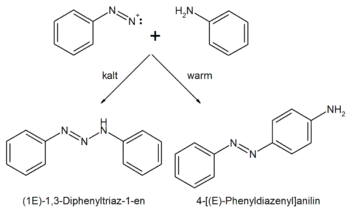
Nachdem das Anilin wie bekannt diazotiert wird (siehe Diazotierung), reagiert das entstandene Diazoniumkation in der Wärme mit einem weiteren Anilinmolekül zum thermodynamisch stabileren p-Aminoazobenzol (IUPAC: 4-[(E)-Phenyldiazenyl]anilin, thermodynamische Kontrolle), bei niedriger Temperatur dagegen mit dem Stickstoffatom der Aminogruppe des Anilins als dessen nukleophilster Stelle unter Bildung eines Triazens (IUPAC: (1E)-1,3-Diphenyltriaz-1-en, kinetische Produktkontrolle).
Gewinnung und Darstellung
Anilingelb lässt sich durch Einwirkung von Salpetriger Säure auf Anilin erhalten, sowie durch saure Umlagerung von 1,3-Diphenyltriazen.
Eigenschaften
Anilingelb kristallisiert in gelben Nadeln oder Blättchen, amorphes Anilingelb ist ein oranges Pulver, das stark karzinogen ist und darüber hinaus im Verdacht steht, mutagen zu sein.
Nachweis
Kurzbeschreibung: Reduktion der Probe mit Dithionit, Extraktion der aromatischen Amine mit MTBE und chromatographischer Nachweis der Amine (TLC, HPLC-DAD/MSD).
Verwendung
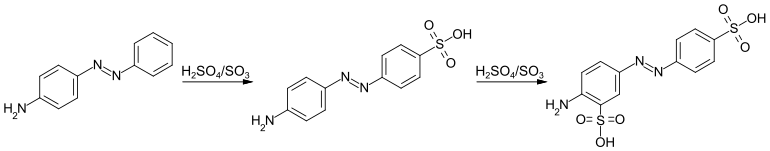
Durch Sulfierung von Anilingelb mit 25 % Oleum (Schwefelsäure mit 25 Gew.-% SO3) erhält man den Farbstoff Acid Yellow 9. Dabei wird im ersten Schritt die zur Azogruppe paraständige Sulfonsäuregruppe eingeführt.[13]
Anilingelb wurde unter anderem als Anfärbemittel in der Mikroskopie verwendet.[14]
Rechtsstatus
Anilingelb ist als karzinogenes Amin in der Liste der aromatischen Amine, für die in der EU gesetzliche Grenzwerte festgelegt sind, enthalten (2008: 30 ppm). Der Import und Vertrieb von Bedarfsgegenständen, die die festgelegten Grenzwerte überschreiten, ist in der EU verboten. Die Umsetzung in nationales Recht erfolgt über die Bedarfsgegenständeverordnung. Die Bestimmung erfolgt nach der Analysemethode in der amtlichen Sammlung von Untersuchungsverfahren § 35 des LMBG unter der Gliederungsnummer B−82.02.
Literatur
- Eintrag zu 4-Aminoazobenzol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Januar 2015.
Einzelnachweise
- Eintrag zu 4-Aminoazobenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Handbook of Chemistry and Physics, 70th edition, 1989–1990.
- Eintrag zu 4-aminoazobenzene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 17. Juli 2014.
- Eintrag zu Aniline Yellow in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 17. August 2021.
- Peter Griess: Vorläufige Notiz über einige neue Verbindungen, welche Wasserstoff durch Stickstoff vertreten enthalten. In: Annalen der Chemie und Pharmacie. 113, 1860, S. 334, doi:10.1002/jlac.18601130307.
- C. Mene: Wagner's Jahresberichte 7, 1861. S. 496.
- H. Schiff: Weitere Untersuchungen über Anilinfarben. In: Annalen der Chemie und Pharmacie. 127, 1863, S. 342, doi:10.1002/jlac.18631270310.
- C. A. Martius, P. Griess: Ueber das Amidodiphenylimid, eine neue organische Base. In: Journal für Praktische Chemie. 97, 1866, S. 257, doi:10.1002/prac.18660970134.
- F. A. Kekulé: Zeitschrift für Chemie 6 (1865); S. 176.
- E. Mitscherlich: Annalen der Physik und Chemie XXXII (1834). S. 224.
- E. Mitscherlich: Ueber das Stickstoffbenzid. In: Annalen der Pharmacie. 12, 1834, S. 311, doi:10.1002/jlac.18340120282.
- Hans Eduard Fierz-David, Louis Blangey: Grundlegende Operationen der Farbenchemie. 5. Auflage. Springer-Verlag, Wien 1943, ISBN 978-3-662-01821-7, S. 257 (eingeschränkte Vorschau in der Google-Buchsuche).
- R. L. Howey: Vital Staining for Protozoa and Related Temporary Mounting Techniques. 2000.

