Natriumstannat
Natriumstannat ist ein Natrium-Salz der Zinnsäure. Es tritt in verschiedenen Spezies auf.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
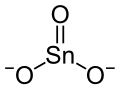 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumstannat | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel |
| ||||||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 212,67 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Natriumstannat gewinnt man durch Auflösung von Zinn(IV)-oxid in überschüssiger, konzentrierter und etwa 100 °C heißer Natronlauge, wobei das Trihydrat entsteht.[4] Durch direktes Schmelzen von Zinn(IV)-oxid und Natriumhydroxid entsteht das Anhydrat.[5]
Auf ähnliche Weise kann Natriumstannat durch Reaktion von Zinn oder Zinn(IV)-sulfid mit heißer Natronlauge gewonnen werden.[6][7]
Es bildet sich auch bei der Reaktion von Natriumstannit mit Luftsauerstoff.[6]
Effektive industrielle Methoden erfolgen zum Beispiel durch Reaktion von Natriumcarbonat und Zinn(IV)-oxid aus Cassiterit bei etwa 850 °C.[8]
Eigenschaften
Natriumstannat-Trihydrat ist ein farbloses kristallines Pulver (dünne, sechsseitige Plättchen), das in Wasser sehr leicht löslich ist, wobei die Löslichkeit mit steigender Temperatur stark abnimmt. Es enthält stets geringe Mengen von Natriumhydroxid adsorbiert und ist sehr empfindlich gegen Kohlendioxid. Es besitzt eine rhomboedrische Kristallstruktur mit der Raumgruppe R3 (Raumgruppen-Nr. 148) (a = 5,84 Å, a = 61,2°) mit einer Überstruktur des Cadmium(II)-iodid-Typs.[4] Das Trihydrat kann nicht in das Anhydrat überführt werden[9] und zersetzt sich bei 140 °C.[3]
Verwendung
Natriumstannat wird verwendet:[10]
- als Gelbildner
- zur Herstellung von reinem Zinn, anderen Stannaten und Zinnverbindungen
- als Bestandteil von Elektrolyten zur Verzinnung
- als Beschichtungsmaterial (Papier)
Das hauptsächlich verwendete Hexahydroxo-Salz Na2[Sn(OH)6][11] wird auch als Natriumhexahydrostannat, Natriumhexahydroxostannat, Präpariersalz oder Grundiersalz bezeichnet.[12][13] Es kann aber auch als das Trihydrat des einfachen Natriumstannates aufgefasst werden: Na2SnO3·3 H2O.
Einzelnachweise
- Eintrag zu SODIUM STANNATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. April 2020.
- Datenblatt Sodium tin(IV) oxide hydrate bei AlfaAesar, abgerufen am 4. Februar 2018 (PDF) (JavaScript erforderlich).
- William M. Haynes: CRC Handbook of Chemistry and Physics, 94th Edition. CRC Press, 2013, ISBN 978-1-4665-7115-0, S. 91 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1771.
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 978-3-11-022566-2, S. 552 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ananya Ganguly: Fundamentals of Inorganic Chemistry for Competitive Examinations. ISBN 81-317-7622-0, S. 9 (eingeschränkte Vorschau in der Google-Buchsuche).
- Anil Kumar De: A Text Book of Inorganic Chemistry. New Age International, 2007, ISBN 81-224-1384-6, S. 379 (eingeschränkte Vorschau in der Google-Buchsuche).
- Yuanbo Zhang, Zijian Su, Bingbing Liu, Zhixiong You, Guang Yang, Guanghui Li, Tao Jiang: Sodium stannate preparation from stannic oxide by a novel soda roasting–leaching process. In: Hydrometallurgy. 146, 2014, S. 82, doi:10.1016/j.hydromet.2014.03.008.
- Bernard Moody: Comparative Inorganic Chemistry. Elsevier, 2013, ISBN 978-1-4832-8008-0, S. 332 (eingeschränkte Vorschau in der Google-Buchsuche).
- EChinaChem (Memento vom 28. September 2007 im Internet Archive)
- Hans P. Latscha,Helmut A. Klein: Anorganische Chemie: Chemie-Basiswissen I. Springer, 2007, ISBN 978-3-540-69863-0 (Seite 327 in der Google-Buchsuche).
- wissen.de: Präpariersalz, abgerufen am 6. August 2021.
- Präpariersalz. In: Meyers Großes Konversations-Lexikon. 6. Auflage. Band 7, Bibliographisches Institut, Leipzig/Wien 1907, S. 203.
