Ammoniumcarbonat
Ammoniumcarbonat, (NH4)2CO3 · H2O, bildet wasserlösliche, farblose, kubische Kristalle. Es zerfällt ab 58 °C vollständig in Ammoniak, Kohlenstoffdioxid und Wasser.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
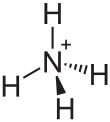 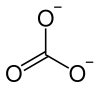 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Ammoniumcarbonat | ||||||||||||
| Andere Namen | |||||||||||||
| Summenformel | CH8N2O3 | ||||||||||||
| Kurzbeschreibung |
hygroskopischer farbloser Feststoff mit ammoniakartigem Geruch[3] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | |||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte | |||||||||||||
| Schmelzpunkt | |||||||||||||
| Dampfdruck | |||||||||||||
| Löslichkeit |
gut in Wasser (320 g·l−1 bei 20 °C)[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||
| ΔHf0 |
−942 kJ·mol−1[7] | ||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Eigenschaften
Das Salz bildet ein farbloses, schwach nach Ammoniak riechendes Pulver. Es hat eine Dichte um 1,6 g·cm−3 (bei 20 °C). In wässriger Lösung reagiert dieses Salz, das als Kation eine schwache Säure, und als Anion eine schwache Base hat, leicht basisch. Der pH-Wert ist die Folge eines komplizierten Gleichgewichts, das sich gemäß der Salzhydrolyse einstellt zwischen gelöstem Ammoniak NH3, Ammoniumionen NH4+, Carbonationen CO32−, Hydrogencarbonationen HCO3− und Kohlenstoffdioxid CO2. Der pH-Wert einer 10%igen wässrigen Lösung von Ammoniumcarbonat liegt bei 9,4.[6]
Das Salz Ammoniumcarbonat reagiert also im Zuge der Auflösung in Wasser zu Hydrogencarbonat- und Hydroxidionen. Eine wässrige Lösung von Ammoniumcarbonat ist daher nur im neutralen und schwach basischen Milieu beständig – bei Zugabe starker Säuren entweicht gasförmiges Kohlenstoffdioxid, bei Zugabe konzentrierter Laugen entweicht Ammoniakgas.
Als Trockensubstanz zersetzt sich Ammoniumcarbonat an der Luft langsam, beim Erhitzen erfolgt die Zersetzung heftig.[6]
Gewinnung und Darstellung
Die Darstellung von Ammoniumcarbonat kann durch Umsetzung von Kohlenstoffdioxid mit Ammoniak in wässriger Lösung erfolgen.
Eine weitere Darstellungsmöglichkeit ergibt sich durch Erhitzen von Calciumcarbonat zusammen mit Ammoniumsulfat.
Bei letzterer Methode sublimieren neben dem gewünschten Ammoniumcarbonat auch noch Ammoniumhydrogencarbonat und Ammoniumcarbamat ab, als Feststoff bleibt Calciumsulfat zurück.
Verwendung
Ammoniumcarbonat wird in der Synthese von Heterocyclen und als Zusatzstoff von fotografischen Entwicklern eingesetzt. Ebenso findet es in der Färberei als Beize, als Detachiermittel und als Kohlendioxid-Entwickler in Löschgeräten Verwendung.
Zudem wird es als Backtriebmittel (als Bestandteil von Hirschhornsalz) genutzt. In der EU ist es als Lebensmittelzusatzstoff der Nummer E 503i zugelassen.
Es wurde ebenfalls früher als Riechsalz zur Belebung bei Schwindel- und Ohnmachtsanfällen unter die Nase gehalten.
Ammoniumcarbonat wird häufig in der Anorganischen Chemie für eine Qualitative Analyse verwendet, um im Kationentrenngang aus einer unbekannten Probe die Erdalkalimetallkationen von Barium, Strontium und Calcium als eine Gruppe auszufällen, aufzutrennen und mit Hilfe von Nachweisreaktionen zu identifizieren.
Weiterhin wird es zur Herstellung von Katalysatoren, Schaumstoffen, Haarbehandlungsmitteln und Caseinfarben und -leimen verwendet.[6]
Einzelnachweise
- Eintrag zu E 503: Ammonium carbonates in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Eintrag zu AMMONIUM CARBONATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Datenblatt Ammoniumcarbonat (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons. William Andrew, 2014, ISBN 978-0-323-29060-9, S. 265 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Ammoniumcarbonat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- Eintrag zu Ammoniumcarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. Februar 2021. (JavaScript erforderlich)
- PAETEC Formelsammlung Ausgabe 2003, S. 116.
