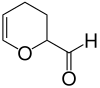
3,4-Dihydro-2H-pyran-2-carboxaldehyd
3,4-Dihydro-2H-pyran-2-carboxaldehyd, oft als Acrolein-Dimer bezeichnet, entsteht bei der thermischen Dimerisierung von Acrolein[5], wobei 2-Propenal in einer Diels-Alder-Reaktion zugleich als Dien und Dienophil fungiert. Bei hohen Temperaturen (>400 °C[6]) wird das Dimer wieder in Acrolein zurückgespalten.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 3,4-Dihydro-2H-pyran-2-carboxaldehyd | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H8O2 | |||||||||||||||
| Kurzbeschreibung |
klare, farblose, stechend riechende Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 112,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
wasserlöslich[1], mischbar mit Diethylether, Aceton, Tetrahydrofuran, 1,4-Dioxan und Dichlormethan, wenig löslich in Benzol[3] | |||||||||||||||
| Brechungsindex |
1,466 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
Acrolein 1 reagiert unter Druck und erhöhter Temperatur in Gegenwart von Polymerisationsinhibitoren, wie z. B. Hydrochinon, mit sich selbst in einer [4+2]-Cycloaddition zum cyclischen Dimer (2-Formyl-3,4-dihydro-2H-pyran) 2.[7][3][8][9]
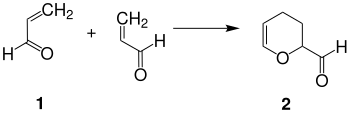
Die Dimerisierung des Acroleins kann auch durch Mikrowellenbestrahlung mit einer Ausbeute von 91 % d.Th. innerhalb von 5 Minuten herbeigeführt werden.[10]
Reaktionsmechanismus
Der Mechanismus wird hier anhand des Produkts 2-Formyl-3,4-dihydro-2H-pyran 2 dargestellt. Acrolein reagiert unter Druck und erhöhter Temperatur mit sich selbst über einen sechsgliedrigen Übergangszustand zum Produkt 2.Theoretisch kann 1 zu dem strukturisomeren Produkt 3-Formyl-3,4-dihydro-2H-pyran reagieren, es entsteht jedoch ausschließlich 2.[5]
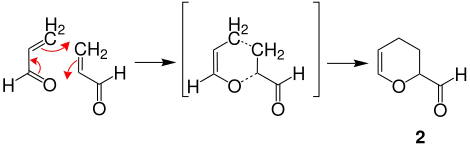
Die niedrigere Aktivierungsenergie der Reaktion zu 2 ist zurückzuführen auf den größeren Mischungsbeitrag des höchsten besetzten Molekülorbital HOMO des Acroleins als Dienkomponente mit dem niedrigsten unbesetzten Molekülorbital LUMO des Acroleins als Dienophil in dieser Orientierung.
Eigenschaften
Acrolein-Dimer ist eine klare und farblose, unangenehm stechend riechende Flüssigkeit, die mit Wasser und polaren organischen Lösungsmitteln mischbar, mit nicht-polaren,[3] wie Benzol, nicht mischbar ist. Acrolein-Dimer neigt zur spontanen Polymerisation unter Bildung eines Polyacetals[3], das thermisch in das Dimer zurückgespalten werden kann. Die Zugabe eines Radikalfängers wie z. B. Hydrochinon unterdrückt die Autoxidation, nicht jedoch die spontane Polymerisation. Acrolein kann kationisch mit Bortrifluoriddiethyletherat, anionisch mit Phenylmagnesiumbromid und radikalisch durch γ-Strahlung polymerisiert werden.[3]
Anwendungen
2-Formyl-3,4-dihydro-2H-pyran ist Ausgangsverbindung für 1,2,6-Hexantriol, das als Polyol in vielen Anwendungen anstelle des weniger stabilen und viskoseren Glycerins eingesetzt wird.
Das Dimer kann als stabile Speicherform für Acrolein dienen. Das durch thermische Spaltung entstehende biozid wirksame Acrolein wurde als Begasungsmittel für von Pflanzenschädlingen, wie z. B. Nematoden verseuchte Böden in Erwägung gezogen.[6]
Die Patentliteratur beschreibt die Herstellung von racemischer DL-Glutaminsäure aus Acrolein-Dimer über die Reaktionsfolge Ozonierung, oxidative Spaltung des Ozonierungsprodukts, Reaktion mit Ammoniak zum Ammonium-pyrrolidoncarboxylat, dessen Hydrolyse und anschließende Aufarbeitung. Die aufwendige Synthese und bescheidene Ausbeute (33,5 % d.Th.) an reiner, jedoch racemischer Glutaminsäure macht diese Synthese uninteressant.[11]
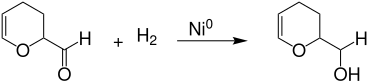
2-Formyl-3,4-dihydro-2H-pyran liefert bei der vollständigen Hydrierung an einem aktivierten Nickel-Kontakt den heterocyclischen Alkohol 2-Hydroxymethyl-tetrahydropyran in praktisch quantitativer Ausbeute, der als Lösemittel und Ausgangsverbindung für Ester mit Weichmachereigenschaften Verwendung findet.[12]
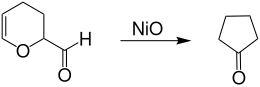
Bei der katalytischen Dehydrierung von Acrolein-Dimer an Metalloxiden, wie z. B. Nickel(II)-oxid und Temperaturen über 200 °C entsteht unter Ringverengung Cyclopentanon bei 70%igem Umsatz in 80%iger Ausbeute.[13]
Die Synthese des Pheromons Brevicomin verläuft, ausgehend von 2-Formyl-3,4-dihydro-2H-pyran, in einer Eintopfreaktion in 69 % Gesamtausbeute zum Zielprodukt als 4:1-Mischung der endo/exo-Isomeren.[14][15][16]
In der Literatur ist die Verwendung von Acrolein-Dimer zur Textilveredelung, Papierbehandlung, Herstellung von Gummichemikalien, pharmazeutischen Wirkstoffen, Weichmachern und synthetischen Harzen erwähnt.[17]
Einzelnachweise
- Datasheet: Acrolein Dimer, stabilized, bei Cameo Chemicals, abgerufen am 11. September 2014.
- Datenblatt 3,4-Dihydro-2H-pyran-2-carboxaldehyde 97% bei Sigma-Aldrich, abgerufen am 11. September 2014 (PDF).
- Potnis, V. S., Shohara, K., Schulz, R. C. and Kern, W.: Untersuchungen über die Polymerisation von 2-Formyl-Δ5-dihydropyran. In: Makromol. Chem. Band 63, 1963, S. 77–88, doi:10.1002/macp.1963.020630106 (ucsf.edu [PDF]).
- fluorochem: Datenblatt 3,4-Dihydro-2H-pyran-2-carbaldehyde, abgerufen am 27. Dezember 2019.
- N.N.: Acrolein Dimerization (Memento des Originals vom 4. September 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Patent US5866614: Methods for fumigating soil using acrolein. Veröffentlicht am 2. Februar 1999, Anmelder: BetzDearborn Inc., Erfinder: E.J. Bockowski, D.P. Davis.
- Alder K., Rüden E.: Zur Kenntnis der Polymerisationsvorgänge, X. Mitteil.: Über das dimere Acrolein. In: Ber. dtsch. Chem. Ges. A/B. Band 74, 1941, S. 920–926, doi:10.1002/cber.19410740610.
- Patent US3159651: Acrolein dimer production. Veröffentlicht am 1. Dezember 1964, Anmelder: Shell Oil Co., Erfinder: G.F. Johnson, L.C. Teague.
- Patent US6187963: Processes for the manufacture of acrolein derivatives. Veröffentlicht am 13. Februar 2001, Anmelder: Union Carbide Chemicals & Plastics Technology Corp., Erfinder: W.G. Etzkorn, R.A. Galley, T.E. Snead, J.L. Brockwell, M.A. Young, J.M. Maher, B.K. Warren.
- H.-P. Hsieh, S.-T. Chen, K.-T. Wang: Microwave Induced Synthesis of 3,4-Dihydro-2H-pyran-2-carboxaldehyde: A Versatile Linker for Solid Phase Combinatorial Library. In: J. Chinese Chem. Soc. Band 44, 1997, S. 597–600, doi:10.1002/jccs.199700092.
- Patent US2897209: Synthesis of glutamic acid. Veröffentlicht am 28. Juli 1959, Anmelder: International Minerals & Chemical Corp., Erfinder: R. Kodras.
- Patent US3187012: Process for preparing 2-Hydroxymethyl-tetrahydrpyran. Veröffentlicht am 1. Juni 1965, Anmelder: The Quaker Oats Co., Erfinder: A.P. Dunlop, D.G. Maaly.
- Patent US3812190: Conversion of acrolein dimer to cyclopentanone. Veröffentlicht am 21. Mai 1974, Anmelder: Monsanto Co., Erfinder: J. P. Petrovich, D.A. Tyssee.
- Patent US4609743: Method for brevicomin synthesis and use in beetle control. Veröffentlicht am 2. September 1986, Anmelder: University of Pittsburgh, Erfinder: T. Cohen, M. Bhupathy.
- T. Cohen, M. Bhupathy: A one-flask, high-yield, stereoselective synthesis of racemic endo-brevicomin. In: Tetrahedron Lett. Band 34, 1983, S. 4163–4164, doi:10.1016/S0040-4039(00)88288-X.
- Eintrag zu exo-Brevicomin in der ChemSpider-Datenbank der Royal Society of Chemistry, abgerufen am 11. September 2014.
- Lawrence Fishbein: Chemical Mutagens Environmental Effects on Biological Systems. Elsevier Science, 2012, ISBN 0-323-15325-9, S. 378.
