2,4,5-Trichlorphenoxyessigsäure
2,4,5-Trichlorphenoxyessigsäure (kurz 2,4,5-T, auch bekannt als T-Säure) ist ein von der Phenoxyessigsäure abgeleitetes Herbizid. Umweltrelevanz hatte 2,4,5-T vor allem durch seine Verunreinigung mit 2,3,7,8-Tetrachlordibenzodioxin (2,3,7,8-TCDD). Es war ein wichtiger Bestandteil der im Vietnamkrieg eingesetzten Entlaubungsmittel. Unfälle bei der Herstellung führten einige Male zur Dioxin-Freisetzung.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
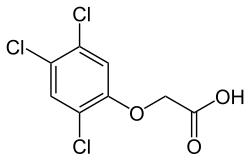 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,4,5-Trichlorphenoxyessigsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H5Cl3O3 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 255,48 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,80 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
Zersetzung[1] | ||||||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (278 mg·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
| ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Herstellung
Nach Pokorny wird 2,4,5-Trichlorphenol und Chloressigsäure mit Natronlauge neutralisiert und mit einem leichten Überschuss von Natriumhydroxid versetzt. Anschließend wird das Gemisch eingedampft und der trockene Rückstand erhitzt. Das Salzgemisch wird in Wasser gelöst; mit Salzsäure wird die 2,4,5-Trichlorphenoxyessigsäure freigesetzt.[5] Die Herstellung des 2,4,5-Trichlorphenols erfolgte aus Tetrachlorbenzol. Falls die Temperatur bei dieser letzten Reaktion zu stark anstieg, bildeten sich Dioxine.
Geschichte
Die chemische Verbindung wurde erstmals 1941 von dem in der C. B. Dolge Company, Westport, Connecticut (USA) arbeitenden Chemiker Robert Pokorny beschrieben.[6] 1948 kam 2,4,5-T auf den Markt. Bei seiner Herstellung kam es immer wieder zu schweren Unfällen, die mit der Freisetzung von Dioxinen verbunden waren. Bei einem Betriebsunfall auf der Produktionsanlage von Monsanto in Nitro wurden 1949 über 120 Arbeiter mit dem Reaktionsgemisch kontaminiert und erkrankten an Chlorakne. Ein weiterer schwerer Unfall ereignete sich 1952 bei Boehringer Ingelheim in Hamburg-Moorfleet, nach dem 30 Arbeiter an Chlorakne erkrankten. Bei Untersuchungen zur Optimierung der 2,4,5-T Synthese explodierte 1968 im Labor der britischen Coalite Chemicals ein Reaktionsbehälter und tötete einen Arbeiter. Das Laborgebäude wurde zunächst weiter genutzt, was jedoch bei etwa 80 Angestellten zum Auftreten von Chlorakne führte.[7]
Zur Zeit des Vietnamkriegs war 2,4,5-T, teilweise in Form seiner iso- oder n-Butylester, Wirkstoff der Entlaubungsmittel Agent Orange, Agent Green, Agent Pink und Agent Purple. Diese Agentien enthielten zwischen 0,02 und 15 ppm (mg/kg) 2,3,7,8-TCDD, was fast ausschließlich auf produktionsbedingte Verunreinigungen der verwendeten 2,4,5-Trichlorphenoxyessigsäure zurückzuführen war. Die im Vietnamkrieg ausgebrachte Menge an 2,3,7,8-TCDD wurde auf etwa 166 kg geschätzt.[8]
Zwischen 1971 und 1974 entsorgte eine Spezialfirma in Missouri ölige Rückstände aus der 2,4,5-T-Produktion nicht ordnungsgemäß. Stattdessen versprühte sie sie auf Pferderennbahnen, um dort den Staub zu binden. Pferde reagieren sehr empfindlich auf Dioxin, mehr als 60 Tiere starben dadurch. Diese Rückstände waren auch auf die Straßen von Times Beach ausgebracht worden. Bei einer Überschwemmung 1982 wurde der dioxinhaltige Straßenbelag in die Häuser gespült. Der gesamte Ort wurde vom Staat aufgekauft und die Bevölkerung umgesiedelt.[7]
Wirkungsweise und Verwendung
2,4,5-T wirkt ähnlich der strukturverwandten 2,4-Dichlorphenoxyessigsäure wie das pflanzliche Wachstumshormon Auxin. Es löst übermäßiges Wachstum aus, was rasch zum Absterben der Pflanze führt.
2,4,5-T wurde in den 1970er- und 1980er-Jahren unter dem Namen Tormona (z. B. Tormona 80, Tormona 100) insbesondere gegen holzige Pflanzen und zur sogenannten Läuterung im Forst verwendet. In Kombination mit anderen Herbiziden wurde es auch im Getreideanbau und auf Grünland- und Rasenflächen eingesetzt. Das Herbizid wurde meist in Form seiner wasserlöslichen Alkali- oder Aminsalze als Pulver, die 2,4,5-T-Ester als Emulsionskonzentrate verkauft.[9] In Deutschland ist die Verwendung von 2,4,5-T seit 1988 verboten.[1] Auch in Österreich und der Schweiz besteht keine Zulassung als Pflanzenschutzmittel mehr.[10]
Toxikologie
2,4,5-T wird vor allem über die Haut oder den Verdauungstrakt aufgenommen. Es wirkt auf Schleimhäute und Haut stark reizend, wobei diese Wirkung vor allem auf in Spuren enthaltenes 2,3,7,8-TCDD zurückgeführt wird. Nach Aufnahme kann das Allgemeinbefinden gestört sein. Die Substanz schädigt das Nerven- und das Herz-/Kreislauf-System. Bei Freiwilligen, die 2,4,5-T in Dosen bis 5 mg/kg Körpergewicht geschluckt hatten, traten keine klinischen Symptome auf. Sie berichteten lediglich von einem metallischen Geschmack im Mund. Im Tierversuch betrug die Letale Dosis (LD50) 100 mg/kg Körpergewicht beim Hund, 500 mg/kg bei der Ratte und etwa 800 mg/kg bei der Maus.[1][9] Bei den durchgeführten Untersuchungen zur chronischen Toxizität scheint in den meisten Fällen nicht mehr nachvollziehbar zu sein, inwieweit das dabei verwendete 2,4,5-T mit Dioxinen verunreinigt war. Bei Tierversuchen wurde ein NOAEL-Wert von 3 mg 2,4,5-T/kg Körpergewicht ermittelt. Die chronische Wirkung führte zu Schäden an Leber und Niere. Die erlaubte Tagesdosis für den Menschen wurde auf 0,03 mg 2,4,5-T/kg Körpergewicht festgesetzt. Reine 2,4,5-Trichlorphenoxyessigsäure wirkt vermutlich nicht teratogen, mutagen oder kanzerogen.[1]
Im Durchschnitt enthielt 2,4,5-T etwa 10 ppm Dioxine.[7] In Deutschland galt lange Zeit ein Grenzwert für 2,3,7,8-TCDD in 2,4,5-T-Produkten von immerhin 10 mg/kg.[11] Er wurde stufenweise heruntergesetzt, in den 1980er Jahren durfte 2,4,5-T höchstens 0,1 mg/kg TCDD enthalten.[9]
Umweltwirkungen
Die Verbindung wurde in Pflanzen nach Abspalten des Essigsäurerests durch Hydroxylierung am Ring zersetzt. Die Nachwirkungszeit im Boden nach dem Ausbringen von 1,5 kg 2,4,5-T pro Hektar wird mit etwa 2 Monaten angegeben. 2,4,5-T war als nicht bienengefährlich eingestuft. Die LC50 für Regenbogenforellen wurde für einen 2,4,5-T-Ester mit 12 mg im 24-Stunden-Test ermittelt.[9]
Nachweis
Für die Rückstandsanalytik kann 2,4,5-Trichlorphenoxyessigsäure mit Chloroform extrahiert und nach Reinigung des Extrakts mit Hilfe von Pyridin-Hydrochlorid in Trichlorphenol umgewandelt werden. Das Trichlorphenol kann nach Reaktion mit 4-Aminoantipyrin und Kaliumferricyanid kolorimetrisch bestimmt werden. Alternativ kann der gereinigte 2,4,5-T-Extrakt auch mit Dimethylsulfat verestert und mit Hilfe der Gaschromatographie bestimmt werden.[9]
Einzelnachweise
- Eintrag zu 2,4,5-Trichlorphenoxyessigsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Eintrag zu 2,4,5-T im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 93-76-5 bzw. 2,4,5-Trichlorphenoxyessigsäure), abgerufen am 2. November 2015.
- Eintrag zu 2,4,5-T in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 17. August 2021.
- Robert Pokorny: New Compounds. Some Chlorophenoxyacetic Acids. In: Journal of the American Chemical Society. Band 63, Nr. 6, Juni 1941, S. 1768–1768, doi:10.1021/ja01851a601.
- Robert Pokorny: New Compounds. Some Chlorophenoxyacetic Acids. In: Journal of the American Chemical Society. Band 63, Nr. 6, Juni 1941, S. 1768–1768, doi:10.1021/ja01851a601.
- John Emsley: Dioxine, die tödlichsten Gifte der Welt? In: Parfum, Portwein, PVC… Wiley-VCH, Weinheim 2003, ISBN 3-527-30789-3.
- Dieter Lenoir, Heinrich Sandermann Jr.: Entstehung und Wirkung von Dioxinen, Biologie in unserer Zeit, 23(6), S. 363–369 (1993), ISSN 0045-205X.
- Werner Perkow: Wirksubstanzen der Pflanzenschutz- und Schädlingsbekämpfungsmittel. 2. Auflage, Verlag Paul Parey.
- Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu 2,4,5-T in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 3. März 2016.
- Karlheinz Ballschmiter, Reiner Bacher: Dioxine. VCH, Weinheim 1996, ISBN 3-527-28768-X.

