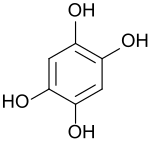
1,2,4,5-Tetrahydroxybenzol
1,2,4,5-Tetrahydroxybenzol ist ein Benzolderivat mit vier symmetrisch angeordneten Hydroxygruppen. Das Tetrahydroxybenzol ist sehr oxidationsempfindlich und geht dabei in 2,5-Dihydroxy-1,4-benzochinon über, aus dem es durch Reduktion leicht zurückerhalten werden kann. Diese Redoxreaktion macht Benzol-1,2,4,5-tetrol für wiederaufladbare Batterien auf Natriumsalzbasis interessant.[4]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | 1,2,4,5-Tetrahydroxybenzol | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C6H6O4 | ||||||||||||
| Kurzbeschreibung | |||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 142,11 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
| ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Die Verbindung bildet sich neben anderen Polyhydroxybenzolen aus bei der Verbrennung von Biomasse entstehenden Di- und Trihydroxyphenolen in Aerosoltröpfchen bei der Oxidation durch Ozon in der Troposphäre.[5]
Darstellung
Bereits 1888 berichtete Rudolf Nietzki die Darstellung von 1,2,4,5-Tetrahydroxybenzol – hier Tetroxybenzol genannt – durch Reduktion von 2,5-Dihydroxy-1,4-benzochinon mit Zinn(II)-chlorid (Zinnchlorür) SnCl2 in salzsaurer Lösung.[1]
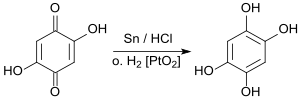
Reduktion des Dihydroxychinons mit metallischem Zinn in konzentrierter Salzsäure liefert Benzol-1,2,4,5-tetrol in einer Reinausbeute von 52 %.[6] In einer Patentschrift wird die Hydrierung des 2,5-Dihydroxy-1,4-benzochinons (aus Hydrochinon durch Oxidation mit Wasserstoffperoxid) an einem Platin(IV)-oxid PtO2-Katalysator in THF in 70 bis 90 %iger Ausbeute beschrieben.[7]
Eigenschaften
1,2,4,5-Tetrahydroxybenzol ist ein farbloser kristalliner Feststoff, der auch „etwas grau gefärbte, silberglänzende Blättchen“ bildet.[1] Die Verbindung ist sehr gut löslich in Wasser, Ethanol and Diethylether und löslich in THF und Dioxan. Zur Reinigung kann Benzol-1,2,4,5-tetrol in Eisessig umkristallisiert werden. In wässriger Lösung färbt sich Benzol-1,2,4,5-tetrol durch Oxidation schnell braun.[1]
Anwendungen
Veresterung von 1,2,4,5-Tetrahydroxybenzol mit Benzoesäuren, die in 4-Stellung langkettige Substituenten tragen, liefert symmetrische (im Fall R = polymerisierbare Gruppe: monomere) Tetraester,
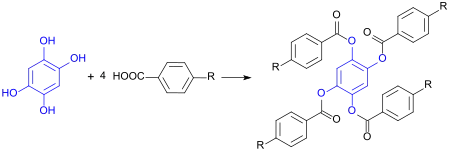
die oft flüssigkristalline Eigenschaften besitzen und nematische Phasen bilden.[8][9]
Umsetzung von Benzol-1,2,4,5-tetrol mit Phosphorchloriden, wie z. B. Phosphortrichlorid PCl3 oder Phosphorpentachlorid PCl5 erzeugt so genannte Benzobisphosphole, die in die entsprechenden Amide bzw. Thioamide überführt werden können.[10]
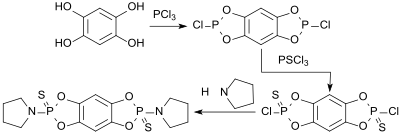
Die Verbindungen können in Schmierölen als verschleiß- und oxidationshemmende Additive und als Flammschutzmittel eingesetzt werden.
Bei der Reaktion von 1,2,4,5-Tetrahydroxybenzol mit aromatischen Diboronsäuren entstehen polymere Poly(dioxaborol)e, die selbstorganisierende, hochgeordnete planare Strukturen mit relativ ausgedehnten π-Systemen bilden und Licht im blauen Wellenlängenbereich emittieren.[11]
e.svg.png.webp)
Mit Triboronsäuren, wie z. B. 1,3,5-Benzoltriboronsäure (CAS-Nr. 89641-21-4) und Benzol-1,2,4,5-tetrol sind hochgeordnete dreidimensionale kovalent organische Gerüstmaterialien (engl. covalent organic frameworks COFs) mit definierter Mikroporosität zugänglich, die sich als Medien für Gasadsorption und Gastrennung eignen könnten.[12]
Das Redoxsystem 1,2,4,5-Tetrahydroxybenzol – 2,5-Dihydroxy-1,4-benzochinon macht dessen Natriumsalze als Anodenmaterial für wiederaufladbare Natriumbatterien interessant.[4]
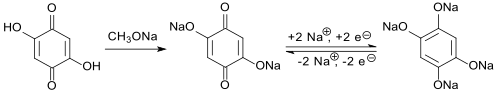
Die erzielten Kenngrößen, wie Betriebsspannung von ca. 1,2 V, reversible Kapazität von ca. 265 mAh/g bei maximal 300 Zyklen und hohe Belastungsfähigkeit zeigen Potentiale, aber auch Schwachpunkte (niedrige Zyklenzahl) dieses Redoxsystems.
Einzelnachweise
- Rudolf Nietzki, F. Schmidt: Ueber Dioxychinon und Tetroxybenzol. In: Chem. Ber. Band 21, Nr. 2, 1888, S. 2374–2379, doi:10.1002/cber.18880210236.
- Patent US3780114: Method for the preparation of 1,2,4,5-tetrahydroxybenzene. Angemeldet am 23. November 1970, veröffentlicht am 18. Dezember 1973, Anmelder: S.A. Texaco Belgium N.V., Erfinder: S.A.R. Dewaele.
- Ambeed: Benzene-1,2,4,5-tetraol, abgerufen am 6. Februar 2021
- Z. Zhu, H. Li, J. Liang, Z. Tao, J. Chen: The disodium salt of 2,5-dihydroxy-1,4-benzoquinone as anode material for rechargeable sodium batteries. In: Chem. Commun. Band 51, Nr. 8, 2015, S. 1446–1448, doi:10.1039/C4CC08220F.
- E.A. Pillar, R.C. Camm, M.I. Guzman: Catechol oxidation by ozone and hydroxyl radicals at the air-water interface. In: Environ. Sci. Technol. Band 48, Nr. 24, 2014, S. 14352–14360, doi:10.1021/es504094x.
- Neue zwitterionische Halbschalen als Bausteine für supramolekulare Kapseln. (PDF) In: Dissertation. Julius-Maximilians-Universität Würzburg, 2009, abgerufen am 1. Februar 2021.
- Patent US3780114: Method for the preparation of 1,2,4,5-tetrahydroxybenzene. Angemeldet am 23. November 1970, veröffentlicht am 18. Dezember 1973, Anmelder: S.A. Texaco Belgium N.V., Erfinder: S.A.R. Dewaele.
- S. Berg, V. Krone, H. Ringsdorf, U. Quotschalla, H. Paulus: Mesophase behaviour of 2,5-dibenzoyloxy-p-benzoquinone derivatives and tetrahydrobenzene tetraesters. In: Liq. Cryst. Band 9, Nr. 2, 1991, S. 151–163, doi:10.1080/02678299108035495.
- Patent US7300604B2: Tetrahydroxybenzenzene tetraester derivative and polymer thereof. Angemeldet am 16. Februar 2006, veröffentlicht am 27. November 2007, Anmelder: Chisso Corp., Chisso Petrochemical Corp., Erfinder: R. Shundo.
- Patent US3910905: Phosphorus derivatives of 1,2,4,5-tetrahydroxy benzene. Angemeldet am 7. Januar 1974, veröffentlicht am 7. Oktober 1975, Anmelder: S.A. Texaco Belgium N.V., Erfinder: L.G. Dulog, S.A.R. Dewaele.
- W. Niu, M.D. Smith, J.J. Lavigne: Self-assembling poly(dioxaborole)s as blue-emissive materials. In: J. Am. Chem. Soc. Band 128, Nr. 51, 2006, S. 16466–16467, doi:10.1021/ja065986c.
- R.W. Tilford, W.R. Gemmill, H.-C. zur Loye, J.J. Lavigne: Facile synthesis of a highly crystalline, covalently linked porous boronate network. In: Chem. Mater. Band 18, Nr. 22, 2006, S. 5296–5301, doi:10.1021/cm061177g.
