Bohrscher Radius
Der bohrsche Radius bezeichnet den Radius des Wasserstoffatoms im niedrigsten Energiezustand und somit auch den Radius seiner ersten und kleinsten Elektronenschale im Rahmen des bohrschen Atommodells; dabei bleibt die kleine Korrektur, die der Mitbewegung des Atomkerns um den Schwerpunkt entspricht, noch unberücksichtigt.
| Physikalische Konstante | |
|---|---|
| Name | Bohrscher Radius |
| Formelzeichen | |
| Größenart | Länge |
| Wert | |
| SI | 5.29177210903(80)e-11 m |
| Unsicherheit (rel.) | 1.5e-10 |
| Gauß | 5.29177210903(80)e-9 cm |
| Bezug zu anderen Konstanten | |
| Quellen und Anmerkungen | |
| Quelle SI-Wert: CODATA 2018 (Direktlink) | |
Eine quantenmechanische Betrachtung ergibt, dass im niedrigsten Energiezustand die radiale Wahrscheinlichkeitsdichte, das Elektron zu messen, beim bohrschen Radius maximal wird. Der experimentell relevantere Erwartungswert für den Radius ist jedoch das 1,5-fache des bohrschen Radius.
Formeln und Zahlenwert
Der bohrsche Radius errechnet sich gemäß der Formel:
Dabei ist
- die elektrische Feldkonstante im Vakuum,
- die durch geteilte Plancksche Konstante,
- die Masse des Elektrons und
- die Ladung des Elektrons.
Ebenso wird der bohrsche Radius beschrieben durch
mit
- der Compton-Wellenlänge des Elektrons und
- der Feinstrukturkonstante
Der Wert beträgt nach derzeitiger Messgenauigkeit der in die Rechnung einfließenden Naturkonstanten:[1]
wobei die eingeklammerten Ziffern die geschätzte Standardabweichung von 0,000 000 000 080 · 10−10 m angeben.
Mit dieser Definition gilt der bohrsche Radius als eine Naturkonstante. Zum Beispiel in der Atomphysik wird sie oft als Längeneinheit benutzt, wobei als Näherungen 52,9 pm oder ein halbes Ångström (= 50 pm) verwendet werden.
Berücksichtigt man die endliche Masse des Kerns und damit seine Mitbewegung um den gemeinsamen Schwerpunkt, muss man in den mechanischen Formeln die Elektronenmasse durch die reduzierte Masse ersetzen. Der Bahnradius wird dann . Die Korrektur beträgt beim H-Atom nur ca. 0,05 %, beim He+-Ion, das ebenfalls nur ein Elektron besitzt, ca. 0,01 %. Mit entsprechenden Werten für die Masse wird der Begriff des bohrschen Radius auch für andere Systeme verwendet, z. B. Exzitonen.
Herleitung
Schon mithilfe einer einfachen Abschätzung und unter Berücksichtigung der Unschärferelation lässt sich der bohrsche Radius ermitteln.
Es wird angenommen, dass der Abstand des im Wasserstoffatom gebundenen Elektrons zum Kern für gewöhnlich beträgt.
Der Unschärferelation wegen lässt sich der Impuls des Elektrons grob mit
angeben, wobei die Ortsobservable hier durch den Abstand ersetzt wird.
Die kinetische Energie beträgt demnach
Die potentielle Energie ist gemäß dem Coulombschen Gesetz
woraus sich die Gesamtenergie ergibt:
Je weiter sich das Elektron vom Kern entfernt, desto kleiner wird seine kinetische Energie. Wegen des negativen Vorzeichens wächst damit aber seine potentielle Energie.
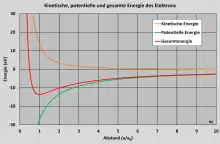
Im Grundzustand realisiert sich eine Art „Kompromiss“, der die Gesamtenergie minimal macht; der zugehörige Radius ergibt sich, indem man die Energie nach differenziert und die Ableitung gleich null setzt (Extremwertermittlung):
Dies ist genau der bohrsche Radius.
Setzt man nun in ein, so erhält man die Rydberg-Energie, die Ionisierungsenergie des Wasserstoffs:
Die Abbildung zeigt den Verlauf von kinetischer, potentieller und Gesamtenergie in Abhängigkeit vom Abstand (in bohrschen Radien). Setzt man in die Formel für bzw. ein, so ergeben sich
bzw.
- .
Der Betrag der potentiellen Energie wird als Hartree-Energie bezeichnet und ist eine weitere Einheit des Systems atomarer Einheiten der Atomphysik.
Historisches
Niels Bohr erwähnt in seinem Aufsatz[2] den österreichischen Physiker Arthur Erich Haas, der die Formel für schon 1910/11 gefunden und damit erstmals die Rolle erkannt hatte, die die Plancksche Konstante in der Atomphysik, insbesondere in ihren mechanischen Aspekten, spielen könnte. In seinem Modell läuft ein Elektron auf der Oberfläche einer mit positiv geladenen Kugel um, was nach dem Gaußschen Gesetz der Elektrostatik dieselbe Anziehungskraft ergibt wie ein punktförmiger Kern. Dieses Modell fand damals keine Beachtung, u. a. weil man vielfach auch beim Wasserstoff noch von einer viel größeren Anzahl von Elektronen ausging, also entsprechend auch von einer größeren positiven Ladung des Rests des insgesamt neutralen Atoms. Auch hielt man es weithin für ausgeschlossen, dass außerhalb des Themas harmonische Schwingungen eine Bedeutung haben könnte.
Anfangs lagen die mit dem bohrschen Radius berechneten Energien bzw. Wellenlängen des Wasserstoffspektrums um 0,05 % neben den damals bekannten Messwerten, beim Helium-Ion um 0,01 %. Doch dass die kleinen Korrekturen wegen der Mitbewegung des Kerns in beiden Fällen volle Übereinstimmung erbrachten, sicherte dem bohrschen Modell rasch große Anerkennung.
Quellen
- R. P. Feynman: Vorlesungen über Physik. Quantenmechanik. Oldenbourg Wissenschaftsverlag, München 2007, ISBN 978-3-486-58109-6.
- L. M. Brown, A. Pais, Sir B. Pippard (Hrsg.): Twentieth Century Physics. Band 1, Inst. of Phys. Publishing, Bristol 1995, ISBN 0-7503-0353-0.
- Max Jammer: The Conceptual Development of Quantum Mechanics. MCGraw-Hill, New York 1966.
Einzelnachweise
- CODATA Recommended Values. National Institute of Standards and Technology, abgerufen am 3. Juni 2019. Wert für den bohrschen Radius. Die eingeklammerten Ziffern bezeichnen die Unsicherheit in den letzten Stellen des Wertes, diese Unsicherheit ist als geschätzte Standardabweichung des angegebenen Zahlenwertes vom tatsächlichen Wert angegeben.
- N. Bohr: On the Constitution of Atoms and Molecules. In: Philosophical Magazine. Band 26, 1913, S. 4.