Valerolactam
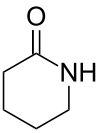
Valerolactam (genauer δ-Valerolactam oder 2-Piperidon) ist das Lactam der 5-Aminovaleriansäure (5-Aminopentansäure), während die Stellungsisomeren 3-Piperidon und 4-Piperidon Aminoketone darstellen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Valerolactam | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H9NO | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 99,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,073 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser (291 g·l−1 bei 25 °C),[2] löslich in Ethanol und Diethylether[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Neue biotechnologische Verfahren liefern die nichtproteinogene ω-Aminosäure 5-Aminovaleriansäure in guten Ausbeuten und eröffnen so den direkten und indirekten (über δ-Valerolactam) Zugang zu dem bisher wenig untersuchten Polyvalerolactam (Polyaminovalerat, Polyamid 5).[4]
Herstellung
5-Aminovaleriansäure reagiert bei Aktivierung mit 2-Nitrophenyl-thiocyanat und Tributylphosphin in Dimethylformamid bei Raumtemperatur in einer intramolekularen Cyclisierung unter Wasserabspaltung mit 73-prozentiger Ausbeute zu δ-Valerolactam.[5]

Die Cyclisierung von 5-Aminovaleriansäure kann auch enzymatisch erfolgen.[6] Über diese Route könnte zukünftig δ-Valerolactam aus biotechnologisch erzeugter 5-Aminovalerian-säure kostengünstig in industriell brauchbaren Mengen zur Verfügung stehen.
Beim Erhitzen des Ammoniumsalzes der 5-Aminovaleriansäure entsteht ebenfalls δ-Valerolactam.

Die Umsetzung von Polymeren des δ-Valerolactons in N-Methylpyrrolidon mit Ammoniak bei 330 °C und einem Wasserstoffdruck von 280 bar erzeugt 2-Piperidon in Ausbeuten bis 83 %.[7]
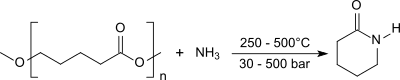
Die Hydrierung von Glutarimid in einem Hochdruckautoklaven liefert δ-Valerolactam in Ausbeuten bis 70 % bei 270 °C und 490 atm Wasserstoffdruck in Gegenwart eines Nickelkatalysators[8]
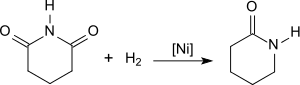
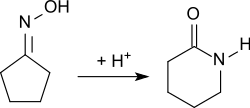
Während diese Herstellrouten keine industrielle Anwendung fanden, ist die Beckmann-Umlagerung von Cyclopentanonoxim (aus Cyclopentanon und Hydroxylamin) ein brauchbares Verfahren zur Herstellung größerer Mengen von δ-Valerolactam.
Die Umlagerung des Cyclopentanonoxims verläuft in der Dampfphase an sauren Zeolith-Katalysatoren schneller als die Reaktion des homologen Cyclohexanonoxims, was von den Autoren auf die höhere Diffusion des kleineren Moleküls Cyclopentanonoxim in die Mikroporen des Katalysators zurückgeführt wird.[9]
Unter milden Bedingungen werden bei der säurekatalysierten Umlagerung von in ionischen Flüssigkeiten gelöstem Cyclopentanonoxim zwar sehr hohe Selektivitäten (>99 %), aber nur bescheidene Umsätze (48 %) erzielt, was mit der Behinderung der Umlagerung durch die höhere Ringspannung im Cyclopentanring (im Vergleich zum Cyclohexanhomologen) erklärt wird.[10]
Die goldkatalysierte Oxidation von Piperidin in Toluol liefert δ-Valerolactam in Ausbeuten von ca. 60 %.[11]

Eigenschaften
δ-Valerolactam fällt bei der Synthese meist als gelb-brauner und hygroskopischer Feststoff an. Nach Passage einer 50-prozentigen wässrigen Lösung über einen sauren Ionenaustauscher kann es in Form geruchloser weißer Kristalle isoliert werden, deren Reinheit sie auch zur Polymerisation zu Polyvalerolactam geeignet macht.[12]
Anwendungen
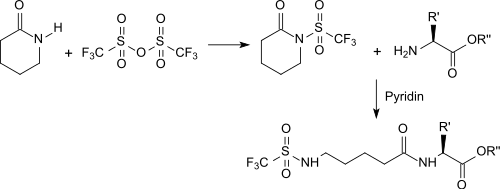
Nach Aktivierung mit Trifluormethansulfonsäureanhydrid reagiert das aktivierte δ-Valerolactam mit an der Carboxygruppe geschützten Aminosäuren zu Dipeptiden von ω-Aminosäuren.[13]
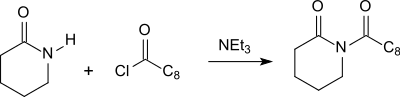
Durch Acylierung von δ-Valerolactam mit längerkettigen aliphatischen oder aromatischen Carbonsäuren entstehende N-Acylvalerolactame eignen sich als Bleichaktivatoren.[14]
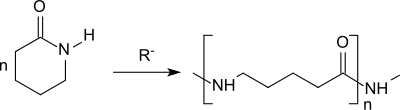
Bei der anionischen Polymerisation von δ-Valerolactam entsteht analog zum homologen ε-Caprolactam Polyamid 5 (Nylon 5).
Polyamide mit ungeradzahliger Kohlenstoffzahl besitzen ferroelektrische Eigenschaften und daraus hergestellte polarisierte Folien zeigen piezoelektrische Eigenschaften, die mit denen von Polyvinylidenfluorid PVDF vergleichbar sind und insbesondere Nylon 5 und seine Copolymeren für Sensoranwendungen interessant erscheinen lassen.[15]
Einzelnachweise
- Datenblatt δ-Valerolactam 98% bei Sigma-Aldrich, abgerufen am 28. April 2015 (PDF).
- Datenblatt δ-Valerolactam 99% bei Acros, abgerufen am 18. Juli 2019.
- Datenblatt delta-Valerolactam 98% bei AlfaAesar, abgerufen am 28. April 2015 (PDF) (JavaScript erforderlich).
- S.J. Park, E.Y. Kim, W. Noh, H.M. Park, Y.H. Oh, S.H. Lee, B.K. Song, J. Jegal, S.Y. Lee: Metabolic engineering of Escherichia coli for the production of 5-aminovalerate and glutarate as C5 platform chemicals. In: Metabolic Engineering. Band 16, 2013, S. 42–47, doi:10.1016/j.ymben.2012.11.011.
- P.A. Grieco, D.S. Clark, G.P. Withers: Direct conversion of carboxylic acids into amides. In: J. Org. Chem. Band 44, Nr. 16, 1979, S. 2945–2947, doi:10.1021/jo01330a028.
- E. Stavila, K. Loos: Synthesis of lactams using enzyme-catalyzed aminolysis. In: Tetrahedron Lett. Band 54, 2013, S. 370–373, doi:10.1016/j.tetlet.2012.10.133.
- Patent EP0670311A2: Verfahren zur Herstellung von Piperid-2-on. Angemeldet am 10. Februar 1995, veröffentlicht am 6. September 1995, Anmelder: BASF AG, Erfinder: L. Franz.
- Patent US3745164: Preparation of butyrolactam and valerolactam. Angemeldet am 28. August 1970, veröffentlicht am 10. Juli 1973, Anmelder: Du Pont of Canada, Ltd., Erfinder: E.G. Adamek.
- T. Takahashi, K. Ueno, T. Kai: Vapor phase Beckmann rearrangement of cyclopentanone oxime over high silica HZSM-5 zeolites. In: Microporous Materials. Band 1, Nr. 5, 1993, S. 323–327, doi:10.1016/0927-6513(93)80048-Y.
- S. Guo, Y. Deng: Environmentally friendly Beckmann rearrangement of oximes catalyzed by metaboric acid in ionic liquids. In: Catal. Commun. Band 6, 2005, S. 225–228, doi:10.1016/j.catcom.2005.01.003.
- Patent US8212027B1: Process for the conversion of cyclic amines into lactams. Angemeldet am 27. April 2011, veröffentlicht am 3. Juli 2012, Anmelder: Iowa State University Research Foundation, Inc., Erfinder: L.K. Woo, R.J. Angelici.
- Patent US2828307: Process for purification of lactams. Angemeldet am 26. Juni 1956, veröffentlicht am 25. März 1958, Anmelder: Stamicarbon N.V., Erfinder: J.C. Soeterbroek, J.A. Zeegers.
- N. Kuhnert, I. Clemens, R. Walsh: On the activation of valerolactam with triflic anhydride: the synthesis of ω-trifluorosulfonamido dipeptides using a transpeptidation reaction under mild conditions. In: Org. Biomol. Chem. Band 3, 2005, S. 1694–1701, doi:10.1039/B417779G.
- Patent US5405413: Bleaching compunds comprising acyl valerolactam bleach activators. Angemeldet am 24. Juni 1993, veröffentlicht am 11. April 1995, Anmelder: The Procter & Gamble Co., Erfinder: A.D. Willey, M.E. Burns, S. Tsunetsugu.
- J.I. Scheinbeim, B.A. Newman: Recent advances in ferroelectric polymers. In: Macromol. Sympos. Band 98, Nr. 1, 1995, S. 897–898, doi:10.1002/masy.19950980178.
