Trifluormethansulfonsäureanhydrid
Trifluormethansulfonsäureanhydrid, abgekürzt Tf2O, ist eine farblose, ätzende und giftige Flüssigkeit, die in organischen Lösungsmitteln gut löslich ist, mit protischen Lösungsmitteln jedoch heftig unter Hydrolyse reagiert. Sie ist das Anhydrid der Trifluormethansulfonsäure. Die Verbindung ist ein besonders starkes Elektrophil, sie wird zum Einführen der Triflylgruppe genutzt. Eine Übersicht über verschiedene Reaktionen ist in der Literatur gegeben.[4]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
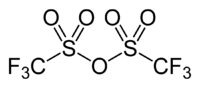 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Trifluormethansulfonsäureanhydrid | |||||||||||||||
| Andere Namen |
Triflinsäureanhydrid Tf2O | |||||||||||||||
| Summenformel | C2F6O5S2 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 282,139 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,677 g·cm−3[2] | |||||||||||||||
| Siedepunkt |
82 °C[3] | |||||||||||||||
| Löslichkeit |
gut in organischen Lösungsmitteln[1] | |||||||||||||||
| Brechungsindex |
1,321[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung und Gewinnung
Trifluormethansulfonsäureanhydrid kann durch Kondensation aus Trifluormethansulfonsäure mittels Phosphorpentoxid oder Phosphorpentachlorid gewonnen werden.[1][5]
Verwendung
In der präparativen organischen Chemie wird durch Trifluormethansulfonsäureanhydrid eingeführte Triflylgruppe als gute Abgangsgruppe genutzt.[6] Mit Alkoholen ergeben sich Alkyltriflate, die u. a. für Alkylierungen verwendet werden. Aus Carbonylverbindungen und Phenolen ergeben sich Vinyl- und Aryltriflate, die in der Heck-Reaktion oder anderen Kreuzkupplungen eine überlegene Alternative zu Haliden darstellen.[7][8][9] Es dient ebenfalls als gute Abgangsgruppe bei Aminierungen,[10] Carbonylierungen oder Heterocyclisierungen.[11][12] Aus Bis(trifluormethansulfonyl)methan und Trifluormethansulfonsäureanhydrid kann Tris(trifluormethansulfonyl)methan gewonnen werden[13]
Einzelnachweise
- Eintrag zu Trifluormethansulfonsäureanhydrid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. Juni 2020.
- Datenblatt Trifluoromethanesulfonic anhydride bei Sigma-Aldrich, abgerufen am 9. Januar 2015 (PDF).
- A.J. Bloodworth, Richard J. Curtis, Michael D. Spencer, Neil A. Tallant: Oxymetallation. Part 24. Preparation of cyclic peroxides by cycloperoxymercuriation of unsaturated hydroperoxides.. In: Tetrahedron. 49, Nr. 13, März 1993, S. 2729–2750. doi:10.1016/S0040-4020(01)86350-X.
- Ivan L. Baraznenok, Valentine G. Nenajdenko, Elizabeth S. Balenkova: Chemical Transformations Induced by Triflic Anhydride. In: Tetrahedron. 56, Nr. 20, Mai 2000, S. 3077–3119. doi:10.1016/S0040-4020(00)00093-4.
- André B. Charette, Peter Chua: A new method for the conversion of secondary and tertiary amides to bridged orthoesters. In: Tetrahedron Letters. 38, Nr. 49, Dezember 1997, S. 8499–8502. doi:10.1016/S0040-4039(97)10310-0.
- e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Trifluoromethanesulfonic Anhydride, abgerufen am 6. Januar 2015.
- Kurt Ritter: Synthetic Transformations of Vinyl and Aryl Triflates. In: Synthesis. 1993, Nr. 08, 1993, S. 735–762. doi:10.1055/s-1993-25931.
- Farina Vittorio, Krishnamurthy Venkat, Scott J. William: The Stille Reaction. In: Organic Reactions. März. doi:10.1002/0471264180.or050.01.
- Rik R. Tykwinski, Yuming Zhao: Cross-Conjugated Oligo(enynes). In: Synlett. Nr. 12, 2002, S. 1939–1953. doi:10.1055/s-2002-35578.
- John F. Hartwig: Transition Metal Catalyzed Synthesis of Arylamines and Aryl Ethers from Aryl Halides and Triflates: Scope and Mechanism. In: Angewandte Chemie International Edition. 37, Nr. 15, 17. August 1998, S. 2046–2067. doi:10.1002/(SICI)1521-3773(19980817)37:15<2046::AID-ANIE2046>3.0.CO;2-L.
- Sandro Cacchi, Giancarlo Fabrizi, Luca M. Parisi: Nitrogen-containing Heterocycles via Palladium-catalyzed Reaction of Alkynes with Organic Halides or Triflates. In: HETEROCYCLES. 58, Nr. 1, 2002, S. 667. doi:10.3987/REV-02-SR(M)1.
- Ernesto Occhiato: Lactam-derived Vinyl Triflates and Phosphates in the Synthesis of N-heterocycles. In: Mini-Reviews in Organic Chemistry. 1, Nr. 2, 1. April 2004, S. 149–162. doi:10.2174/1570193043488890.
- Francis J. Waller, Anthony G. M. Barrett, D. Christopher Braddock, Dorai Ramprasad, R. Murray McKinnell, Andrew J. P. White, David J. Williams, Richard Ducray: Tris(trifluoromethanesulfonyl)methide (“Triflide”) Anion: Convenient Preparation, X-ray Crystal Structures, and Exceptional Catalytic Activity as a Counterion with Ytterbium(III) and Scandium(III). In: The Journal of Organic Chemistry. Band 64, Nr. 8, 1999, ISSN 0022-3263, S. 2910–2913, doi:10.1021/jo9800917.

