Tristearin
Tristearin ist eine chemische Verbindung aus der Gruppe der einfachen Triglyceride, wobei alle drei Hydroxygruppen des Glycerins mit der Stearinsäure verestert sind.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
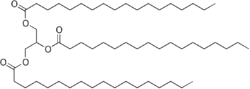 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tristearin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C57H110O6 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 891,48 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,4395 (80 °C)[8] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Gewinnung
Tristearin ist der Hauptbestandteil in Talg oder Nierentalg aus Schweinefett und kann daraus extrahiert werden. Im Gegensatz dazu werden Mono- und Distearin künstlich hergestellt. Die Darstellung des reinen Tristearin kann durch die katalytische Hydrierung des ungesättigten Triglycerids Trilinolein in n-Hexan als Lösungsmittel erfolgen.[9]
Eigenschaften
Tristearin ist ein kristalliner Feststoff, der in drei polymorphen Formen auftreten kann.[10] Die α–Form schmilzt bei 54 °C mit einer Schmelzenthalpie von 145 kJ·mol−1.[5] Der Schmelzpunkt der β–Form liegt bei 72 °C, wobei die Schmelzenthalpie 203 kJ·mol−1 beträgt.[5] Eine intermediär herstellbare β'-Form besitzt einen Schmelzpunkt von 63,5 C und eine Schmelzenthalpie von 143 kJ·mol−1.[11] Die Formen α und β' stehen monotrop zu Form β. Die β–Form ist die thermodynamisch stabile Form. Die α–Form bildet ein hexagonales Kristallgitter, wo die parallel liegenden Kohlenwasserstoffketten senkrecht zur Basisebene angeordnet sind. Bei der β–Form stehen die Kohlenwasserstoffgruppen gekippt zur Basisebene in einem triklinen Kristallgitter. Die Anordnung der Kohlenwasserstoffketten bei der β'–Form entspricht der β–Form, es wird aber ein orthorhombisches Kristallgitter gebildet.[12][11] Die Verbindung ist schwer flüchtig. Die Dampfdrücke liegen im Temperaturbereich von 253 °C und 313 °C zwischen 1,3·10−3 mbar und 9,1·10−2 mbar.[13] Die Dampfdruckfunktion ergibt sich nach August entsprechend log10(P) = −A/T+B (P in mmHg, T in K) mit A = 8750 und B = 16,60.[13] Es ergibt sich eine Verdampfungsenthalpie von 167 kJ·mol−1.[13] Die Verbrennungsenthalpie des Feststoffes beträgt −35,807 kJ·mol−1.[14]
Verwendung
Der Ester wird auch als Formulierungshilfe in Medikamenten, als Emulgator und Kristallisationshilfe in Lebensmitteln, als Weichmacher, Schmierstoff und in Kosmetika verwendet. In den USA besitzt Tristearin den GRAS-Status (Generally Recognized As Safe) und wird in Mengen bis zu 3 % verschiedenen Lebensmitteln zugesetzt.[15]
Einzelnachweise
- Eintrag zu TRISTEARIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Januar 2021.
- Datenblatt Glyceryl tristearate bei Sigma-Aldrich, abgerufen am 15. Juni 2011 (PDF).
- D. Johansson, B. Bergenstahl: Sintering of fat crystal networks in oil during post-crystallization processes. In: J Am Oil Chem Soc. 72, 1995, S. 911–920. doi:10.1007/BF02542069
- Eintrag zu Tristearin der Gefahrstoff-Datenbank im „CLAKS“ der Uni-Hamburg
- G. H. Charbonnet, W. S. Singleton: Thermal properties of fats and oils. VI. Heat capacity, heats of fusion and transition, and entropy of trilaurin, trimyristin, tripalmitin, and tristearin. In: J. Am. Oil Chem. Soc. 24, 1947, S. 140–142. doi:10.1007/BF02643296
- E. S. Domalski, E. D. Hearing: Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III. (= J. Phys. Chem. Ref. Data. 25). American Chemical Society, 1996, OCLC 68546879. doi:10.1063/1.555985
- Eintrag zu Glyceroltristearat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juni 2014.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-268.
- D. W. Rogers, D. N. Choudhury: Heats of hydrogenation of large molecules. Part 3 - Five simple unsaturated triglycerides (triacylglycerols). In: J. Chem. Soc. Faraday Trans. 1, 74, 1978, S. 2868–2872.
- E. S. Lutton: The Polymorphism of Tristearin and Some of its Homologs. In: J. Am. Chem. Soc. 67, 1945, S. 524–527. doi:10.1021/ja01220a008
- M. Ollivon, R. Perron: Measurements of enthalpies and entropies of unstable crystalline forms of saturated even monoacid triglycerides. In: Thermochim. Acta. 53, 1982, S. 183–194. doi:10.1016/0040-6031(82)85007-7
- E. S. Lutton: Lipid structures. In: J. Am. Oil Chem. Soc. 49, 1972, S. 1–9. doi:10.1007/BF02545128
- E. S. Perry, W. H. Weber, B. F. Daubert: Vapor Pressures of Phlegmatic Liquids. I. Simple and Mixed Triglycerides. In: J. Am. Chem. Soc. 71, 1949, S. 3720–3726. doi:10.1021/ja01179a038
- B. Freedman, M. O. Bagby, H. Khoury: Correlation of heats of combustion with empirical formulas for fatty alcohols. In: J. Am. Oil Chem. Soc. 66, 1989, S. 595–596. doi:10.1007/BF02885455
- George A. Burdock: Encyclopedia of food and color additives. CRC Press, 1997, ISBN 0-8493-9416-3, S. 1231–1232.