Triphenylboroxin
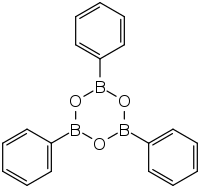
Triphenylboroxin ist eine bororganische Verbindung, die der Stoffgruppe der Boroxine zugeordnet werden kann. Die Verbindung ist zudem das trimere Anhydrat der Phenylboronsäure.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Triphenylboroxin | |||||||||||||||
| Andere Namen |
Triphenylboroxol | |||||||||||||||
| Summenformel | C18H15B3O3 | |||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 311,748 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Durch trockenes Erhitzen kann die Verbindung aus Phenylboronsäure unter Wasserabspaltung erhalten werden.[5]
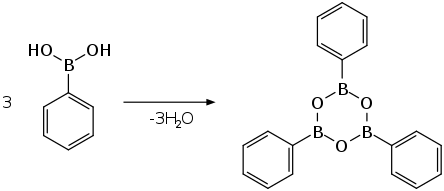
Die Boroxinbildung verläuft mit einer Reaktionswärme von −14,3 kJ·mol−1 schwach exotherm.[6]
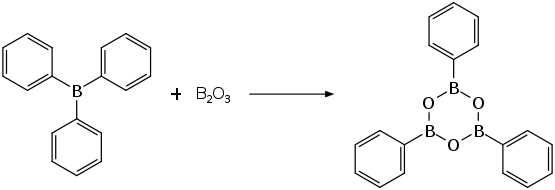
Eine weitere Herstellvariante ist die Umsetzung von Bortrioxid mit Triphenylboran in Tetrachlormethan.[7]
Eigenschaften
Physikalische Eigenschaften
Triphenylboroxin kristallisiert in einem monoklinen Kristallgitter in der Raumgruppe P21/c (Raumgruppen-Nr. 14).[8] Der B3O3-Ring und die drei substituierten Phenylringe bilden ein nahezu planares Molekül mit einer schwachen Krümmung, da im B3O3-Ring ein Boratom etwa 0.119 Å von der Ringebene abweicht.[8]
Chemische Eigenschaften
In Wasser hydrolysiert die Verbindung sofort zur Phenylboronsäure.[4][5] Die Hydrolyse ist eine Gleichgewichtsreaktion mit[6]
Die Gleichgewichtskonstante ergibt sich mit
Die Gleichgewichtskonstante beträgt bei 25 °C K = 0,32 mol·l−1.[6]
Triphenylboroxin bildet stabile Donor-Akzeptor-Addukte mit Stickstoffbasen wie Aminen[9][10][11], Hydrazinen[12] und Stickstoffheterocyclen[10][13]. Die Adduktbildung beruht auf Donor-Akzeptor-Bindungen zwischen den Boratomen als elektrophile Elektronenpaarakzeptoren und den Stickstoffatomen als nucleophile Elektronenpaardonatoren. Die Struktur einiger Addukte wurde mittels Röntgenstrukturanalyse und 1H- bzw. 11B-NMR-Spektroskopie charakterisiert.[10]
| Donor | Zusammensetzung | Schmelzpunkt | Quelle |
| Propylamin | 1 : 1 | 140–143 °C | [9] |
| Diethylamin | 1 : 1 | 85 °C | [9] |
| Piperidin | 1 : 1 | 213 °C | [9] |
| Trimethylamin | 1 : 1 | [10] | |
| Triethylamin | 1 : 1 | 39 °C | [9] |
| Chinuclidin | 1 : 1 | [10] | |
| DABCO | 1 : 1 | [10] | |
| Urotropin | 1 : 2 | [10] | |
| Morpholin | 1 : 1 | 188–189 °C | [13] |
| p-Phenylendiamin | 3 : 2 | 167–168 °C | [11] |
| Hydrazin | 1 : 1 | 95–97 °C | [12] |
| Hydrazin | 2 : 1 | 48–52 °C | [12] |
| 1,2-Dimethylhydrazin | 1 : 1 | 102–105 °C | [12] |
| 1,1-Dimethylhydrazin | 1 : 1 | 44–48 °C | [12] |
| 1,1-Dimethylhydrazin | 2 : 1 | 107–109 °C | [12] |
| Pyridin | 1 : 1 | 152 °C | [13][10][14] |
| 3,5-Lutidin | 1 : 1 | [10] | |
| 2,4-Lutidin | 1 : 1 | [10] | |
| 2,6-Lutidin | 1 : 1 | [10] | |
| Chinoxalin | 1 : 1 | [10] | |
| 3,6-Diaminoacridin | 1 : 2 | 252–255 °C | [13] |
Die Verbindung zersetzt sich bei höheren Temperaturen. Als Zersetzungstemperatur mit dem Kriterium einer Zersetzungsgeschwindigkeit von 1 mol%·h−1 werden 357 °C angegeben.[15]
Verwendung
Die Verbindung kann als flammenhemmendes Additiv in Polymeren wirken.[16] In der organischen Synthese kann sie als alternative Substanz zu Boronsäuren bei Miyaura-Suzuki-Kupplungen[17] oder durch Rhodium katalysierte Kupplungen[18] verwendet werden.
Einzelnachweise
- Eintrag zu 2,4,6-Triphenylboroxin bei TCI Europe, abgerufen am 29. April 2014.
- Datenblatt 2,4,6-TRIPHENYLBOROXIN, Aldrich bei Sigma-Aldrich, abgerufen am 29. April 2014 (PDF).
- Sporzynski, A.; Szatylowicz, H.: Can triorganoboroxins exist in a “monomeric” R-B-O form? MNDO calculations and ebulliometric molecular weight determination in J. Organomet. Chem. 470 (1994) 31–34, doi:10.1016/0022-328X(94)80145-2.
- Michaelis, A.; Becker, P.: Ueber Monophenylborchlorid und einige Derivate desselben in Chem. Ber. 15 (1882) 180–185, doi:10.1002/cber.18820150143.
- Washburn, R.M.; Levens, E.; Albright, C.F.; Billig, F.A.: Benzeneboronic Anhydride In: Organic Syntheses. 39, 1959, S. 3, doi:10.15227/orgsyn.039.0003; Coll. Vol. 4, 1963, S. 68 (PDF).
- Tokunaga, Y.; Ueno, H.; Shimomura, Y.; Seo, T.: Formation of Boroxine: Its Stability and Thermodynamic Parameters in Solution in Heterocycles 57 (2002) 787–790, doi:10.3987/COM-02-9464.
- Hennion, G.F.; McCusker, P.A.; Ashby, E.C.; Rutkowski, A.J.: Organoboron Compounds. VIII. The Reaction of Triorganoboranes with Boric Oxide in J. Am. Chem. Soc. 79 (1957) 5194–5196, doi:10.1021/ja01576a032.
- Brock, C.P.; Minton, R.P.; Niedenzu, K.: Structure and Thermal Motion of Triphenylboroxin in Acta Cryst. C43 (1987) 1775–1779, doi:10.1107/S010827018709022X.
- Yabroff, D.L.; Branch, G.E.K.: Addition Compounds of Phenylboric Acid with Bases in J. Am. Chem. Soc. 55 (1933) 1663–1665, doi:10.1021/ja01331a057.
- Yalpani, M.; Boese, R.: The structure of amine adducts of Triorganylboroxines in Chem. Ber. 116 (1983) 3347–3358, doi:10.1002/cber.19831161011.
- Fieldner, W.L.; Chamberlain, M.M.; Brown, C.A.: Formation of an adduct of triphenylboroxine and p-phenylenediamine in J. Org. Chem. 26 (1961) 2154–2155, doi:10.1021/jo01065a637.
- Das, M.K.; Mariategui, J.F.; Niedenzu, K.: Boron-nitrogen compounds. 114. Hydrazine complexes of B-triorganoboroxins in Inorg. Chem. 26 (1987) 3114–3116, doi:10.1021/ic00266a011.
- Snyder, H.; Konecky, M.; Lennarz, W.: Aryl Boronic Acids. II. Aryl Boronic Anhydrides and their Amine Complexes in J. Am. Chem. Soc. 80 (1958) 3611–3615, doi:10.1021/ja01547a033.
- Beckmann, J.; Dakternieks, D.; Duthie, A.; Lim, A.E.K.; Tiekink, E.R.T.; Tiekink, E.R.T.: Ring strain in boroxine rings: computational and experimental considerations in J. Organomet. Chem. 633 (2001) 149–156, doi:10.1016/S0022-328X(01)01060-9.
- Johns, I.B.; McElhill, E.A.; Smith, J.O.: Thermal Stability of Some Organic Compounds in J. Chem. Eng. Data 7 (1962) 277–281, doi:10.1021/je60013a036.
- Morgan, A.B.; Jurs, J.L.; Tour, J.M.: in Polym. Prep. 40 (1999) 553.
- Miyaura, N.; Suzuki, A.: Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds in Chem. Rev. 95 (1995) 2457–2483, doi:10.1021/cr00039a007.
- Hayashi, T.; Inoue, N.; Taniguchi, N.; Ogasawara, M.: Rhodium-Catalyzed Hydroarylation of Alkynes with Arylboronic Acids: 1,4-Shift of Rhodium from 2-Aryl-1-alkenylrhodium to 2-Alkenylarylrhodium Intermediate in J. Am. Chem. Soc. 123 (2001) 9918–9919, doi:10.1021/ja0165234.