Chinuclidin
Chinuclidin ist eine chemische Verbindung aus der Gruppe der bicyclischen, tertiären Amine.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
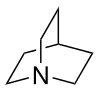 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Chinuclidin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H13N | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 111,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,1334 g·cm−3 (48 °C)[1] | ||||||||||||||||||
| Schmelzpunkt |
158–160 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Es hat strukturelle Ähnlichkeit mit 1,4-Diazabicyclo(2.2.2)octan (DABCO), welches auch am zweiten Brückenkopf ein Stickstoff-Atom trägt. Es ist die Stammverbindung der Chinuclidine, von der zahlreiche Derivate abgeleitet werden können.
Chinuclidin kommt in der Natur nicht vor; als Strukturelement ist es aber in Chinin, Chinidin und in weiteren Chinolin-Alkaloiden enthalten.
Geschichte und Synthese
Über diese chemische Verbindung wurde im Jahre 1909 von Karl Löffler und Fritz Stietzel berichtet.[3] Der kroatische Chemiker Vladimir Prelog und Mitarbeiter fanden, dass die beschriebene Substanz nicht rein sein konnte, und publizierten 1937 eine neue Synthese, die auch zum Patent angemeldet wurde.[4][5] Prelogs Synthese besteht aus mehreren Reaktionsschritten (Stufen), von denen nur die letzte als Formelschema wiedergegeben werden soll.
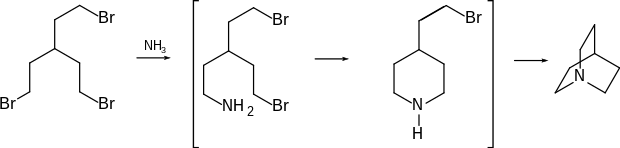
3-(2-Bromethyl)-1,5-dibrompentan wurde in einem Autoklaven mit einer 20-prozentigen Lösung von wässrigem Ammoniak in Methanol auf 130–140 °C erhitzt. Nach 3-stündigem Erhitzen wurde aufgearbeitet, und Chinuclidin in 50 % Ausbeute erhalten. Es wurde als farblose, campher-ähnliche Substanz mit Schmelzpunkt 158–159 °C beschrieben.
Verwendung
Das Hydrochlorid des Chinuclidins wurde pharmakologisch untersucht. Es erniedrigt stark den Blutdruck des Kaninchens und der Katze und kontrahiert stark die glatte Muskulatur, z. B. den Dünndarm des Meerschweinchens oder die Dorsalmuskulatur des Blutegels.[6] Diese Wirkungen beruhen auf der Interaktion mit den muskarinischen Acetylcholin-Rezeptoren.
In der Synthesechemie kann Chinuclidin, das an einer Ionischen Flüssigkeit immobilisiert wird, als Katalysator für eine Baylis-Hillman-Reaktion verwendet werden.[7]
Einzelnachweise
- Eintrag zu Chinuclidin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Februar 2020.
- Datenblatt Quinuclidine bei Sigma-Aldrich, abgerufen am 23. Februar 2021 (PDF).
- Karl Löffler, Fritz Stietzel: γ-Picolylalkine, γ-Pipecolinylalkine, und Chinuclidine. In: Berichte der deutschen Chemischen Gesellschaft, Jg. 1909, Bd. 42, S. 124–132.
- V. Prelog D. Kohlbach, E. Cerkovnikov, A. Režek, M. Piantanida: Über Chinuclidin. Bicyclo[2,2,2]aza-1-octan. In: Justus Liebigs Annalen der Chemie, Jg. 1937, Bd. 532, Heft 1, S. 69–82. doi:10.1002/jlac.19375320106.
- US-Patent 2,192,840, angemeldet am 30. Juli 1938, Erfinder Vlado Prelog.
- Pavao Stern, Über die pharmakologische Wirkung von Chinuclidin und verwandten Verbindungen, In: Naunyn-Schmiedebergs Archiv für experimentelle Pathologie und Pharmakologie, Jg. 1940, Bd. 197, S. 377–383.
- Xueling Mi, Sanzhong Luo, Jin-Pei Cheng: Ionic Liquid-Immobilized Quinuclidine-Catalyzed Morita-Baylis-Hillman Reactions. In: The Journal of Organic Chemistry. Band 70, Nr. 6, März 2005, S. 2338–2341, doi:10.1021/jo048391d.

