Rutherford-Streuung
Die Rutherford-Streuung beschreibt die Streuung von geladenen Partikeln an einem geladenen Streuzentrum. Im Ausgangsversuch wurde die Streuung von Alpha-Teilchen an Gold-Atomkernen untersucht. Die sich daraus ergebenden Teilchenbahnen sind Hyperbeln. Die Verteilung der gestreuten Teilchen lässt auf die Struktur des Streuzentrums rückschließen. Dies führte zur Erkenntnis, dass die positive Ladung in den Atomen sich auf einen kleinen Raum im Atomzentrum konzentriert. Bis dahin galt das Modell von J. J. Thomson, bei dem die positive Ladung des Atoms homogen in einer Kugel verteilt ist (thomsonsches Atommodell). An diesen Experimenten waren unter Ernest Rutherfords Leitung Hans Geiger und Ernest Marsden beteiligt. Bei der Betrachtung der Messergebnisse, die darauf hinweisen, dass die Masse des Atoms in einem kleinen Kern konzentriert ist, soll Rutherford gesagt haben: „Dies ist so unwahrscheinlich, als ob man mit einer Pistole auf einen Wattebausch schießt, und die Kugel zurückprallt.“[1]
Rutherfordscher Streuversuch (Manchester, 1909–1913)
Aufbau und Versuchsdurchführung
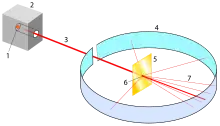
In einen Bleiblock mit Öffnung zu einer Seite hin wird ein radioaktiver Stoff gelegt, der Strahlung abgibt: Alpha-, Beta- und Gamma-Strahlung. Die aus der Öffnung im Bleiblock austretenden Strahlen werden durch ein elektrisches Feld geleitet um sie voneinander zu trennen. Dadurch werden die negativen Elektronen (Beta-Strahlen) zum positiven Pol und die positiven Helium-Atomkerne (Alpha-Strahlen) zum negativen Pol abgelenkt, während die Richtung der ungeladenen Photonen (Gamma-Strahlen) unverändert bleibt. Die Alpha-Strahlung wird senkrecht auf eine nur 0,5 μm dicke Goldfolie (ca. 1000 Atome hintereinander) gerichtet. Die aus der Folie austretende Strahlung lässt sich danach mit einem Leuchtschirm oder einem daran befestigten Film sichtbar machen. Gold wurde verwendet, da es sich schon damals mit einfachen mechanischen Mitteln zu sehr dünnen Schichten verarbeiten ließ und eine hohe Atommasse besitzt. Daher stammt auch die Bezeichnung Goldfolienexperiment.
Beobachtung
_v1.1.svg.png.webp)
- Fast alle Alpha-Teilchen können die Goldfolie ungehindert passieren.
- Etwa jedes 100000ste Alpha-Teilchen wird um 90 Grad oder mehr abgelenkt.[2]
- Je größer der Streuwinkel, desto seltener tritt diese Ablenkung auf.
- Einige Alpha-Teilchen werden zurückgestreut.
Für die beobachtete Verteilung hat Rutherford die unten beschriebene Streuformel entwickelt.
Interpretation
Die extrem seltene Ablenkung der Alpha-Teilchen und deren Winkelverteilung lassen sich dadurch verstehen, dass sich in den Atomen nur ein sehr kleines Massezentrum befindet, das positiv geladen ist. Man nennt dieses Massezentrum den Atomkern. Da die meisten Teilchen die Goldfolie ungehindert passieren, muss zwischen den Kernen ein großer Freiraum bestehen. Dieses Ergebnis führte zu dem rutherfordschen Atommodell. Die Elektronen, welche sich in dem relativ zum Kerndurchmesser riesigen leeren Raum um den Kern bewegen, schirmen die konzentrierte positive Kern-Ladung ab, sodass das Atom nach außen hin neutral erscheint.
Rutherfordsche Streuformel
Die rutherfordsche Streuformel gibt den so genannten differenziellen Streuquerschnitt (auch Wirkungsquerschnitt genannt) in Abhängigkeit vom Streuwinkel im Schwerpunktsystem an:
Die gleiche Formel in kernphysikalisch sinnvollen Einheiten:
Damit ist die Wahrscheinlichkeit beschrieben, dass gestreute Teilchen nach einer Ablenkung um den Winkel im Raumwinkel auftreffen.
In der Formel werden weiterhin folgende Größen benutzt:
| Elektrische Feldkonstante (Dielektrizitätskonstante) | |
| Ladung des gestreuten Teilchens | |
| Ladung des Atomkerns | |
| Elementarladung | |
| Anfangsenergie des gestreuten Teilchens |
Auf den Vorfaktor kommt man, indem man folgende Größen verwendet:
| Feinstrukturkonstante | |
| Einheit für den Wirkungsquerschnitt | |
Rutherford leitete die rutherfordsche Streuformel aus der klassischen Physik her. Eine vollständige quantenmechanische Behandlung des Problems mit Hilfe der bornschen Näherung ergibt, dass die rutherfordsche Streuformel in erster Ordnung korrekt ist und quantenmechanische Effekte nur kleine Korrekturen darstellen. Ein weiteres Problem der rutherfordschen Formel ist der Grenzfall , für die der differentielle Wirkungsquerschnitt unendlich groß wird. Kleine Winkel entsprechen jedoch einem großen Stoßparameter. Bei sehr großen Stoßparametern schirmen die Atomelektronen den Kern jedoch ab. Die einzige Möglichkeit sehr kleine Winkel bei kleinen Stoßparametern zu haben, ist die Energie der Alpha-Teilchen zu erhöhen. Für sehr hohe Energien kann die Ladungsverteilung des Atomkerns jedoch nicht mehr als punktförmig angenommen werden. Dann geht der Formfaktor der Ladungsverteilung zusätzlich in die Streuformel ein. Außerdem kann man bei hohen Projektilenergien nicht mehr davon ausgehen, dass die Streuung nur durch elektromagnetische Wechselwirkung geschieht. Nähern sich beide Kerne bis zu einem Kontaktradius, spielt die starke Wechselwirkung eine größere Rolle.
Plausibilitätsbetrachtung der Abhängigkeiten
Nach den Feynman-Regeln ergibt sich für die Streuung eines Teilchens der Ladung an einem zweiten Teilchen der Ladung für das Matrixelement
wobei der Propagator vernachlässigt wurde. Nach Fermis Goldener Regel gilt
womit folgt, dass
Herleitung der Rutherford-Streuformel
Aufgrund der abstoßenden Wirkung der Coulombkraft ergibt sich für die Bahn des Alphateilchens () eine Hyperbel.

Die große Halbachse a der Hyperbel lässt sich aus dem Ansatz
bestimmen, wobei sich aufgrund der Hyperbelform der Bahn als der minimale Abstand des Alphateilchens ergibt, wenn es zentral mit dem Kern stößt. ist von der kinetischen Energie abhängig und kann auch für Stöße, die nicht zentral sind, übernommen werden. Der Stoßparameter ist der minimale Abstand des Alphateilchens zum Kern, wenn es auf einer Geraden weiter fliegen würde. Tatsächlich wird das Alphateilchen um den Winkel gestreut. Aus der Geometrie der Hyperbel erhält man folgende Gleichungen:
- ,
da und damit
- .
Durch Ableitung der letzten Formel erhält man einen Zusammenhang zwischen der Breite eines Hohlzylinders und der zugehörigen Breite des Ablenkwinkels .
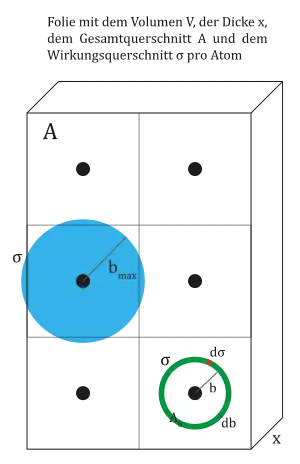
Sei die Teilchendichte ( Atome pro Volumen ) des Streumaterials und die Dicke der Folie, so gibt die durchschnittliche Querschnittsfläche pro Atom an, die das Alphateilchen beim Durchgang durch die Folie erfährt. nennt man auch den Wirkungsquerschnitt.
Die Wahrscheinlichkeit im Ring des Hohlzylinders zu landen ergibt sich dann aus
- .
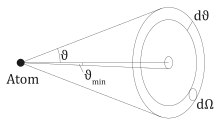
Von Teilchen werden in den Hohlkegel gestreut. Die Wahrscheinlichkeit dafür ist
gibt die Anzahl der Teilchen in den Raumwinkel an.
Daraus folgt:
- .
So ergibt sich für die Wahrscheinlichkeit
Dies ist die Rutherford-Streuformel. Sie gibt an, wie hoch die Wahrscheinlichkeit für ein Teilchen ist, in den Raumwinkel gestreut zu werden.
Oft wird die Streuformel mit Hilfe des differentiellen Wirkungsquerschnitts angegeben. Er ist ein Maß für die gleiche Wahrscheinlichkeit.
Es gilt
und damit
Bemerkungen
- ist nicht definiert, da es einen minimalen Ablenkwinkel gibt. Dieser wird angenommen, wenn sich das Alphateilchen im Abstand vom Atom, also am Rand der kreisförmigen Wirkungsquerschnittsfläche bewegt. Für einen größeren Stoßparameter befindet sich das Alphateilchen im Streufeld des Nachbaratoms und der Ablenkwinkel nimmt wieder zu.
Dabei gilt:
und- .
- Das Integral über die Wahrscheinlichkeitsverteilung ergibt 1
- Ähnliches gilt für die Flächenintegrale
und
Siehe auch
- Rutherford Backscattering Spectrometry
- Atomkern
- Geiger–Marsden experiments (engl. Wikipedia)
Literatur
- E. Rutherford, The Scattering of α and β Particles by Matter and the Structure of the Atom, Philosophical Magazine. Series 6, 21 (May 1911) p. 669–688 (PDF, Kurzfassung)
- H. Geiger and E. Marsden, On a Diffuse Reflection of the α-Particles (Memento vom 24. April 2008 im Internet Archive), Proceedings of the Royal Society 82A (1909), p. 495–500
- H. Geiger and E. Marsden, LXI. The Laws of Deflexion of a Particles through Large Angles, Philosophical Magazine 25 (1913), p. 604–623
- Gerthsen, Kneser, Vogel: Physik, 16. Auflage, S. 630–633, Springer-Verlag
Weblinks
- LP - Rutherfordsches Streuexperiment (inkl. Skizzen, Fotos, Video und Literaturhinweisen)
- Rutherfordexperiment auf Schülerniveau (LEIFIphysik)
Einzelnachweise
- Wolfgang Demtröder: Experimentalphysik 3: Atome, Moleküle und Festkörper. Springer Berlin Heidelberg, 13. Juni 2016, ISBN 978-3-662-49094-5, S. 64.
- Eckhard Ignatowitz: Chemie für Schule und Beruf: ein Lehr- und Lernbuch. 5. Auflage. Verl. Europa-Lehrmittel Nourney, Vollmer, Haan-Gruiten 2014, ISBN 978-3-8085-7056-2.