trans-Crotonaldehyd
trans-Crotonaldehyd ist eine organisch-chemische Verbindung aus der Stoffgruppe der ungesättigten Aldehyde. Es ist eines der beiden Strukturisomere der Crotonaldehyde, daneben existiert noch der technisch weitaus weniger bedeutende cis-Crotonaldehyd.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
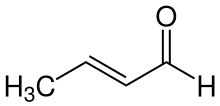 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | trans-Crotonaldehyd | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C4H6O | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit scharfem, stickigen Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 70,09 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||||||||
| Dichte |
0,85 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
102 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,4362 (20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−138,7 kJ/mol[6] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Vorkommen
In der Natur kommt Crotonaldehyd vor allem im Crotonöl, welches aus den Pflanzen der Gattung Croton hergestellt wird, vor.[7]
Gewinnung und Darstellung
Großtechnisch hergestellt wird trans-Crotonaldehyd durch eine basenkatalysierte Aldolreaktion von Acetaldehyd. Dieses wird zunächst in einer Aldoladditionsreaktion bei milden Temperaturen zu 3-Hydroxybutanal (Acetaldol) umgesetzt. Im Anschluss erfolgt eine Aldolkondensationsreaktion bei erhöhter Temperatur und mit Essigsäure als Katalysator zu trans-Crotonaldehyd.[2][8]
Die Aufarbeitung des Produkts erfolgt durch mehrstufige Destillation.[2][8]
Eigenschaften
Crotonaldehyd ist eine leicht brennbare Flüssigkeit mit stechendem Geruch. Die Verbindung ist in Wasser nur wenig, in gängigen organischen Lösungsmitteln dagegen gut löslich. Sie neigt in Gegenwart von Sauerstoff zur Bildung von Peroxiden und zur Autoxidation.
Biologische Bedeutung
Im menschlichen Körper entsteht Crotonaldehyd ebenfalls aus Acetaldehyd. Polyamine, normalerweise natürliche Schutzstoffe der Zelle, erleichtern nach dem Alkoholkonsum die Umwandlung von Acetaldehyd in Crotonaldehyd. Dieses wiederum steht in starkem Verdacht, die DNA zu verändern und für die Entstehung von Krebs verantwortlich zu sein.
Verwendung
Die Oxidation von Crotonaldehyd liefert Crotonsäure.[9] Die Reduktion von Crotonaldehyd liefert Crotylalkohol.[10][11]
Weblinks
Einzelnachweise
- Eintrag zu trans-Crotonaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu (E)-But-2-enal. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. März 2019.
- R. A. Raphael, Franz Sondheimer: 598. The synthesis of long-chain aliphatic acids from acetylenic compounds. Part V. The synthesis of trans-cis-herculin. In: Journal of the Chemical Society (Resumed). 1951, S. 2693, doi:10.1039/jr9510002693.
- Eintrag zu (E)-Crotonaldehyd im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 28. Februar 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 123-73-9 bzw. 2-Butenal), abgerufen am 14. September 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 749.
- Eintrag zu (E)-Crotonaldehyde in der Hazardous Substances Data Bank, abgerufen am 1. März 2019 (online auf PubChem).
- Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2, S. 230.
- Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 506.
- William G. Young, Walter H. Hartung, Frank S. Crossley: Reduction of Aldehydes with Aluminum Isopropoxide, in: J. Am. Chem. Soc., 1936, 58 (1), S. 100–102; doi:10.1021/ja01292a033.




