Streptogramine
Streptogramine sind eine Gruppe von Antibiotika, deren Vertreter Stoffgemische aus zwei strukturell verschiedenen Komponenten darstellen.[1] Beide Komponenten hemmen jeweils die Proteinbiosynthese von Bakterien und verhindern so deren weiteres Wachstum.[2] Ihre Kombination bewirkt eine überadditive, das heißt synergistische, antibiotische Wirksamkeit.
Bedeutung erlangten Streptogramine vor allem durch die fortschreitende Resistenzentwicklung gegenüber älteren Antibiotika wie Penicillinen oder Makroliden. Sie stehen derzeit nicht auf dem Arzneimittelmarkt zur Verfügung.
Struktur
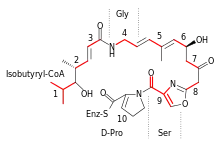
.png.webp)
Streptogramine werden natürlicherweise im Sekundärstoffwechsel einer Reihe von Arten der Streptomyces und Actinoplanes gebildet. Sie bestehen stets aus zwei Komponenten, von denen eine der Gruppe A und die andere der Gruppe B zuzurechnen ist. Die einzelnen Verbindungen jeder Gruppe unterscheiden sich geringfügig in einigen Substituenten, funktionellen Gruppen oder Aminosäurenkomponenten.[3]
Gruppe A
Die Gruppe-A-Streptogramine sind mehrfach ungesättigte Macrolactone. Sie enthalten Peptid- und Polyketidstrukturelemente. Die cyclische Struktur entsteht durch eine intramolekulare Esterbindung zwischen der Carboxygruppe der C-terminalen Aminosäure, üblicherweise Prolin (Pristinamycin II) und einer Hydroxygruppe. Strukturelle Variationen entstehen beispielsweise durch Austausch des Prolins durch Alanin (Madumycin II) oder Cystein (Griseoviridin).
Gruppe B
Gruppe-B-Streptogramine stellen verzweigte cyclische Hexa- oder Heptadepsipeptide aus der Klasse der Peptid-Antibiotika dar. Allgemein weisen Gruppe-B-Streptogramine folgende Sequenz auf:
3-Hydroxypicolinsäure, L-Threonin, D-Aminobuttersäure (oder D-Alanin), L-Prolin, L-Phenylalanin (oder 4-N,N-(Dimethylamino)-L-phenylalanin), X, L-Phenylglycin. Der Rest X steht in der Regel für L-4-Oxo- oder 4-Hydroxypipecolinsäure, an der Stelle kann aber auch Asparaginsäure oder Prolin vorhanden sein.
Beispiele
| Kombination | Streptogramin Gruppe A | Streptogramin Gruppe B |
|---|---|---|
| Natürliche | ||
| Pristinamycin | Pristinamycin IIA (= Streptogramin A) | Pristinamycin IA (= Streptogramin B) |
| Virginiamycin | Pristinamycin IIA | Virginiamycin S1 |
| Teilsynthetische | ||
| RP 59500 (Synercid) | Dalfopristin | Quinupristin |
| NXL103 (XRP 2868) | Flopristin | Linopristin |
Durch chemische Modifikationen entstehen Varianten, die sich therapeutisch verwenden lassen, da sie besser wasserlöslich (Dalfopristin, Quinupristin) oder auch oral wirksam (Flopristin, Linopristin) sind.
Wirkungsmechanismus
Die Vertreter beider Untergruppen binden an die P-Stelle der 50S-Untereinheit des Ribosoms und hemmen so die Elongation der Proteinsynthese. Einzeln betrachtet sind diese beiden Wirkstoffe nur bakteriostatisch wirksam, das heißt, dass sie nur das Wachstum von Bakterien hemmen können, sie jedoch nicht zerstören. Zusammen eingesetzt, häufig in einer 70:30-Mischung eines Gruppe-A-Streptogramins mit einem Gruppe-B-Streptogramin, zeigt sich ein Synergismus, der Bakterien sogar direkt tötet (bakterizide Wirkung). Möglich ist dies aufgrund einer Konformationsänderung der 50S-Untereinheit, nachdem Streptogramine der Gruppe A gebunden haben, die es Streptograminen der Gruppe B ermöglichen, eine 100-fach höhere Aktivität zu zeigen.
Gruppe-A-Streptogramine alleine blockieren eine frühe Phase der Elongation, indem sie die Donor- und Akzeptorstellen des Ribosoms blockieren. Ihnen ist es nur möglich an das Ribosom zu binden, wenn dieses frei von einer gebundenen Acyl-tRNA ist. Gruppe-B-Streptogramine jedoch können in jeder Phase der Proteinsynthese das Ribosom besetzen und führen so zu einer Hemmung der Elongation, als auch zu einer Freisetzung von inkompletten Peptiden.[3]
Resistenzmechanismen und Wirkungsspektrum
Obwohl das Einsatzgebiet dieser Antibiotika-Klasse sich auf multiresistente Bakterien beschränken sollte, kennt man schon diverse Resistenzmechanismen. Interessanterweise zeigt sich aufgrund des ähnlichen Wirkungsmechanismus oft eine Kreuzresistenz zwischen Streptograminen, Makroliden und Lincosamiden, die auf diverse 23S-rRNA-Methylasen, also Enzyme, die RNA-Moleküle methylieren können, zurückzuführen ist. Damit wird die Wirkungsstätte dieser Antibiotika so verändert, dass eine Interaktion zwischen Antibiotikum und Ribosom nicht mehr möglich ist.
Ein anderer weit verbreiteter Mechanismus von Bakterien ist es, ähnlich wie Tumorzellen, die unerwünschte Substanz wieder auszuschleusen, bevor diese wirksam werden kann. So fand man ABC-Transporter, eine Familie ATP-abhängiger Pumpen, die spezifisch für Streptogramine sind. Eine direkte Kreuzresistenz ist durch diese Pumpen nicht zu erwarten, da diese Transporter in Abhängigkeit vom chemischen Aufbau der Stoffe agieren. Es wurden jedoch Plasmide gefunden, die mehrere Gene für Antibiotikaresistenzen enthalten, die auch Streptogramine einschließen. Außerdem fand man Lyasen, die in der Lage sind, Streptogramine zu spalten und somit direkt zu deaktivieren.[4]
Heute kann man davon ausgehen, dass die meisten grampositiven Bakterien wie Staphylokokken, Streptokokken, Enterokokken gegenüber Synercid empfindlich sind, inklusive der multiresistenten Stämme. Ausgenommen hiervon ist Enterococcus faecalis, welches eine natürliche Resistenz aufgrund einer Effluxpumpe zeigt, sowie Enterobakterien und Pseudomonaden. Im Wirkungsspektrum werden auch aerobe gramnegative Bakterien erfasst wie Moraxella catarrhalis, Legionellen, Neisserien, Haemophilus influenzae, jedoch zu einem geringeren Grad, sowie anaerobe Bakterien, zum Beispiel Bacteroides, Lactobacillus, Clostridium perfringens und Clostridium difficile.[5]
Das Einsatzgebiet beschränkt sich heute auf komplizierte Hautinfektionen, durch Gruppe-A-Streptokokken und Methicillin-empfindliche Staphylokokken sowie auf Infektionen mit Vancomycin-resistenten Stämmen von Enterococcus faecium und nosokomiale, also im Krankenhaus erworbene, Lungenentzündungen.[6]
Nebenwirkungen
Einschränkungen in der Anwendung der Streptogramin-Antibiotika ergeben sich einerseits durch häufige Wechselwirkungen mit anderen Arzneistoffen, andererseits durch unerwünschte Wirkungen, die sich zum Beispiel in Muskel- und Gelenkschmerzen, Übelkeit oder Entzündungen an der Infusionsstelle ergeben.
Die heute klinisch verwendeten Streptogramine zeigen keine gute orale Bioverfügbarkeit, weshalb sie intravenös verabreicht werden müssen. Hierbei kann es zu lokalen Irritationen der peripheren Venen kommen. Beobachtet wurden Ödeme, Entzündungen des umliegenden Gewebes sowie der Venenwand (Phlebitis) und Thrombosen. Deshalb wird empfohlen, Streptogramine über einen ZVK zu verabreichen, um die lokale Konzentration durch das größere Lumen geringer zu halten. Bei bis zu 30 % der Patienten treten dosisabhängige Muskelschmerzen (Myalgien) und Gelenkschmerzen (Arthralgien) auf, die mit herkömmlicher analgetischer Therapie, sei es mit NSAR oder mittels Opioidanalgetika, gut behandelbar sind und nach Beendigung der Therapie vollständig verschwinden.[7][6] Seltenere unerwünschte Arzneimittelwirkungen sind ein erhöhtes konjugiertes Bilirubin, Hyponatriämie und Anämie.
Streptogramine hemmen die hepatische Monooxygenase CYP3A4, ein System, das für den Abbau diverser Arzneimittel zuständig ist. Zu den prominentesten Beispielen zählen Amiodaron, Ciclosporin, Diazepam, Lidocain, Warfarin oder Phenytoin. Bei Kombinationen solcher Arzneimittel mit Streptograminen oder aber bei Leberschädigungen sind Dosisanpassungen in Erwägung zu ziehen. Renale Insuffizienzen erfordern keine Dosisreduktion.[8]
Einzelnachweise
- R. Kosla et al.: Streptogramins: A new class of antibiotics. Indian J Med Sci. 1999 Mar; 53(3):111-9. PMID 10798011
- Bergeron M, Montay G: The pharmacokinetics of quinupristin/dalfopristin in laboratory animals and in humans. In: J. Antimicrob. Chemother.. 39 Suppl A, Mai 1997, S. 129–38. PMID 9511077.
- Mukhtar TA, Wright GD: Streptogramins, oxazolidinones, and other inhibitors of bacterial protein synthesis. In: Chem. Rev.. 105, Nr. 2, Februar 2005, S. 529–42. doi:10.1021/cr030110z. PMID 15700955.
- Woodford N: Biological counterstrike: antibiotic resistance mechanisms of Gram-positive cocci. In: Clin. Microbiol. Infect.. 11 Suppl 3, Mai 2005, S. 2–21. doi:10.1111/j.1469-0691.2005.01140.x. PMID 15811020.
- Eliopoulos GM: Quinupristin-dalfopristin and linezolid: evidence and opinion. In: Clin. Infect. Dis.. 36, Nr. 4, Februar 2003, S. 473–81. PMID 12567306.
- Fraser TG, Hansen C, Long JK: Newer antibiotics for serious gram-positive infections. In: Cleve Clin J Med. 73, Nr. 9, September 2006, S. 847–53. PMID 16970136.
- Olsen KM, Rebuck JA, Rupp ME: Arthralgias and myalgias related to quinupristin-dalfopristin administration. In: Clin. Infect. Dis.. 32, Nr. 4, Februar 2001, S. e83–6. PMID 11181142.
- Lincosamides, Oxazolidinones, and Streptogramins. The Merck Manual. November 2005. Abgerufen am 24. August 2008.