Clostridium perfringens
Clostridium perfringens (lateinisch perfringere ‚durchbrechen‘) ist ein stäbchenförmiges, grampositives, endosporenbildendes, unbegeißeltes Bakterium der Gattung Clostridium. In (älterer) Fachliteratur findet sich auch gelegentlich die Bezeichnung Welch-Fraenkelscher Gasbazillus[1] bzw. Clostridium welchii.[2]
| Clostridium perfringens | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
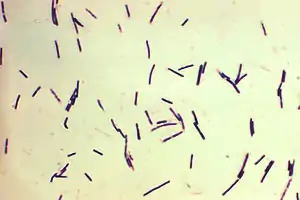
Clostridium perfringens | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Clostridium perfringens | ||||||||||||
| (Veillon & Zuber 1898) Hauduroy et al. 1937 |
Vorkommen
C. perfringens ist ein strikter Anaerobier, der das kurzzeitige Aussetzen in sauerstoffreicher Atmosphäre aber problemlos überlebt. Der Organismus kann im Boden (anaerobe Zonen), in Wasser, Staub und Lebensmitteln, aber auch im Darm von Mensch und Tier nachgewiesen werden (1.000 bis 10.000 Keime/g Fäzes). Im Boden zählen Clostridien zu den wichtigsten anaerob Cellulose-abbauenden Mikroorganismen.
Das Temperaturoptimum von C. perfringens liegt bei ca. 43 bis 47 °C (mit Generationszeiten von 8 bis 12 min), Extrembereich min. bei 10 bis 18 °C und max. bei 50 bis 52 °C. Die Sporen können in Abhängigkeit von diversen Umweltfaktoren, Temperaturen von 60 °C überleben. Die Hitzeresistenz ist je nach Stamm sehr variabel und kann bei 100 °C bis zu 60 min betragen. Das Toxin ist hitzelabil (4 min bei 60 °C). Als Dezimale Reduktionszeit werden 15 bis 145 min bei 90 °C und 0,31 bis 38 min bei 100 °C angegeben.
Toxine
C. perfringens der Serotypen A, B, C, D und E bildet für den Menschen pathogene Exotoxine (Enterotoxine) aus. Durch den Nachweis der wesentlichen Toxine α, β, ε, ι können diese Serotypen des C. perfringens unterschieden werden.[1] Gasbrandkeime bilden mindestens zwölf Toxine, die als Enzyme (Proteasen, Kollagenasen, Desoxyribonukleasen und Phospholipasen) wirken. Diese Enzyme bauen Gewebe ab und führen zu Nekrosen im betroffenen Muskelgewebe.
Pathogenese und Pathologie
Der Erreger zählt mit weiteren Clostridien zur Gruppe der Gasbrandbazillen und ist der häufigste Erreger des Gasbrands (70 bis 80 %). Darüber hinaus ist das Bakterium häufiger Verursacher der nekrotisierenden Pneumonie, der gangränösen Cholezystitis, einer Sepsis oder anderer unspezifischer Infektionskrankheiten. In der Humanmedizin sind insbesondere Typ A und Typ C von Bedeutung.[3] Darüber hinaus kann Clostridium perfringens Infektionserkrankungen des Zentralen Nervensystems verursachen, wovon die häufigste die clostridiale Meningitis ist, die sich meist aus einer Clostridien-Sepsis entwickelt, aber auch infolge von lokalen Traumen oder Operationen, wie der Ausräumung eines subduralen Hämatoms, entstehen kann. Seltener wurden auch Fälle einer clostridialen Enzephalitis beschrieben.[4] Bei Tieren werden die Erkrankungen durch Clostridium-perfringens-Toxine als Enterotoxämie bezeichnet.
Gasbrand
Clostridium perfringens ist häufigster, jedoch nicht einziger Erreger des clostridialen Myositis – dem sogenannten Gasbrand. Dieser gilt neben Wundstarrkrampf und Botulismus als eine schwersten der Clostridienkrankheiten und wird auch als „clostridiale Myonekrose“[1] oder Gasgangrän[5] bezeichnet. Die Krankheit entwickelt sich meist nach Verletzungen mit Infektion bei Gartenarbeit oder Tätigkeiten im landwirtschaftlichen Bereich, aber auch nach Bissverletzungen oder Amputationen und hat eine Inkubationszeit von ca. 2 Tagen. Das Infektionsgebiet kennzeichnet sich durch Schwellung und bräunlich-livide Verfärbung. Bei der Palpation kann gegebenenfalls ein „Knistern“ (Crepitatio) festgestellt werden. Aus der Wunde entleert sich häufig stinkendes, seröses Wundsekret. Erfolgt keine schnelle Behandlung, kann es durch einen toxininduzierten Schock binnen Stunden zum Tod des Infizierten kommen.[1] Trotz optimaler Therapie ist die Letalität hoch und liegt bei 40 bis 60 %. Allerdings ist die Krankheit aufgrund einer guten chirurgischen Versorgung in der Bundesrepublik Deutschland selten geworden; im Jahre 1998 gab es in Deutschland 114 gemeldete Fälle von Gasbrand.[6]
Als pathomechanische Ursache des Gasbrandes lassen sich Clostridium-perfringens-Bakterien vom Serotyp A nachweisen. Diese zerstören durch ihr α-Toxin – eine Lecithinase, die membranständiges Lecithin in Phosphorylcholin und Diacylglycerol spaltet – die Zellmembranen im Infektionsgebiet. Die Vermehrung der toxinbildenden Erreger bzw. die Auskeimung der Sporen von C. perfringens wird dabei durch eine Senkung des Redoxpotentials im Gewebe – beispielsweise bei verminderter Durchblutung, Sekretansammlung oder Nekrose – angeregt. Demzufolge begünstigen Quetschwunden, verschmutzte Schürfwunden, große Wundhöhlen nach Amputation oder Pfählungswunden eine Infektion.[1]
Intestinale Infektionen
C. perfringens zählt zudem zu den Lebensmittelvergiftern. Die Infektionsdosis liegt bei 700.000 Individuen/g, bei Lebensmitteln meist noch höher. Gefährdete Lebensmittel sind warmgehaltenes Fleisch (Rindfleisch, Geflügel), Austern und andere Meeresfrüchte. Die intestinalen C.-perfringens-Erkrankungen werden im überwiegenden Teil der Fälle von C.-perfringens-Stämmen vom Typ A verursacht.[1] In den Vereinigten Staaten von Amerika ist Clostridium perfringens mit geschätzten 248.000 Fällen je Jahr die häufigste gemeldete Ursache von Nahrungsmittelvergiftungen. Die nach dem Verzehr auskeimenden Clostridien beginnen im Darm mit der Herstellung des Perfringens-Enterotoxins, das die Durchlässigkeit des Darmepithels steigert und so zu Durchfällen und Darmkrämpfen führt, jedoch selten von Fieber oder Erbrechen begleitet wird. Erste Symptome treten innerhalb von 7 bis 15 Stunden nach dem Verzehr der kontaminierten Lebensmittel auf und verschwinden häufig nach 24 Stunden. Die Letalität ist gering.[5]
Wesentlich schwerwiegender ist beim Menschen die durch C. perfringens ausgelöste und erstmals im Ersten Weltkrieg beschriebene Enteritis necroticans (genannt auch Darmbrand[7]), welche eine hochgradig nekrotisierende Erkrankung des Jejunums (oberer Dünndarm) darstellt. Diese wird durch β-toxinbildende Stämme des Bakteriums vom Serotyp C hervorgerufen und verläuft häufig tödlich. Die genauen Pathomechanismen sind noch nicht abschließend geklärt.[1] Im Tierreich verursacht der Typ C die nekrotisierenden Darmentzündung der Saugferkel bzw. die nekrotische Enteritis bei Lämmern, Schafen und Kälbern.[2]
Diagnose
Die Nahrungsmittelvergiftung mittels Clostridium perfringens vom Typ A wird durch Isolierung des Erregers aus dem Darm oder am zuverlässigsten durch einen enzymgekoppelten Immunadsorptionstest (ELISA) zum Nachweis des Bakteriums im Darm diagnostiziert.[5] Eine Laboratoriumsdiagnose kann jedoch in der Regel nur eine nachträgliche Bestätigung der Infektion ermöglichen, da die Symptome der Erkrankung meist nach 24 Stunden bereits abgeklungen sind.[2] Im Lebensmittel selbst wird die Keimzahl von Clostridium perfringens auf Sulfit-Cycloserin-Agar (SC) ermittelt. Die Bestätigung kann mittels Lactose-Sulfit (LS) Medium und in Nitrat-Beweglichkeits-Medium (MN) erfolgen.[8]
Die Diagnose von Gasbrand wird zunächst klinisch gestellt.[1] Die Erregeranzucht kann aufgrund des zügigen Fortschreitens des Gasbrandes in der Regel nicht abgewartet werden und kann demzufolge lediglich der nachträglichen Bestätigung dienen.[6]
Mikrobiologischer Nachweis
Der Nachweis von Clostridium perfringens wird zunächst mikroskopisch durch Anfertigung eines gram-gefärbten Präparates geführt, in dem ca. 4 bis 6 × 1 μm große Stäbchen mit abgerundeten Enden sichtbar werden. Dabei können in Originalpräparaten die Erreger teilweise von Kapseln umgeben sein, was an nicht angefärbten Zonen um die Bakterien erkennbar wird. Sporen sind gelegentlich in Stuhl- und Bodenproben zu finden, jedoch meist nicht in angezüchteten Kulturen. Als Merkmal dient u. a. die Unbeweglichkeit aufgrund der fehlenden Begeißelung und die fehlende Bildung von Sporen in vitro.
Des Weiteren wird das Verdachtsmaterial auf Anaerobier- bzw. Standard-Blutagar und auf Eigelb-Agar angezüchtet. Clostridium-perfringens-Kolonien werden unter Bebrütung in der Regel nach 10 bis 12 Stunden sichtbar. Charakteristisch sind beim Anaerobier-Blutagar runde, gewölbte, feuchtglänzende, gelegentlich rötlich schimmernde Kolonien von 3 bis 5 mm Durchmesser, die sich unter Sauerstoffeinwirkung erst grau, dann hellbraun und später grünlich verfärben und von keinem größeren Hämolysefeld umgeben sind. Auf dem Standard-Blutagar findet um die Kolonien eine Doppelzonenhämolyse statt. Auf Eigelb-Agar verursacht die vom Erreger freigesetzte Lecithinase eine charakteristische weißliche Aufhellung um den Wachstumsrasen („Seiffert-Nagler-Reaktion“). In Nährbouillons tritt rasch eine Trübung mit starker Gasentwicklung auf.
In Speziallaboratorien können zudem die Serotypen des Clostridium perfringens mittels Identifikation der Exotoxine in Tierversuchen unter Einsatz spezifischer Antiseren ermittelt werden.[3] Der Nachweis kann auch molekularbiologisch mittels PCR erfolgen.[9]
Einzelnachweise
- Arne C. Rodloff: Obligat anaerobe sporenbildende Stäbchen. In: Helmut Hahn u. a. (Hrsg.): Medizinische Mikrobiologie und Infektiologie. 5. Auflage. Berlin/ Heidelberg 2004, S. 339ff.
- Werner Köhler: Sporenbildende gram-positive Bakterien (Bacillus, Clostridium) - Milzbrand, Tetanus, Gasbrand, pseudomembranöse Colitis, Botulismus. In: Werner Köhler u. a. (Hrsg.): Medizinische Mikrobiologie. 8. Auflage. Jena/ München 2001, S. 402ff.
- Gerhard Ruckdeschel: Clostridium perfringens und andere histotoxische sowie sonstige, gewöhnlich apathogene Klostridienarten. In: Friedrich Burkhardt (Hrsg.): Mikrobiologische Diagnostik. Stuttgart/ New York, S. 228ff.
- J. Finsterer, B. Hess: Neuromuscular and Central Nervous System Manifestations of Clostridium perfringens Infections. In: Infection. Band 35, Nr. 6, 2007, S. 396–405, doi:10.1007/s15010-007-6345-z.
- Michael T. Madigan, John M. Martinko: Brock. Mikrobiologie. 11., überarb. Auflage. München u. a. 2006, S. 814, 1069.
- Herbert Hof: Bakteriologie. In: Herbert Hof, Rüdiger Dörries (Hrsg.): Mikrobiologie. (= Duale Reihe). Stuttgart 2005, S. 345ff.
- Hans Adolf Kühn: Enteritis necroticans (Darmbrand). In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 812 f.
- DIN EN ISO 7937:2004-11: Mikrobiologie von Lebensmitteln und Futtermitteln - Horizontales Verfahren zur Zählung von Clostridium perfringens - Koloniezählverfahren doi:10.31030/9565762
- U. Messelhäusser, R. Zucker, D. Elmer-Englhard, U. Busch, S. Hörmansdorfer, U. Pudich, C. Höller: Nachweis und Charakterisierung von Clostridium perfringens mittels real-time-PCR. In: Journal für Verbraucherschutz und Lebensmittelsicherheit. Band 2, Nr. 2, 2007, ISSN 1661-5867, S. 194–197, doi:10.1007/s00003-007-0173-z.