Dutasterid
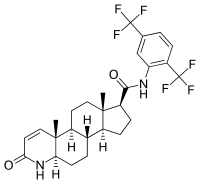
Dutasterid ist eine organische chemische Verbindung aus der Klasse der Steroide. Es wird wegen seiner Wirksamkeit als 5α-Reduktase-Hemmer, der die Umwandlungsrate von Testosteron in Dihydrotestosteron (DHT) senkt und dadurch die DHT-Konzentration vermindert, als Arzneistoff zur Behandlung der benignen Prostatahyperplasie (BPH) eingesetzt. Der Handelsname des weltweit erhältlichen Fertigarzneimittels des Herstellers GlaxoSmithKline (GSK) lautet Avodart®.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Dutasterid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C27H30F6N2O2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
G04CB02 | |||||||||||||||||||||
| Wirkstoffklasse |
Urologika – Prostatamittel | |||||||||||||||||||||
| Wirkmechanismus |
nichtselektiver 5α-Reduktase-Inhibitor | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 528,53 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Anwendungsgebiete
Dutasterid wird zur Behandlung der Symptome der benignen Prostatahyperplasie (BPH) eingesetzt. Auch zur Minderung des Risikos des akuten Harnverhalts und vor Prostataoperationen kommt Dutasterid bei bestehenden BPH-Symptomen zum Einsatz.
Prostatakarzinom
Dutasterid reduziert bei Patienten mit einem niedrig malignen Prostatakarzinom, die eine Wait-and-see-Strategie verfolgen, das Risiko eines Progresses.[3] In der randomisierten, doppeltblinden, multizentrischen REDEEM-Studie wurden 302 Männer mit niedrig malignem Prostatakarzinom randomisiert. Nach drei Jahren hatten 38 % der mit Dutasterid behandelten Männer einen Tumorprogress, in der Placebo-Gruppe dagegen 48 %. In beiden Gruppen wurde kein tumorbedingter Todesfall oder eine Metastasierung beobachtet. Auf diese Behandlung wird weder in der S3-Leitlinie Prostatakarzinom der DKG[4] noch in der Guidelines on Prostate Cancer der EAU[5] eingegangen. Es besteht keine Zulassung für diese Indikation.
Pharmakologie
Dutasterid hemmt die 5α-Reduktase-Isoenzyme vom Typ 1, 2 und 3, die für den Abbau des Hormons Testosteron zu Dihydrotestosteron verantwortlich sind. Es senkt auf diese Weise die Konzentration des zirkulierenden Dihydrotestosterons. Diese Umwandlung erfolgt größtenteils in der Prostata, der Leber und der Haut. In den Zellen dieser drei Organe bindet DHT am Zellkern. Speziell in den Prostata-Zellen steigert DHT die Zellteilungsrate des Prostatagewebes und sorgt für deren Vergrößerung. Dutasterid ist derzeit nur für Behandlung der benignen Prostatahyperplasie (BPH) zugelassen. Das ähnliche Finasterid wird darüber hinaus auch zur Behandlung der androgenetischen Alopezie mit einem Fünftel der BPH-Arzneistoffdosis angewendet.
Nebenwirkungen
Die folgenden Nebenwirkungen sind bei Dutasterid in einer placebokontrollierten Studie in den ersten 6 Monaten beobachtet worden:[1]
- Impotenz: 4,7 % (Placebogruppe: 1,7 %)
- Verminderte Libido: 3,0 % (Placebogruppe: 1,4 %)
- Ejakulationsstörung: 1,4 % (Placebogruppe: 0,5 %)
- Empfindlichkeit der Brust oder Brustvergrößerung: 0,5 % (Placebogruppe: 0,1 %)
Es gibt vereinzelte Berichte zu andauernden Nebenwirkungen nach Absetzen des Medikaments.[6]
Gebrauch gegen Haarausfall
Bei einer ärztlichen Verschreibung von Dutasterid gegen androgenetische Alopezie handelt es sich um einen sogenannten Off-Label-Use. Der Fachausdruck off-label-use bezeichnet die Verwendung eines Arzneistoffs außerhalb der zugelassenen Indikation. Dutasterid ist derzeit nicht zur Behandlung der androgenetischen Alopezie zugelassen, anders als der pharmakologisch und chemisch eng verwandte Wirkstoff Finasterid, dessen Indikationen BPH und androgenetische Alopezie sind. 0,5 mg Dutasterid sind in der Lage, die Konzentration von DHT in der Kopfhaut stärker zu senken als die zehnfache Menge an Finasterid. Im Juni 2010 wurde eine Phase-III-Studie zur Behandlung der androgenetischen Alopezie publiziert, die zur Zulassung für eine Indikation nötig ist.[7]
Kontraindikationen
Arzneimittel, die den Arzneistoff Dutasterid enthalten, dürfen nicht von Frauen, Kindern und Jugendlichen eingenommen werden und ebenso wenig von Personen mit schweren Leberfunktionsstörungen und Überempfindlichkeiten gegenüber anderen 5α-Reduktasehemmern.
Missbrauch im Sport
Dutasterid wird angewendet, um die steoroidtypischen Nebenwirkungen von stark androgen wirkenden Steroiden zu unterbinden. Hierzu gehören Haarausfall, verstärktes Körperhaarwachstum und Akne. Dutasterid wirkt bei jedem androgen wirkenden Steroid mit Ausnahme von Drostanolon.[8]
Einzelnachweise
- FDA Label für Avodart® (Dutasterid) – Stand: September 2010 (PDF; 315 kB) auf der Webseite der Food and Drug Administration FDA.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Neil E Fleshner, M Scott Lucia, Blair Egerdie, Lorne Aaron, Gregg Eure: Dutasteride in localised prostate cancer management: the REDEEM randomised, double-blind, placebo-controlled trial. In: Lancet (London, England). Band 379, Nr. 9821, 24. März 2012, S. 1103–1111, doi:10.1016/S0140-6736(11)61619-X, PMID 22277570.
- Federführende Fachgesellschaft Deutsche Gesellschaft für Urologie e. V. (DGU): Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms. Version 5.0. (PDF) (Nicht mehr online verfügbar.) Leitlinienprogramm Onkologie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.V. (AWMF), Deutschen Krebsgesellschaft e.V. (DKG) und Deutschen Krebshilfe (DKH), 2018, archiviert vom Original am 11. April 2019; abgerufen am 11. April 2019.
- Guidelines on Prostate Cancer. European Association of Urology (EAU), 2019, abgerufen am 11. April 2019 (englisch).
- A.M. Traish, J. Hassani, A.T. Guay, M. Zitzmann, M.L. Hansen: Adverse side effects of 5α-reductase inhibitors therapy: persistent diminished libido and erectile dysfunction and depression in a subset of patients. In: The Journal of Sexual Medicine. 8/2011, S. 872–884. doi:10.1111/j.1743-6109.2010.02157.x. PMID 21176115.
- Hee Chul Eun u. a.: Efficacy, safety, and tolerability of dutasteride 0.5 mg once daily in male patients with male pattern hair loss: A randomized, double-blind, placebo-controlled, phase III study. In: Journal of the American Academy of Dermatology, Volume 63, 2010, S. 252–258. doi:10.1016/j.jaad.2009.09.018.
- Das Schwarze Buch – Anabole Steroide, 2007, ISBN 978-3-00-020944-4, S. 114.