Selenoamide
Selenoamide sind organisch-chemische Verbindungen. Sie stellen Selen-Analoga von Amiden dar und gehören zu den Selenocarbonylverbindungen.
| Selenoamide |
|---|
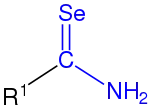 primäres Selenoamid |
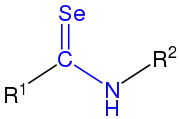 sekundäres Selenoamid |
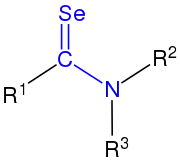 tertiäres Selenoamid |
| R1, R2 und R3 sind organische Reste (Alkyl, Aryl o. ä.). Die Selenoamidgruppe ist blau markiert. |
Das Grundgerüst ihrer funktionellen Gruppe besteht aus einem Selenatom, welches durch eine Doppelbindung an ein Kohlenstoffatom gebunden ist. Das Kohlenstoffatom ist durch eine Einfachbindung mit einem Stickstoffatom verbunden. Die Anzahl der gebundenen Wasserstoffatome hängt von der Anzahl der Substituenten ab. Es können unsubstituierte, primäre, sekundäre und tertiäre Selenoamide unterschieden werden.[1] Der einfachste Vertreter der Selenoamide ist das ausschließlich mit Wasserstoffatomen substituierte Selenoformamid, ein Derivat des Formamids. Primäre Selenoamide sind einfach (mono), sekundäre zweifach (di) und tertiäre dreifach (tri) substituiert, wobei es sich bei den Substituenten um organische Reste handelt (z. B. Alkyl, Aryl etc.).[2] Selenoamide sind generell farblose bis schwach gelbe Substanzen, ihre Stabilität steigt mit der Anzahl der Substituenten.[1] Primäre Selenoamide eignen sich aufgrund ihrer Reaktivität zur Synthese von heterocyclischen Selenverbindungen, welche wiederum in der Pharmaindustrie genutzt werden (z. B. zur Synthese von Selenazolen, Selenazinen).[3] Andererseits sind tertiäre Selenoamide stabiler und darum handhabbarer, sodass sie als Selenquelle zur Herstellung von Chalkopyritverbindungen verwendet werden. Diese wiederum werden als aktives Material in Solarzellen genutzt.[4]
Synthese
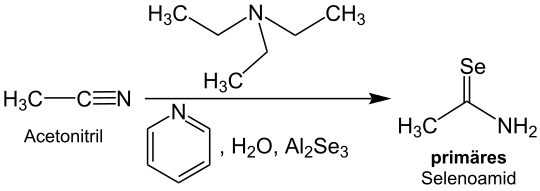
Selenoformamid kann durch die Einwirkung von Phosphorpentaselenid auf Formamid erhalten werden.[1] Während primäre Selenoamide früher häufig aus Nitrilen und Selenwasserstoff synthetisiert wurden,[5] wird heutzutage auf das toxische Selenwasserstoff verzichtet. Stattdessen werden Nitrile mit Triethylamin, Pyridin, Wasser und Aluminiumselenid umgesetzt.[2][6]
Sowohl sekundäre als auch tertiäre Selenoamide können aus Selenoestern hergestellt werden. Wenn Selenoester mit Magnesiumbromidsalzen von primären Aminen umgesetzt werden, entsteht ein sekundäres Selenoamid. Um ein tertiäres Selenoamid zu erhalten, muss der Selenoester mit einem sekundären Amin umgesetzt werden.[2]
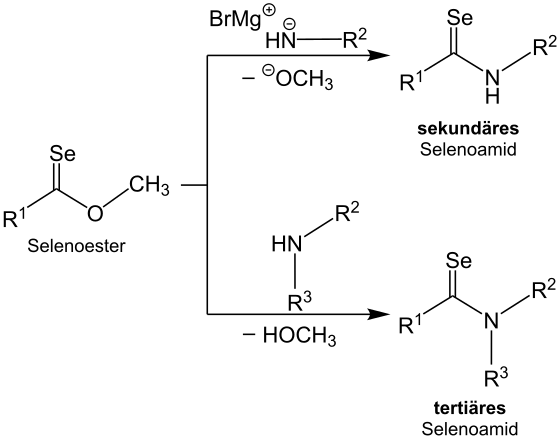
Außerdem kann Natriumhydrogenselenid oder das Woollins’ Reagenz zur Synthese von Selenoamiden verwendet werden.[7]
Reaktionen
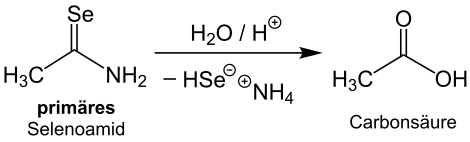
Primäre Selenoamide können als Selenüberträger genutzt werden, sodass sie zur Synthese von Ketonen, Seleniumsalzen, Seleniden, Selenazolen oder Selenazinen verwendet werden.[8] Die Hydrolyse von Selenoamiden führt zu Carbonsäuren. Durch die Hydrolyse des primären Selenoamids Selenoacetamid wird beispielsweise Essigsäure erhalten.[2]
Selenoamide können außerdem mit Iod zu Selenodiazolen oxidiert werden.[5] Durch die Eschenmoser-Kupplung von Selenoamiden werden cyclische Enaminoester erhalten.[9] Außerdem wurden Michael-Additionen von chiralen, α-β-ungesättigten Selenoamiden mit lithiumorganischen Verbindungen beobachtet.[10]
Einzelnachweise
- C. Paulmier: Selenium Reagents and Intermediates in Organic Synthesis. Band 4. Pergamon Press, Oxford 1986, ISBN 0-08-032484-3, S. 77–79.
- The Chemistry of Selencarbonylcompounds. In: Dennis Liotta, F.S. Guzirc (Hrsg.): Organoselenium chemistry. Wiley, New York 1987, ISBN 0-471-88867-2, S. 294–299.
- M. Koketsu, H. Ishihara: Synthesis of 1, 3-selenazine and 1, 3-selenazole and their biological activities. In: Current Organic Chemistry. Band 7, Nr. 2, 2003, S. 175–185, doi:10.2174/1385272033373102.
- Mehmet Eray Erkan u. a.: Chalcopyrite thin films and solar cells prepared by using selenoamide as a selenium source. In: Thin Solid Films. Band 574, 1. Januar 2015, S. 207–215, doi:10.1016/j.tsf.2014.12.017.
- A. Schönberg, A. Wagner: Herstellung und Umwandlung von Schwefelverbindungen: Methoden zur Herstellung und Umwandlung von Thioaldehyden und Thioketonen. In: Schwefel-, Selen-, Tellur-Verbindungen (= Methoden der Organischen Chemie (Houben-Weyl). Band IX). 4. Auflage. Georg Thieme Verlag, Stuttgart/New York 1955, ISBN 3-13-195904-5, S. 1207–1209, doi:10.1055/b-003-125691.
- Frank S. Guziec, Jr, Lynn James Guziec: Recent advances in the insertion and extrusion reactions of selenium and tellurium in organic compounds. In: Zvi Rappoport (Hrsg.): The chemistry of organic selenium and tellurium compounds (= Patai’s Chemistry of Functional Groups). Volume 4, Part 2, 1986, ISBN 0-471-90425-2, S. 1361–1400.
- Guoxiong Hua, J. Derek Woollins: Synthese und Reaktivität von Phosphor-Selen-Ringen. In: Angewandte Chemie. Band 121, Nr. 8, 2009, S. 1394–1403, doi:10.1002/ange.200800572.
- Toshiaki Murai: Thio-, Seleno-, Telluro-Amides. In: Shinzi Kato (Hrsg.): Chalcogenocarboxylic Acid Derivatives (= Topics in Current Chemistry. Band 251). Springer, Berlin/Heidelberg 2005, ISBN 3-540-23012-2, S. 247–272, doi:10.1007/b101011.
- S.R. Hussaini, G.B. Hammond: Eschenmoser coupling reaction of selenoamides. Synthesis of enamino esters. In: Arkivoc. Band 2008, Nr. 13, 8. Juli 2008, S. 129, doi:10.3998/ark.5550190.0009.d15.
- Toshiaki Murai, Toshihiro Mori, Shinzi Kato: Diastereoselective Michael Addition of Organolithium Reagents to Chiral α,β-Unsaturated Selenoamide. In: Synlett. Band 1998, Nr. 06, Juni 1998, S. 619–620, doi:10.1055/s-1998-1749.