Selbstinkompatibilität bei Pflanzen
Unter Selbstinkompatibilität bei Pflanzen versteht man Strategien von Samenpflanzen, nach einer Bestäubung die Befruchtung durch eigene Pollen (Autogamie) oder genetisch ähnlichen Pollen zu verhindern. Bei Selbstbefruchtung kann es statistisch häufiger passieren, dass vorher verdeckt vorhandene (heterozygot rezessive) negative Eigenschaften exprimiert werden und die Nachkommen dadurch benachteiligt sind. Daher existieren bei manchen Pflanzen in den Blüten Systeme, die verwandte oder eigene Pollen erkennen können und so eine Befruchtung durch diese verhindern.
Darüber hinaus besitzen viele Blütenpflanzen Mechanismen, die schon eine Bestäubung und damit auch die Befruchtung durch eigene Pollen verhindern. Der Begriff der Selbstinkompatibilität bezieht sich jedoch auf die nach einer Bestäubung wirksamen Schutzmechanismen.
Im Groben werden die Systeme der Selbstinkompatibilität (kurz: SI) nach dem Ort der Erkennungsreaktion unterschieden. Findet diese anhand von Merkmalen des schlauchartig auskeimenden Polleninneren (Pollenschlauch) statt, so spricht man von Gametophytischer Selbstinkompatibilität (GSI). Im Gegensatz dazu steht die Erkennung durch Charakteristika der Pollenoberfläche (vom väterlichen Sporophyten aufgelagert). Unterscheiden sich die jeweils miteinander kreuzbaren, also die nicht miteinander „verwandten“ Individuen der sporophytischen SI dabei durch bestimmte morphologische Merkmale, so bezeichnet man das als Heteromorphe Selbstinkompatibilität (HMSI). Besitzen alle Individuen hingegen ein gleiches Aussehen, so liegt (Homomorphe) Sporophytische Selbstinkompatibilität (SSI) vor. Es gibt auch eine Kombination aus gametophytischer und sporophytischer Selbstinkompatibilität (GSSI). Auch die Benachteiligung eigenen oder eng verwandten Pollens bei der Pollenkeimung ist ein möglicher Weg, welcher Selbstbefruchtung verhindern kann, man spricht von Kryptischer Selbstinkompatibilität (CSI).
Darüber hinaus gibt es noch andere Mechanismen, die z. B. die Bildung eines Nachkommen aus Selbstbefruchtung verhindern, etwa über Gene, die zum Tod von embryonalem Gewebe führen (Letal-Allele) und andere Wirkungsweisen, sogar nach der Befruchtung. Ihre Einordnung als „Selbstinkompatibilitätssystem“ ist unter den Botanikern umstritten, da durchaus eine Selbstbefruchtung stattfindet, aber letztendlich keine Nachkommen daraus erzeugt werden.
Botanische und genetische Grundlagen
Pflanzen bilden zwei Generationen aus. Die eine Generation, „Gametophyt“ genannt, trägt nur einen Satz an Chromosomen, was man auch als „haploid“ bezeichnet. Der Gametophyt bildet nun Geschlechtszellen, sogenannte „Gameten“ aus: männliche und weibliche. Diese verschmelzen zu einer Zygote, einen Vorgang, den man als „Befruchtung“ bezeichnet. Die Zygote besitzt nun den doppelten Chromosomensatz („diploid“) und bildet die nächste Generation aus. Diese nennt man „Sporophyt“ und diese ist es auch, die man allgemein als „Samenpflanze“, sprich als Baum oder „Blume“ vor Augen sieht. Der Gametophyt ist bei Samenpflanzen auf sehr wenige Zellen reduziert. Der weibliche Gametophyt befindet sich in der Samenanlage, die im Fruchtknoten liegt, der männliche Gametophyt im Inneren des Pollens. Das haploide Polleninnere keimt nach der Bestäubung schlauchförmig aus (daher auch „Pollenschlauch“ genannt) und befruchtet die ebenfalls haploide „Eizelle“ in der Samenanlage. Daraus entsteht wieder ein neuer diploider Sporophyt.
Die Befruchtung funktioniert bei Pflanzen im Prinzip genauso wie bei Tieren: Aus zwei einfachen Chromosomensätzen wird ein doppelter. Der Vorteil eines doppelten Chromosomensatzes ist, dass defekte Gene durch die ihnen entsprechenden Gene auf dem zweiten Chromosom ausgeglichen werden können. Das ist auch einer der Gründe dafür, warum die meisten höher entwickelten Lebewesen nicht haploid sind. Wenn ein diploider Organismus mit einem defekten Gen sich aber selbst befruchtet, kann es sein, dass die beiden defekten Genversionen aufeinander treffen. Das bedeutet, es ist kein Ausgleich mehr möglich und das kann Nachteile oder gar den Tod bedeuten. Selbstbefruchtung kann also negative Folgen haben und wird deswegen allgemein häufig verhindert.
Um eine Selbstbefruchtung bei Samenpflanzen zu verhindern, kann man versuchen, schon die Selbstbestäubung auszuschließen. Dies ist recht häufig realisiert, meist aber nicht besonders effektiv. Eine andere Methode wäre es, den „eigenen“ Pollen zu erkennen und ihn vom Befruchten abzuhalten. Dazu bedarf es dreier Dinge: Merkmale des Pollens, Merkmale der Narbe und einen Mechanismus, bei Pollen, der als unerwünscht erkannt ist, dessen Wachstum zu verhindern oder zu stoppen. Da man zu Beginn der Erforschung der Selbstinkompatibilitätssysteme die Genetik noch nicht vollständig verstanden hat, ging man davon aus, dass dies durch ein einziges Gen geschieht. Dieses bezeichnete man als „S-Gen“, wobei das S dabei für „Selbstinkompatibilität“ steht. Heutzutage ist jedoch bekannt, dass nur wenige sehr nahe beieinander liegende („gekoppelte“) Gene dafür zuständig sind. Korrekterweise müsste man daher von einem „S-Genlocus“ sprechen. Da jede Pflanze solche S-Genloci besitzt, müssen die Gene in verschiedenen Formen (so genannten „Allelen“) vorliegen, um eine Unterscheidung zwischen „selbst“ und „fremd“ zu gewährleisten. Das ist ganz analog zu einem Ausweis: Jeder besitzt einen, aber bei jedem sieht er etwas anders aus. Aus diesen verschiedenen Allelen entstehen Proteine mit meist kleinen, aber wichtigen Unterschieden, die zur (Selbst-)Erkennung notwendig sind. Die Anzahl der Allele liegt, je nach System bei 2 (HMSI) oder schwankt zwischen 20 und 70 (GSI und SSI).
Um eine wirkliche „Selbsterkennung“ zu gewährleisten, müssen das jeweilige Allel für das Pollencharakteristikum und das Allel für das zusammenpassende Narbenmerkmal stets gekoppelt vorliegen. Täten sie das nicht, so würden sich die Selbsterkennungsmerkmale im Lauf der Zeit unabhängig voneinander innerhalb einer Gruppe (Population) von Pflanzen verteilen (siehe auch 3. Mendelsche Regel). Das liegt daran, dass es bei der Bildung von haploiden Keimzellen (genauer bei der Meiose) zum Austausch von genetischem Material zwischen den jeweils doppelt vorliegenden Chromosomen kommt (Rekombination). Je enger die Gene für die Merkmale zusammenliegen, desto unwahrscheinlicher ist ihre Trennung bei der Rekombination.
Welche Merkmale von Pollen beziehungsweise Narbe jeweils genau für die Erkennung verantwortlich sind und wie diese exakt funktioniert, hängt von den jeweiligen SI-Systemen ab. Das bedeutet auch, dass sie evolutionär nicht zwingend miteinander verwandt (homolog) sind. Da sie aber allesamt eine Selbststerilität bewirken, werden sie trotzdem mit dem Überbegriff „S-Gene“ zusammengefasst. Auf Grund der Verteilung der Inkompatibilitätssysteme innerhalb der Samenpflanzen wird davon ausgegangen, dass sie teils mehrfach unabhängig voneinander entstanden sind und dass auch innerhalb eines Systems parallele Entwicklungen stattgefunden haben.
Bei den Süßgräsern (Poaceae) ist neben dem S-Gen ein weiteres, analog funktionierendes Gen bekannt, das als „Z-Gen“ bezeichnet wird. Es müssen sowohl S-Allel als auch Z-Allel übereinstimmen, damit es zum Abbruch der Befruchtung kommt. Beim Scharfen Hahnenfuß (Ranunculus acris) wurde ein drittes, bei der Zuckerrübe (Beta vulgaris) sogar noch ein viertes Gen entdeckt. Allerdings wiesen Mulcahy & Bergamini-Mulcahy 1983[1] darauf hin, dass durch mehrere unabhängige Selbstinkompatibilitätsgene eine Selbsterkennung immer unwahrscheinlicher wird.
Gametophytische Selbstinkompatibilität (GSI)
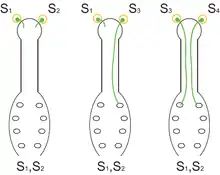
Bei der GSI erfolgt die Erkennungsreaktion durch den Genotyp des Gametophyten. Da der auskeimende Pollenschlauch gametophytisch ist und somit nur einen Satz an Chromosomen trägt (haploid), besitzt er nur ein S-Allel. Im Griffel der zu bestäubenden Blüte liegen zwei Allele vor, da er sporophytisch und somit diploid ist. Die beiden Allele werden dort meist gleichzeitig exprimiert (Kodominanz).
Die GSI besitzt durch die gametophytische Erkennung einen gewissen Nachteil, durch die eine Befruchtung mit genetisch ähnlichem Pollen möglich wird. Kreuzt z. B. ein männlicher Elter mit S1, S3 mit einem weiblichen Elter mit S1, S2, so können 50 % des Pollens (nämlich die S3-Pollen) die Eizelle befruchten. Da es bei der Meiose während der Gametophytenentwicklung zum Austausch von genetischem Material unter den Chromosomen kommt (Rekombination), können in der befruchteten Eizelle (Zygote) bei beiden Chromosomen identische (homozygote) Genbereiche auftreten. Dies kann bei defekten Genkopien zu negativen Effekten führen.
Die GSI ist häufig mit bestimmten Merkmalen korreliert. So ist der Pollen bei der Bestäubung häufig noch zweikernig. Der männliche Gametophyt besteht also aus der Pollenschlauchzelle und der generativen Zelle, die sich erst später in die beiden Spermazellen teilt. Die Schutzschicht auf der Narbenoberfläche (Cuticula) ist diskontinuierlich, besitzt also Lücken oder Dünnstellen. Durch diese sezerniert die Narbe eine zuckerreiche Flüssigkeit („feuchte Narbe“). Bei Süßgräsern existieren diese Korrelationen nicht, obwohl ihre Selbstinkompatibilität sonst über den Gametophyten erfolgt. So sind Gräserpollen dreikernig und die Narbenoberfläche ist stark behaart und sonst trocken.
Die GSI ist bei 56 Pflanzenfamilien bekannt. Darunter sind neben den Rosengewächsen, Nachtschattengewächsen und Braunwurzgewächsen auch die Süßgräser vertreten.

RNase-Mechanismus
Die biochemische Funktionsweise ist zwar noch nicht vollständig geklärt, aber es wurde herausgefunden, dass in vielen Fällen (Nachtschattengewächse, Petunien, Rosengewächse) in den Griffelzellen RNA-abbauende Enzyme (RNasen) gebildet werden. Diese wandern in den Pollenschlauch und verhindern somit dort die Bildung von Proteinen.[2] Polleneigene Genprodukte, sogenannte „S-gekoppelte F-Box-Proteine“ (SFB)[3][4] greifen, analog einem Immunsystem, alle „fremden“ RNase-Versionen an, die nicht im eigenen Genom codiert sind. Dabei ignorieren sie aber diejenigen Griffel-RNase-Versionen, die gleichzeitig auch im Pollen codiert vorliegen (Selbsterkennung). Diese „eigenen“ RNasen bringen dann die Proteinbiosynthese des Pollenschlauchs zum Erliegen. Der Pollenschlauch stirbt im Griffel ab und die Spermazellen erreichen somit die Eizelle nicht. Beim Absterben des Pollenschlauchs wird dann Callose im Griffel abgelagert.
Da der Mechanismus durch sehr ähnliche RNase-Typen und jeweils über F-Box-Proteine verläuft, geht man davon aus, dass dieser Mechanismus einmal entstanden ist und in vielen Gruppen wieder verloren ging. Durch molekulare Datierung wird dieses System auf ein Alter von etwa 90 Millionen Jahren geschätzt.[5]
Apoptose-Mechanismus
Bei Mohngewächsen löst das als „selbst“ anerkannte S-Allel hingegen eine durch Ca2+-Ionen bedingte Signalkette aus, die erst das Wachstum des Pollenschlauchs durch Abbau des Actin-Cytoskeletts stoppt und dann den programmierten Zelltod (Apoptose) in der Pollenschlauchzelle bewirkt.[6]
(Homomorphe) sporophytische Selbstinkompatibilität (SSI)
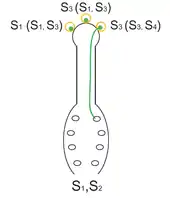
Bei der SSI hängt die Erkennungsreaktion nicht vom Gametophyten ab, sondern vom pollenbildenden Sporophyten. Dadurch spielen beide Allele des diploiden Genoms des „Vaters“ eine Rolle. Dies ist über die Erkennung von Proteinen der äußeren Pollenwandschicht (Exine), die vom „väterlichen“ Sporophyten aufgelagert wurde, möglich. Stimmt auch nur ein S-Allel mit denen des zu befruchtenden mütterlichen Sporophyten überein, so erfolgt eine Abstoßungsreaktion. In der Praxis ist es jedoch beim S-Gen des pollenbildenden Sporophyten meist so, dass nur eines der beiden Allele ausgeprägt wird (Dominanz). Dadurch kann es wie bei der GSI zu partieller Homozygotie kommen, also dass direkt verwandte Genomabschnitte zusammentreffen, was eigentlich verhindert werden soll.
Bei der SSI wird der meist dreizellige Pollen schon bei der Keimung behindert. Die Schutzschicht der Narbe (Cuticula) ist im Gegensatz zur GSI kontinuierlich, also ohne Lücken und sondert nur wenig oder gar keine Flüssigkeit ab („trockene Narbe“). Im Gegensatz zur Heteromorphen Selbstinkompatibilität sind an die Inkompatibilität zwischen nahe verwandten Genotypen keine morphologischen Merkmale verknüpft.
Die Homomorphe sporophytische Selbstinkompatibilität (SSI) ist bei 8 Pflanzenfamilien bekannt, unter ihnen die Korbblütler, Windengewächse und die Kreuzblütengewächse.
Gametophytisch-sporophytische Selbstinkompatibilität (GSSI)
Bei der GSSI hängt die Reaktion sowohl von der sporophytischen Pollenaußenschicht (Exine) als auch vom Gametophyten ab. Sie stellt somit eine Kombination aus GSI und SSI dar.
Beim Kohl (Brassica) wurden zwei gekoppelte Gene mit jeweils einer Vielzahl von Allelen identifiziert. In der empfänglichen Region der Narbe wird auf dessen Oberfläche ein Protein namens SRK (S-receptor kinase) abgelagert. Das im Genom sehr nahe gelegene und somit nur sehr selten durch Crossing-over getrennte Protein mit dem Namen SCR (small, cystein-rich pollen-coat protein, teilweise auch SP11 genannt) wird im Pollen exprimiert. Das SCR-Protein besitzt recht häufig die Aminosäure Cystein und befindet sich auf der Oberfläche des Pollens. Ungewöhnlicherweise werden die beiden Allele des SCR-Gens nicht, wie von der SSI bekannt, gleichzeitig exprimiert (kodominant), sondern es gibt dominante und rezessive Allele. Die dominanten Allele werden vom Tapetum (das Gewebe der Vaterpflanze, das die Außenschicht des Pollens bildet) und im Pollenschlauch selbst produziert, sodass eine sporophytische Erkennung erfolgt. Die rezessiven SCR-Genvarianten werden nur im Pollenschlauch ausgeprägt, sodass dann eine gametophytische SI erfolgt.[7]
Nachgewiesen wurde es in einigen Kreuzblütengewächsen (Brassica, Eruca, Raphanus) und Korbblütlern (Hypochaeris, Pippau). Da die Beispiele innerhalb der „typischen SSI-Familien“ gefunden wurden, kann ein genereller gametophytischer Einfluss auf sporophytische Selbstinkompatibilitätssysteme nicht ausgeschlossen werden.
Heteromorphe sporophytische Selbstinkompatibilität (HMSI oder HSI)

Die HMSI beschreibt die Selbstinkompatibilität gekoppelt mit unterschiedlichen morphologischen (=heteromorphen) Merkmalen. Das bekannteste Merkmal ist die Länge des Griffels (Heterostylie). Treten zwei Formen auf, bei der einmal die Staubblätter über dem Griffel (Kurzgriffligkeit, englisch: thrum) und einmal der Griffel über den Staubblättern stehen (Langgriffligkeit, englisch: pin), so spricht man von Distylie. Ein bekanntes Beispiel, das bereits Clusius 1583 erkannte, ist die Primel. Erst Charles Darwin erkannte jedoch 1877 den Zusammenhang zwischen Verschiedengriffligkeit und Selbststerilität. Individuen mit dem gleichen Blütenbau bilden keine Nachkommen. Es gibt jedoch weitere Merkmale, die mit der Griffellänge korreliert sind, wie etwa die Größe der Staubbeutel (Lungenkraut und andere), Griffelfarbe (z. B. Eichhornia) oder -behaarung (z. B. Sauerklee). Obwohl die unterschiedliche Länge der Griffel ein optisch hervorstechendes Merkmal ist, ist es bei der HMSI nicht zwingend. So verfügt die selbststerile Strand-Grasnelke (Armeria maritima) über verschiedene Morphen, besitzt jedoch keine unterschiedlichen langen Griffel und Staubblätter, sondern andere morphologische Merkmale wie z. B. unterschiedliche Pollengröße. Das Vorkommen von Heterostylie ist jedoch nicht zwingend (aber sehr häufig) mit der Selbstinkompatibilität verbunden.
Es gibt auch trimorphe Varianten, bei der der Griffel und jeweils zwei Staubblattkreise in drei Versionen zueinander stehen können. Man unterscheidet je nachdem, ob der Griffel ganz unten, in der Mitte oder ganz oben steht. Eine solche Tristylie gibt es etwa beim Blut-Weiderich, bei den Sauerkleegewächsen und bei der Wasserhyazinthe.
Die heteromorphe sporophytische Selbstinkompatibilität kombiniert mit der sporophytisch erfolgenden Selbsterkennung eine Reduktion der Selbstbestäubung, indem Pollen und Narbe räumlich getrennt sind (Herkogamie). Durch die unterschiedliche Platzierung der Pollen beim Bestäuber werden bevorzugt verschiedengestaltete Morphen bestäubt, was die Effizienz des Systems erhöht.
Die Pollenreaktion ist sporophytisch, also bestimmen beide Genprodukte der Allele auf der Pollenaußenschicht, ob der Pollen keimen kann oder nicht.
Mit Selbstinkompatibilität gekoppelte Heteromorphien sind in circa 25 Familien und 155 Gattungen bekannt. Besonders häufig sind sie in den Rötegewächsen vertreten, aber auch in Bleiwurzgewächsen, Leingewächsen uvm.
Genetik der distylen Vertreter

Das S-Gen bei distylen Vertretern liegt bei der HMSI stets nur in zwei Zuständen (Allelen) vor: „S“ und „s“. Das S-Allel ist gegenüber dem s-Allel dominant, setzt sich also stets durch. Da in der Pflanze zwei Allele vorliegen, gilt bei Ss also effektiv „S“ und bei ss effektiv „s“. Der homozygote S-Typus „SS“ ist ausgeschlossen, da er nur durch die Befruchtung von Ss mit Ss entstehen könnte, die jedoch wird durch die Selbstinkompatibilität verhindert. Es können sich also nur Ss- und ss-Individuen miteinander kreuzen. Daraus entstehen dann wieder zu 50 % Ss- und 50 % ss-Individuen. Häufig gilt, dass Ss-Individuen kurze Griffel ausbilden und ss-Individuen lange Griffel (z. B. Buchweizen, Forsythien, Primeln), seltener ist es jedoch andersherum (Hypericum aegypticum).
Das S-Gen bei den distylen Primeln besteht aus drei sehr eng gekoppelten Genen. Das erste Gen (G beziehungsweise g) ist für die Griffellänge (beim dominanten G kurze Griffel, bei g lange), die Beschaffenheit der Narbenpapillen (bei G größere Papillen) und die Inkompatibilitätsreaktion der Narbe verantwortlich. Gen 2 (P beziehungsweise p) ist für die Pollenkorngröße (bei P kleinere Pollen als bei p) und die Reaktion des Pollenkorns zuständig, während das dritte Gen (A beziehungsweise a) die Höhe der Staubbeutel (bei A hoch stehend) bestimmt. Seltene Neukombinationen dieser Merkmale haben die Unterschiedlichkeit der Genloci, also die Existenz mehrerer einzelner Gene bewiesen. So kennt man z. B. auch Primeln, bei denen Griffel und Staubbeutel auf gleicher Höhe liegen („homostyl“). Dies ist erklärbar, wenn G und a (Griffel kurz und Staubbeutel niedrig stehend) oder wenn g und A (Griffel lang und Staubbeutel hoch) zusammenkommen.
Genetik der tristylen Vertreter
.jpg.webp)
Bei tristylen Arten mit HMSI ist die Genetik etwas komplizierter. Dort liegen zwei Genloci („S“ und „M“) mit je zwei Allelen (S/s beziehungsweise M/m) vor. Die Merkmale von M kommen nur zum Vorschein, wenn S jeweils mit dem rezessiven Allel, also als „ss“ vorliegt (man sagt, S ist epistatisch über M). Kommt das dominante S-Allel vor, so ist der Griffel kurz, egal, welches M-Allel vorkommt. Kommt das dominante S-Allel nicht vor (nur bei „ss“), so entsteht der Mittelgriffel, wenn ein dominantes M-Allel vorkommt (bei ssMm, ssmM und ssMM). Die Morphe mit dem langen Griffel entsteht nur, wenn beide Gene nur die rezessiven Allele tragen (ssmm). Dieses System ist häufig bei den Vertretern mit Tristylie so ausgeprägt, es gibt jedoch auch hier wieder Ausnahmen.[8]
Der Pollen der langen Staubblätter ist auf langen Griffeln fruchtbar, der Pollen mittlerer Staubblätter auf mittellangen Griffeln und bei kurzen entsprechend. Da jede Blüte 2 Staubblattkreise besitzt, kann eine Morphe die beiden anderen Morphen befruchten.
Wie bei den distylen Gruppen haben einige Arten die Selbstinkompatibilität verloren, so kennt man z. B. auch selbstkompatible Sauerklee-Arten mit Tristylie. Auch kann durch den Verlust eines Allels sekundär eine Distylie entstehen.
Kryptische Selbstinkompatibilität (CSI)
Unter kryptischer Selbst-Inkompatibilität (englisch: cryptic self-incompatibility ) versteht man das Phänomen, dass bei einer ansonsten selbstkompatiblen Art die Pollenschläuche von Fremdpollen schneller wachsen als eigene. Die CSI ist keine eigene Form der Selbstinkompatibilität, sondern beschreibt nur, dass die Fremdbestäubung aktiv bevorzugt wird. Gefunden wurde die Kryptische SI z. B. im Goldlack,[9] bei Decodon verticillatus[10] oder bei Campanulastrum americanum[11]
Letalallele
Auch bei Gymnospermen und Farnen wird die Selbstbefruchtung verhindert. Da diese jedoch weder Narbe noch Griffel besitzen, geht man davon aus, dass es Letalallele gibt. Das sind rezessive Versionen von Genen, die, wenn sie also im diploiden Chromosomensatz doppelt (homozygot) vorliegen, zum Tod der befruchteten Eizelle oder des Embryos führen. Dies ist insbesondere dann der Fall, wenn Selbstbefruchtung vorliegt. Meist finden sich eine Vielzahl von Genen mit Letalallelen bei den Farnen und Nacktsamern.[12][13] Da die Genetik der Letalallele eigentlich nichts mit den anderen Selbstinkompatibilitätssystemen zu tun hat, ist es umstritten, ob man sie hinzuzählen soll oder nicht. Auch findet bei den Letalallelen die Befruchtung statt, nur entsteht kein Nachkomme. Das Argument, dass es für die nächste Generation nur darauf ankommt, ob darunter auch Individuen aus Selbstbefruchtung sind oder nicht, würde Letalallele hingegen zu den SI-Systemen hinzurechnen.
Spät einsetzende Selbstinkompatibilität – Postzygotische SI (PSI) – Ovarische SI
Unter diesen Begriffen werden Phänomene zusammengefasst, die das Absterben der Pollenschlauchzelle kurz vor der Eizelle oder das Absterben der bereits selbstbefruchteten Eizelle beschreiben. Während bei der späten SI wohl eine verzögerte gametophytische SI vorliegt, ist bei den anderen Formen nicht klar, ob es um eine wirkliche Selbstinkompatibilitätsreaktion handelt oder ob sie die Ausprägung negativer rezessiver Merkmale bei Homozygotie (Inzuchtdepression) beschreiben (siehe auch Letalallele). Durch die unbekannten genaueren Mechanismen ist auch die Uneinigkeit der Begriffe begründet.[14][15]
Bedeutung für Populationen

Wenn Pflanzen nicht mehr sich selbst oder nahe Verwandte befruchten können, so hat dies durchaus auch Auswirkungen auf die Population und die Verbreitungsmöglichkeiten der Art.
Selbstbefruchtung hat eindeutig Nachteile, so kommt es etwa mit der Zeit zu einem Verlust an genetischer Vielfalt. Zwar verbleiben durch die Rekombination während der Meiose in der ersten Generation nach einer Selbstbefruchtung viele Allele in jeweils unterschiedlichen Versionen in einem Individuum (heterozygot), aber schon nach zirka 8 Generationen sind über 99 % des Genoms in beiden Chromosomen identisch. Die Wahrscheinlichkeit, dass darunter negative Eigenschaften sind, die dann zum Tragen kommen und die Überlebensfähigkeit der Pflanze verringern, steigt also stetig an. Die Paarung zwischen zwei Geschwistern verzögert diesen Effekt zwar, aber verhindert ihn nicht. Zumal muss auch bedacht werden, dass bereits ein auftretender Gendefekt starke Auswirkungen haben kann.
Andererseits stellt die Beschränkung auf Fremdbefruchtung (Xenogamie) auch eine Gefahr dar. Wird eine Population z. B. durch ein katastrophales Ereignis auf wenige Individuen verringert, so kann es passieren, dass diese plötzlich reproduktiv isoliert sind und die Population gänzlich zusammenbricht. Auch die Neubesiedlung weit entfernter Habitate, etwa einer Insel oder eines anderen Berges entspricht einer solchen Situation. Meist werden nur eine oder wenige Ausbreitungseinheiten (Diasporen) über längere Strecken verdriftet oder es kommen nur wenige zur Keimung. Sind die Arten selbstinkompatibel, so kann keine dauerhafte Neubesiedlung erfolgen, die Population stirbt nach einer Generation wieder aus. Der Verlust der Selbststerilität ist insofern also Voraussetzung für die Weiterverbreitung in fremde Gebiete. So sind zum Beispiel die nach Europa eingewanderten Sauerklee-Arten zwar tristyl, aber zur Selbstbefruchtung fähig. Allerdings ist auch die Nutzung von nichtsexueller Vermehrung (Apomixis) eine Möglichkeit, die Besiedlung neuer Standorte zu ermöglichen und gleichzeitig Selbstbefruchtung zu verhindern.
Selbstinkompatibilität und Ökologie einer Pflanzenart sind demnach eng miteinander verbunden. Für konkurrenzschwache Arten, die nur selten zur Blüte kommen und/oder in geringen Dichten vorkommen, wäre Selbststerilität sicherlich von Nachteil. Meist ist es jedoch so, dass der Besitz eines Selbstinkompatibilitätssystems eine Selbstbefruchtung nicht kategorisch ausschließt. So gibt es, wie in fast allen Merkmalen auch, bei der Selbstinkompatibilität häufig eine Variation in der Reaktionsstärke bei Selbsterkennung.[16] Somit ist eine Streuung der Vor- und Nachteile beider Fortpflanzungssysteme gegeben, womit ein Überdauern auch widriger Umstände ermöglicht wird.
Bedeutung in der Pflanzenzucht
Die Selbstinkompatibilität stellt vor allem Pflanzenzüchter vor größere Probleme. Da sie bei den Samenpflanzen weit verbreitet ist, sind natürlich auch diverse vom Menschen genutzte Pflanzen selbststeril. So gehören bedeutende Nutzpflanzen wie Reis und Mais zu den gametophytisch selbstinkompatiblen Süßgräsern. Wirtschaftlich interessante Mutanten können demnach nicht durch Selbstbestäubung erhalten und vermehrt werden. Auch bei vielen anderen Arten wie Tabak oder Gartenblumen erschwert die Selbstinkompatibilität die Züchtung, besonders die Hybridzüchtung.
Eine weit verbreitete Lösung für die Erhaltung von interessanten Individuen ist die vegetative Vermehrung, zum Beispiel über Stecklinge. Im Zuge immer besser werdender Kenntnisse der physiologischen Vorgänge in Pflanzen sind auch weitere Techniken, wie die Gewinnung und Kultivierung ganzer Pflanzen aus teilungsfähigem Gewebe (Meristemen), möglich. Aus dem entstehenden, noch undifferenzierten Gewebe (Kallus) kann sich mit Hilfe von Pflanzenhormonen eine vollständige Pflanze entwickeln. Die gewünschten Merkmale der so entstehenden Klone können dann u. U. durch diverse Kreuzungsstrategien in bestehende Zuchtlinien oder Sorten eingekreuzt werden. Diese Methode ist jedoch aufwändig und langwierig.
Eine Methode zur Umgehung der Selbstinkompatibilitätssysteme schlug Marianne Kroh 1955 vor, indem die Narbe entfernt und der Pollen direkt ins pollenschlauchleitende Griffelgewebe gebracht werden soll. In vielen Fällen können dadurch die Abstoßungsreaktionen umgangen werden, da sie vor allem in der Narbe stattfinden. Eine weitere, aber komplizierte Methode, die Selbstbefruchtung zu erzwingen, ist die Fusion von Protoplasten. Dazu werden zuerst aus den Zielpflanzen Exemplare mit einfachem Chromosomensatz („haploid“) hergestellt, aus ihnen Zellen entnommen und diese von der Zellwand befreit. Die so entstandenen „nackten“ künstlichen Keimzellen können z. B. über Zellfusion vereinigt werden und wie ein Kallus (siehe oben) behandelt werden.
Geschichte
Mit der (Wieder-)Entdeckung der Geschlechtertrennung bei Pflanzen (Diklinie) im 18. Jahrhundert kamen auch Fragen über die Bestäubung und die Rolle der Insekten auf. Viele Botaniker beschäftigten sich mit dem Thema, darunter Charles Darwin, der aus experimentellen Serien 1877 schloss, dass Fremdbestäubung die Regel sei (Knight-Darwin’sches Gesetz) und somit ein Selektionsdruck in Richtung der Trennung der Geschlechter in unterschiedliche Blüten vorliegen müsse.
Erst im 20. Jahrhundert konnten jedoch tiefere Erkenntnisse gewonnen werden. Durch neue Forschungen nach der Wiederentdeckung von Mendels Regeln schlugen schon 1905 Bateson und Gregory vor, dass die Heterostylie durch zwei Allele eines Gens codiert sein müsse. Der nächste Durchbruch in der Erforschung der pflanzlichen Selbstinkompatibilität kam aber erst 1925. Edward M. East und A. J. Mangelsdorf entdeckten bei Versuchen mit Tabak, dass die Selbstinkompatibilität über ein „Gen“ gesteuert wird, das in vielen Allelen vorliegen muss. So fanden sie heraus, dass eine Bestäubung nur erfolgt, wenn das S-Allel im Pollen nicht mit den Allelen der zu bestäubenden Pflanze übereinstimmt, was heute als Gametophytische Selbstinkompatibilität (GSI) bezeichnet wird.
1950 wurde in den Korbblütlern, durch D. U. Gerstel bei Guayule (Parthenium argentatum) und M. R. Hughes und E. B. Babcock im Stink-Pippau (Crepis foetida), eine Selbstinkompatibilität entdeckt, die nicht durch nur ein Allel (das des Gametophyten), sondern durch zwei Allele des Pollens bestimmt wird. Aus ihren Beobachtungen schlossen sie auf eine sporophytische SI-Reaktion. Im Jahre 1956 entdeckten A. Lundquist und D. L. Hayman parallel die Existenz eines zweiten S-Gens in Süßgräsern, das als „Z-Gen“ bezeichnet wird. Ersterer entdeckte später weitere Selbstinkompatibilitätsgene, die in einer Pflanze vorkommen können. Nur ein Jahr später, 1957, entdeckte J. L. Brewbaker, dass es in der Regel einen Zusammenhang aus sporophytischer beziehungsweise gametophytischer SI und der Zellanzahl des Pollens sowie der Narbenfeuchte gibt.
Die biochemischen Zusammenhänge begann man hingegen erst ab 1974 zu verstehen. Vor allem die Arbeiten von Jack Heslop-Harrison und Yolande Heslop-Harrison sowie R. B. Knox, die Proteine der Pollenaußenschicht (Exine) als Faktor der Selbstinkompatibilität bei Kreuzblütengewächsen erkannten, gaben bedeutende Impulse.
Die molekularen Funktionsweisen indes wurden erst seit den 1990er Jahren verstanden, begründet durch die Verfügbarkeit der molekularbiologischen Methoden. Zwar vermutete schon Dan Lewis 1947 einen Schlüssel-Schloss-Mechanismus in Bezug auf separate Merkmale von Pollen und Narbe, aber er sollte erst circa 50 Jahre später nachgewiesen werden können. Die Forschung ist heutzutage (Stand 2006) erst am Beginn des Verständnisses der Molekülinteraktionen und somit auch der wirklichen Vielfalt und evolutionären Entwicklung der Systeme.
Einzelnachweise
- David L. Mulcahy, Gabriella Bergamini-Mulcahy: Gametophytic self-incompatibility reexamined. In: Science. Bd. 230, Nr. 4603, 1983, S. 1247–1251, doi:10.1126/science.220.4603.1247.
- Bruce A. McClure, Julie E. Gray, Marilyn A. Anderson, Adrienne E. Clarke: Self-incompatibility in Nicotiana alata involves degradation of pollen rRNA. In: Nature. Bd. 347, 1990, S. 757–760.
- Paja Sijacic, Xi Wang, Andrea L. Skirpan, Yan Wang, Peter E. Dowd, Andrew G. McCubbin, Shihshieh Huang, Teh-hui Kao: Identification of the pollen determinant of S-RNase-mediated self-incompatibility. In: Nature. Bd. 429, 2004, S. 302–305.
- Hong Qiao, Fei Wang, Lan Zhao, Junli Zhou, Zhao Lai, Yansheng Zhang, Timothy P. Robbins, Yongbiao Xue: The F-box protein AhSLF-S2 controls the pollen function of S-RNase-based self-incompatibility. In: Plant Cell. Bd. 16, Nr. 9, 2004, ISSN 1040-4651, S. 2307–2322, doi:10.1105/tpc.104.024919.
- Boris Igic, Joshua R. Kohn: Evolutionary relationships among self-incompatibility RNases. In: Proceedings of the National Academy of Sciences of the United States of America. Bd. 98, Nr. 23, 2001, S. 13167–13171, doi:10.1073/pnas.231386798.
- Steve Thomas, Kim Osman, Barend H. J. de Graaf, Galina Shevchenko, Mike Wheeler, Chris Franklin, Noni Franklin-Tong: Investigating mechanisms involved in the self-incompatibility response in Papaver rhoeas. In: Proceedings of the Royal Society of London B. Bd. 358, Nr. 1434, 2003, S. 1033–1036, PMC 1693190 (freier Volltext).
- Deborah Charlesworth, Xavier Vekemans, Vincent Castric, Sylvain Glémin: Plant self-incompatibility systems: a molecular evolutionary perspective. In: New Phytologist. Bd. 168, Nr. 1, 2005, ISSN 0028-646X, S. 61–69, PMID 16159321, doi:10.1111/j.1469-8137.2005.01443.x.
- Fred R. Ganders: The biology of heterostyly. In: New Zealand Journal of Botany. Bd. 17, Nr. 4, 1979, ISSN 0028-825X, S. 607–635, doi:10.1080/0028825X.1979.10432574.
- A. J. Bateman: Cryptic self-incompatibility in the wallflower: Cheiranthus cheiri L. In: Heredity. Bd. 10, 1956, ISSN 0018-067X, S. 257–261, (online).
- Christopher G. Eckert, Maryl Allen: Cryptic self-incompatibility in tristylous Decodon verticillatus (Lythraceae). In: American Journal of Botany. Bd. 84, Nr. 10, 1997, ISSN 0002-9122, S. 1391–1397, JSTOR 2446137.
- Leah J. Kruszewski, Laura F. Galloway: Explaining Outcrossing Rate in Campanulastrum americanum (Campanulaceae): Geitonogamy and Cryptic Self‐Incompatibility. In: International Journal of Plant Sciences. Bd. 167, Nr. 3, 2006, S. 455–461, JSTOR 10.1086/501051.
- Max Hagman: Incompatibility in forest trees. In: Proceedings of the Royal Society of London B. Bd. 188, Nr. 1092, 1975, S. 313–326, JSTOR 76332.
- Claire G. Williams, Yi Zhou, Sarah E. Hall: A chromosomal region promoting outcrossing in a conifer. In: Genetics. Bd. 159, Nr. 3, 2001, S. 1283–1289, PMC 1461856 (freier Volltext).
- Tammy L. Sage, Robert I. Bertin, Elizabeth G. Williams: Ovarian and other late-acting self-incompatibility systems. In: Elizabeth G. Williams, Adrienne E. Clarke, R. Bruce Knox (Hrsg.): Genetic control of self-incompatibility and reproductive development in flowering plants (= Advances in Cellular and Molecular Biology of Plants. 2). Kluwer Academic Publishing, Dordrecht u. a. 1994, ISBN 0-7923-2574-5, S. 116–140, doi:10.1007/978-94-017-1669-7_7.
- Steven R. Seavey, Kamaljit S. Bawa: Late-acting self-incompatibility in angiosperms. In: The Botanical Review. Bd. 52, Nr. 2, 1986, ISSN 0006-8101, S. 195–219, doi:10.1007/BF02861001.
- Donna W. Vogler, K. Filmore, Andrew G. Stephenson: Inbreeding depression in Campanula rapunculoides L. I. A comparison of inbreeding depression in plants derived from strong and weak self- incompatibility phenotypes. In: Journal of Evolutionary Biology. Bd. 12, Nr. 2, 1999, ISSN 1010-061X, S. 483–494, doi:10.1046/j.1420-9101.1999.00046.x.
Literatur
- Botanik online der Universität Hamburg
- William Bateson, Reginald P. Gregory: On the inheritance of heterostylism in Primula. In: Proceedings of the Royal Society of London B. Bd. 76, Nr. 513, 1905, S. 581–586, doi:10.1098/rspb.1905.0049.
- James L. Brewbaker: Pollen cytology and self-incompatibility systems in plants. In: The Journal of Heredity. Bd. 48, Nr. 6, 1957, ISSN 0022-1503, S. 271–277, doi:10.1093/oxfordjournals.jhered.a106742.
- Deborah Charlesworth, Xavier Vekemans, Vincent Castric, Sylvain Glémin: Plant self-incompatibility systems: a molecular evolutionary perspective. In: New Phytologist. Bd. 168, Nr. 1, 2005, ISSN 0028-646X, S. 61–69, PMID 16159321, doi:10.1111/j.1469-8137.2005.01443.x.
- Dreux de Nettancourt: Incompatibility in angiosperms. In: Sexual Plant Reproduction. Bd. 10, Nr. 4, 1997, ISSN 0934-0882, S. 185–199, doi:10.1007/s004970050087.
- Walter Durka: Blüten- und Reproduktionsbiologie. In: Schriftenreihe für Vegetationskunde. Heft 38, 2002, ISSN 0085-5960, S. 133–175, online, hier S. 147–150 (Memento vom 19. Juli 2011 im Internet Archive).
- Edward M. East, Albert J. Mangelsdorf: A new interpretation of the hereditary behavior of self-sterile plants. In: Proceedings of the National Academy of Sciences of the United States of America. Bd. 11, Nr. 2, 1925, S. 166–171, doi:10.1073/pnas.11.2.166.
- Dan U. Gerstel: Self-incompatibility studies in guayule. II. Inheritance. In: Genetics. Bd. 35, Nr. 4, 1950, ISSN 0016-6731, S. 482–506, (online).
- David L. Hayman: The genetic control of self-incompatibility in Phalaris coerulescens. In: Australian Journal of Biological Sciences. Bd. 9, Nr. 3, 1956, ISSN 0004-9417, S. 321–331, doi:10.1071/BI9560321.
- Aki M. Höltken: Genetische Untersuchungen zu den Voraussetzungen und Konsequenzen rezedenten Lebensweise am Beispiel Vogelkirsche (Prunus avium L.). Göttingen 2005 S. 12–15, online (für GSI) (PDF; 1,9 MB).
- Morris R. Hughes, Ernest B. Babcock: Self-incompatibility in Crepis foetida (L.) subsp. rhoedifolia (Bieb.) Schinz et Keller. In: Genetics. Bd. 35, Nr. 5, 1950, ISSN 0016-6731, S. 570–588, , (online).
- Benjamin P. Kemp, James Doughty: Just how complex is the Brassica S-receptor complex? In: The Journal of Experimental Botany. Bd. 54, Nr. 380, 2003, ISSN 0022-0957, S. 157–168, doi:10.1093/jxb/erg033.
- Arne Lundquist: The nature of the two-loci incompatibility system in grasses. IV. Interaction between the loci in relation to pseudo-compatibility in Festuca pratensis huds. In: Hereditas. Bd. 52, Nr. 2, 1964, ISSN 0018-0661, S. 221–234, doi:10.1111/j.1601-5223.1964.tb01954.x.
- Bruce A. McClure, Julie E. Gray, Marilyn A. Anderson, Adrienne E. Clarke: Self-incompatibility in Nicotiana alata involves degradation of pollen rRNA. In: Nature. Nr. 347, 1990, S. 757–760, doi:10.1038/347757a0.
- Peter Sitte, Elmar Weiler, Joachim W. Kadereit, Andreas Bresinsky, Christian Körner: Lehrbuch der Botanik für Hochschulen. Begründet von Eduard Strasburger. 35. Auflage. Spektrum Akademischer Verlag, Heidelberg u. a. 2002, ISBN 3-8274-1010-X.