Savannenbussard
Der Savannenbussard (Buteogallus meridionalis) ist ein mäusebussardgroßer, langbeiniger Greifvogel aus der Gattung Buteogallus innerhalb der Unterfamilie der Bussardartigen (Buteoninae). Anders als die meisten anderen Arten dieser Gattung weist sein Gefieder nur wenige schwarze Gefiederanteile auf, sondern ist vor allem zimtbraun mit rostbraunen Federpartien. Die Bauchseite ist auffallend dunkelbraun gesperbert.
| Savannenbussard | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
_(28209553996).jpg.webp)
Adulter Savannenbussard | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Buteogallus meridionalis | ||||||||||||
| (Latham, 1790) |
Die Art ist weit über das tropische und subtropische Südamerika östlich der Anden verbreitet. Westlich dieses Gebirgszuges und im südlichen Mittelamerika liegen weitere, zum Teil isolierte Vorkommen. Er besiedelt vor allem offen baumbestandenes Grasland, bevorzugt in Wassernähe und meist unter 1000 Metern. Der Savannenbussard ist weitgehend Jahresvogel, nur die südlichsten Populationen Argentiniens verlassen im Winter ihre Brutgebiete und ziehen nach Norden. Als Nahrungsgeneralist ernährt er sich von einer Vielzahl an unterschiedlichen Beutetieren, denen er teils im Flug, teils von einem Ansitz aus oder auch laufend oder flughüpfend am Boden nachstellt. Sie führen meist eine mehrjährige Partnerschaft und bebrüten in der Regel nur ein einziges Ei.
In vielen Regionen ist B. meridionalis ein verbreiteter Brutvogel. Er wird mit Stand Anfang 2021 in keiner Gefährdungskategorie geführt.[1] Die monotypische Art wurde 1790 von John Latham als Falco meridionalis erstbeschrieben. Der Gattungsname Buteogallus lässt sich mit Hahnenbussard übersetzen und weist auf die Langbeinigkeit des Vogels hin. Das Artepitheton bezieht sich auf seine Verbreitung (lat. meridies = Süden, südlich).[2]
Aussehen
.JPG.webp)
_immature.jpg.webp)
_-_TOMA_DE_SAFARI_A_CEIBAS-ENTRE_RIOS.ARGENTINA.HORACIO_PATRONE.jpg.webp)
Der Savannenbussard ist ein eher schlanker, schlaksig wirkender Greifvogel mit zimtfarbener Oberseite und deutlich eng gesperberter Unterseite. Sowohl im Sitzen als auch im Fliegen sind die schwarzen Ränder der Flügel auffallend. Die Beine sind lang, der Kopf mit den stark nach vorne ausgerichteten Augen wirkt klein. Charakteristisch ist weiters die aufrechte Sitzposition. Die breiten, leicht gebuchteten Flügel sind mit 2,4facher Körperlänge länger als bei anderen Schwarzbussarden.[3] Im Sitzen schließen Schwanz und Flügelspitzen in etwa gleich ab. Savannenbussarde fliegen meist in eher niedrigen Regionen mit langsamen, tief durchgezogenen Flügelschlägen, denen kurze Gleitphasen mit leicht gebuckelten Schwingen folgen. Wenn sie in größere Höhen aufsteigen, segeln sie mit waagrecht gehaltenen Flügeln.
Da kein Färbungsdimorphismus besteht und auch der Größendimorphismus mit 2 % (max. 5 %. bei südlichen Vögel) zugunsten der Weibchen sehr moderat ist, sind die Geschlechter feldornithologisch nur durch ihr Verhalten zu unterscheiden.[3]
Erwachsenengefieder
Kopf, Nacken und Hals sind warm zimtbraun; die feine dunkle Strichelung ist nur aus der Nähe zu erkennen. Wangen und Ohrdecken können einen gräulichen Ton aufweisen. Die düster kastanienbraune Grundfärbung des Rückens wird durch die zimtfarbene Randung der Deckfedern aufgehellt, die Schultern deutlich rostbraun. Zum Schwanzansatz wird die Färbung dunkler und weist eine weiße, feine Längsstrichelung auf. Bis auf den Hals ist die gesamte Unterseite auf variablem (zimtfarben, graubraun, auch sehr hellgrau) Grund fein dunkel gesperbert. Der verhältnismäßig lange Schwanz ist schwarz und zeigt eine deutliche weiße Medianbinde und ein feinen weißen Abschluss. Die Flügeldecken sind auf der Oberseite kastanienfarben und zimtfarben gesprenkelt; die Schwingen sind davon klar abgesetzt ungezeichnet zimtfarben. Die tief gefingerten Handschwingen sind schwarz, die Armschwingen sind auf Ober- und Unterseite schwarz gerandet. Fast ungezeichnet zimtfarben sind die Unterflügeldecken; sie setzen sich deutlich von den cremefarbenen, fein dunkel längslinierten Schwingen ab. Die gelben Laufbeine sind bis zum Intertarsalgelenk buschig rostbraun befiedert. Die Iris ist orange, die Wachshaut gelb.
Juvenil- und Immaturgefieder
Das erste Jugendgefieder ist auf der Oberseite dunkel graubraun. Die Unterseite ist sehr hell, fast weiß; sie weist eine dunkle Strichelung und Tropfung auf, die sich im Schulterbereich und an den Flanken flächig verstärkt. Die Flügel sind dunkel gerandet, nur die gefingerten Handschwingen sind bereits rein schwarz. Der helle Schwanz ist mehrfach fein quergestreift und endet in einem dunklen Terminalband. Das Immaturgefieder ist auf der Oberseite noch immer mehrheitlich schiefergrau, weist jedoch bereits zimtfarbene Einschlüsse und teilweise rostbraune Schultern auf. Die Unterseite ist bräunlich-grau und teilweise dunkel getropft, teilweise dunkel gesperbert. Die Schwanzfärbung gleicht bereits weitgehend der des Erwachsenengefieders, das Schwarz ist jedoch noch nicht tief gesättigt, sondern eher dunkel grauschwarz. Charakteristisch für dieses 2. Gefieder ist der breite, cremefarbene Überaugenstreif, der sich bis in den Nacken verlängert. Es ist nicht bekannt, ob nach diesem ersten Immaturgefieder ein weiteres folgt, das sich noch stärker dem Erwachsenengefieder angleicht, oder ob Savannenbussarde in ihrem dritten Lebensjahr ins Erwachsenengefieder wechseln.
Biometrische Daten
Adulte Savannenbussarde wogen zwischen 740 und 1134 Gramm. Weibchen sind im Durchschnitt etwas schwerer. Die Schnabel-Schwanzspitzenlänge schwankt zwischen 46 und 64 Zentimetern, wobei die in den Tropen beheimateten Vögel die kleinsten und jene aus den südlichsten Verbreitungsgebieten die größten sind. Auch in dieser Hinsicht sind Weibchen etwas größer. Die Flügelspannweite liegt zwischen 121 und 140 Zentimetern.[4]
Stimme
Ferguson-Lees bezeichnet die Art als eher still. Akustisch auffällig wird sie nur während der Etablierung eines Territoriums und in der Paarbildungsphase, aber selbst in diesen Zeiten ist ihre Vokalpräsenz niedriger als die anderer Schwarzbussarde.[3] Der Hauptruf, als Anwesenheits- und Kommunikationsruf eingesetzt, ist ein langgezogenes, grelles Pfeifen, das im ersten Drittel ansteigt und abfallend ausklingt. Dieser Ruf ist sowohl von fliegenden als auch von sitzenden Vögeln zu hören.[5] Daneben verfügt die Art noch über eine Reihe unterschiedlicher, zum Teil flötender Rufe.[6]
Verbreitung, Wanderungen, Lebensraum und Raumbedarf
Verbreitung
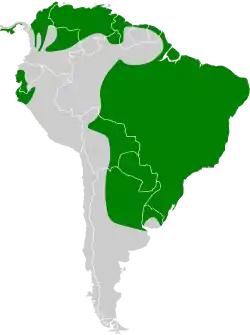
Der Savannenbussard ist eine ausschließlich neotropische Vogelart. Sie kommt vom südlichen Costa Rica, wo sie seit 2014 als Brutvogel geführt wird,[7] (südöstliches Puntarenas und südliches Limón) über das panamesische pazifische und teilweise karibische Küstenland, Kolumbien und das pazifiknahe Ecuador bis ins nördliche Peru (Region Tumbes und nördliche Region Piura) vor.[8] In Venezuela fehlt die Art nur im südlichen Bergland, in Kolumbien, und dem westlichen Guyana reichen die Vorkommen weit ins Hinterland. In Kolumbien sind weiters die Flusstäler des Río Meta und des Río Magdalena besiedelt. Ob die Art auch entlang der kolumbianischen Pazifikküste brütet, ist unklar. Ostwärts ist an der südamerikanischen Golf- und nördlichen Atlantikküste nur das küstennahe Schwemmland besiedelt, im Bergland von Guayana scheint die Art zu fehlen. Kleine Vorkommen bestehen auch auf Trinidad. Im Amazonastiefland Brasiliens ist die Art weit verbreitet, ebenso in den trockeneren südlichen Landesteilen. Wie weit die Art im Amazonasbecken nach Westen vordringt (Peru?) ist nicht bekannt.[3] In Bolivien liegt der Schwerpunkt der Vorkommen in der Osthälfte des Staates, nur im Norden des Departamento La Paz erreichen sie fast die peruanische Grenze.[9] Paraguay ist annähernd flächig besiedelt, in Uruguay wurde der Savannenbussard im südlichen Río-de-la-Plata-Hinterland bisher nicht festgestellt. In Argentinien kommt die Art im Nordosten des Staates vor, südwärts bis in die Provinzen Entre Ríos und Córdoba.
Wanderungen
Der Savannenbussard gilt allgemein als territorialer Standvogel.[3][4] Seine Ortstreue scheint sehr ausgeprägt zu sein.[4] Unterschiedliche saisonale Häufigkeiten bei Linienzählungen in Südbrasilien und Uruguay (größte Häufigkeit im Frühling und Sommer, geringste im Winter) deuten jedoch darauf hin, dass ein Teil der Vögel im Winter abzieht.[10][11] Vollständig scheinen im Winter nur die südlichsten Populationen ihr Brutgebiet zu räumen und bis nach Kolumbien nach Norden zu ziehen. Sie sind zumindest als Mittelstreckenzieher zu bezeichnen. Zusätzlich finden kleinräumige Futterwanderungen statt, und immature Vögel dürften weiträumig umherstreifen. Sie erscheinen regelmäßig weit außerhalb der Brutgebiete, so zum Beispiel in der Provinz Buenos Aires.[4]
Lebensraum


Der Savannenbussard vermag sehr unterschiedliche Lebensräume für sich zu nutzen. Er ist von Wassernähe nicht unabhängig, doch seine Bindung an feuchte Habitate ist bedeutend weniger ausgeprägt als bei anderen Mitgliedern dieser Vogelgattung.[3] Der Schwerpunkt seiner Verbreitung liegt in saisonal feuchten Graslandschaften, in die einzelne Baumgruppen, Wäldchen oder einzelnstehende Bäume eingestreut sind. Solche Landschaftsformen findet er in den Llanos und im Cerrado; in diesen Landschaftstypen dürfte die höchste Brutdichte zu verzeichnen sein. Lebensraum bietet ihm jedoch auch die wesentlich trockenere Pampa, der Chaco und die Caatinga. In sehr feuchten Habitaten, wie etwa dem Pantanal kommt er vor allem in höhergelegenen Regionen vor, die während der Regenzeit nicht unter Wasser geraten. Wenn Wasserläufe in der Nähe sind und das Nahrungsangebot entspricht, findet er selbst in Saguarobeständen geeignete Brutmöglichkeiten. Im Amazonastiefland besiedelt er Schwemmlandstreifen entlang der Flüsse, Rodungsgebiete und nachwachsenden Sekundärwald, sowie natürliche Lichtungen, in Meeresnähe vor allem die saisonal vernässten Bajos, seltener Küstenlagunen und Mangrove.
Der Savannenbussard ist vor allem ein Vogel der Niederungen, der in den Tieflandebenen, sowie in Hügelländern bis etwa 1000 Meter über NHN den Schwerpunkt seiner Verbreitung hat. Nur in wenigen Regionen brütet er in größeren Höhen, so in Panama, Kolumbien und Bolivien (Höchster Brutnachweis 2075 Meter über NHN in Kolumbien)[4]
Häufigkeit und Raumbedarf
Zum Raumbedarf liegen nur wenige Angaben vor. Eine sehr hohe Brutdichte stellte Mader in seiner 1982 fertiggestellten Studie in einer zum Teil palm- zum Teil baumbestandenen Graslandschaft (Llano) Venezuelas fest, auf der extensive Weidewirtschaft betrieben wurde. Auf der 9,4 km² großen Studienfläche zählte er 23 aktive Nester, was einem Brutterritorium von nur ~0,41 km² entspricht.[12] Auch eine Untersuchung aus der Uruguayan Savanna, einer relativ feuchten Ökoregion im südlichen Brasilien und nordöstlichen Uruguay ergab hohe Bestandsdichten, die auf Territorien schließen lassen, die für einen Greifvogel dieser Größe relativ klein sind. Im Durchschnitt wurden auf einigen, je 5,4 km langen Zählstrecken etwa 4 Individuen festgestellt.[11] Dem steht ein Ergebnis gegenüber, das im Nationalpark Emas, einem wesentlich trockeneren Cerradogebiet, das in den Hochebenen bis 1000 Meter über NHN ansteigt, erhoben wurde. Eine Linientaxierung ergab eine durchschnittliche Sichtung von 0,14 Individuen auf 5 km. Der daraus errechnete Raumbedarf betrug 2,42 km² pro Individuum.[10] Global geht der allgemein eher niedrig einschätzende Ferguson-Lees von einem Brutpaar/240 km² aus, bezeichnet die Art jedoch als relatively common (= relativ häufig)[3]
Nahrung und Nahrungserwerb
Nahrungszusammensetzung
_(8077653244).jpg.webp)

Wie viele Mitglieder dieser Vogelgattung ist der Savannenbussard ein Nahrungsgeneralist. Als opportunistischer Prädator verwertet er vor allem jene Beutetiere, bei denen das Verhältnis zwischen Aufwand und Energiegewinn am günstigsten zu sein scheint. Die Palette seiner potenziellen Beutetiere ist deshalb sehr groß; sie ist sowohl saisonal als auch regional sehr unterschiedlich. Vor allem unterscheidet sich die Nahrungszusammensetzung in den Nass- und Trockenzeiten grundsätzlich voneinander: In den Regenzeiten überwiegen Fische, Froschlurche und Süßwasserkrabben in den Trockenzeiten Nagetiere sowie Schlangen und andere Reptilien. Vögel sind in beiden Perioden wichtige Energielieferanten.
Er stellt kleinen Nagetieren bis zur Größe junger Agutis nach, sehr oft fängt er auch unterschiedliche Neuweltmäuse. Er erbeutet Eidechsen (relativ häufig große Schienenechsen wie etwa die Grüne Ameive, oder Grüne Leguane), Schlangen (darunter auch hochgiftige Lanzenottern und Klapperschlangen), sowie unterschiedliche Amphibien.[13] Häufig sucht er Strandabschnitte oder Flussufer nach Krabben, Krebsen und angespülten Fischen ab. Auch große Insekten und große Spinnentiere gehören zu den regelmäßig aufgenommenen Beutetieren. In Gezeitentümpel und trockenfallenden Wasserflächen jagt er nach dort gefangenen Fischen. Kiemenschlitzaale können kurzfristig zur Hauptbeute werden und stellen regional neben Krabben einen wesentlichen Bestandteil der Nestlingsnahrung dar.[12] Immer bilden Vögel einen nicht unwesentlichen Bestandteil seiner Nahrung. Vor allem Tauben und Kuhstärlinge, aber auch größere Vögel wie etwa Anis werden vom Savannenbussard erbeutet.[4][3][12] Häufig verzehrt er Aas, vor allem überfahrene Reptilien, die er von Straßen aufliest.
Jagdverhalten
Der Savannenbussard ist ein flexibler Jäger, der imstande ist, seine Jagdstrategie den ins Auge gefassten Beutetieren anzupassen. Häufig hält er von einer erhöhten Warte (Weidezaun, Telegrafenmast und anderes) aus Ausschau. Erblickt er ein Beutetier, versucht er es im Gleitflug zu erreichen und am Boden zu schlagen. Insekten und Vögel erbeutet er im Flug oder streift sie von Ästen ab. Häufig jagt der langbeinige Greifvogel laufend oder flughüpfend am Boden, oder sucht in einem langsamen, niedrigen Suchflug den Boden nach geeigneter Beute ab. Bei solchen Transekt-Flügen ist er auch imstande über einem potenziellen Beutetier eine kurze Zeit zu rütteln. Savannenbussarde fliegen weite Strecken um bei Grasbränden fliehende, verletzte oder bereits tote Tiere zu erbeuten. Bei solch ergiebigen Ressourcen können sich große Gruppen von Individuen versammeln, ohne dass wesentliche Aggressionshandlungen ausgelöst werden. Schließlich betreibt diese Art regelmäßig Kleptoparasitismus; besonders Reiher Störche oder Ibisse bedrängt er so lange, bis diese bereits verschluckte Nahrung wieder auswürgen.[4]
Brutbiologie
Die Brutbiologie der Art ist noch ungenügend dokumentiert. Die detailliertesten Informationen liefert die Arbeit Maders (1982), deren Untersuchungsgebiet in der Provinz Guárico im zentralen Venezuela lag. Es muss dahingestellt bleiben, inwieweit die Ergebnisse dieser Arbeit für Populationen Geltung haben, die in ganz anderen Lebensräumen brüten.
Paarbindung und Nest
Die Paarbildung ist unauffällig. Sie besteht vor allem aus Ausdrucksflügen über dem Revier und Rufreihen. Flugakrobatik wurde bisher nicht beobachtet.[3] Der Savannenbussard führt eine mehrjährige, möglicherweise permanente Partnerschaft.[12] Das Paar errichtet zwar ein Revier, dessen Grenzen regelmäßig abgeflogen werden, intensiv verteidigt scheint aber nur die unmittelbare Nestumgebung zu werden. Beflogene Nester können sehr nahe beieinander stehen, ohne dass bisher innerartliche ernste Aggressionshandlungen beobachtet wurden. Das Nest selbst ist eine bei Erstbenutzung eher kleine, schlampig wirkende Konstruktion aus Zweigen mit etwa 60 Zentimetern Durchmesser. Es wird außen mit grünen Zweigen, Palmwedeln und allerlei grünen Ranken verkleidet, innen mit frischem grünen Laub und Gras ausgelegt. Die Nester werden in Astgabelungen von Bäumen, oft Überhältern, aber auch in Palmen, zuweilen auch auf Telegrafenmasten angelegt. Sie werden mehrfach benutzt und wachsen im Laufe der Zeit zu umfangreichen Gebilden heran.[12]
Die Brutzeiten liegen meist in den jeweiligen Regenperioden: In Mittelamerika und dem nördlichen Südamerika zwischen April und Oktober, in Kolumbien zwischen Februar und Juni, so auch auf Trinidad. In Bolivien, Brasilien und Argentinien liegt der Legegipfel zwischen September und Januar. Frische Gelege können aber auch außerhalb dieser Zeiten gefunden werden.
Gelege und Brut
In den meisten Fällen scheint das Gelege aus nur einem Ei zu bestehen. Es wurden aber auch Zweiergelege beobachtet, von denen beide Jungen zum Ausfliegen kamen. Das Ei ist annähernd ungezeichnet weiß, misst 59 x 47 Millimeter und wird etwa 39 Tage (37 – 40) bebrütet.[4] Über die Aufgabenteilung während der Brutzeit liegen keine Informationen vor. Bei Gelege oder Nestlingsverlust wird häufig eine Ersatzbrut begonnen, die jedoch sehr häufig scheitert.
Von den 23 Paaren die Mader beobachtete, schritten 21 zur Brut; insgesamt wurden 27 Eier gelegt (15 Einer- und 6 Zweiergelege). Zwei Junge flogen bei keinem Nest aus. Mader manipulierte im darauffolgenden Jahr 10 Nester mit Einergelege, indem er ein zweites Ei hinzufügte. Von diesen künstlichen Zweiergelegen kamen bei 6 ein Junges zum Ausfliegen, drei scheiterten vollkommen und nur bei einem flogen beide Nestlinge aus. Zwischen den Nestlingen waren keine schwerwiegenden Aggressionshandlungen zu beobachten, auch die in unterschiedlichen Entwicklungsstadien verstorbenen Jungen aus den 6 anderen Nestern zeigten keine Verletzungen, die auf Geschwisteraggressivität hindeuteten. Die Jungen aus diesen Zweiergelegen waren signifikant leichter und weniger fit als jene aus Einergelegen, sodass Nahrungsmangel der Grund für den Tod der meisten Küken aus Zweiergelegen war. Mader vermutet deshalb auch, dass bei dieser Art das Nahrungsangebot das wesentlichste Regulativ für die Gelegegröße ist.[12]
Nestlings- und Führungszeit sowie Bruterfolg
Die Nestlingszeit beträgt 45 bis 50 Tage. Nach dem Ausfliegen bleibt der Jungvogel im unmittelbaren Nestbereich und wird weiter von beiden Eltern mit Nahrung versorgt. Diese Abhängigkeit von der Fürsorge der Eltern lockert sich zwar kontinuierlich, indem der Jungvogel seinen Aktionsradius erweitert und selbstständig versucht Beute zu machen, bis zur vollständigen Unabhängigkeit vergehen jedoch 4 bis 7 Monate. Danach dismigrieren die Jungvögel und streifen oft weiträumig, ungerichtet umher.
Der Bruterfolg und Reproduktionsrate dieser Art scheinen nicht hoch zu sein. Das liegt einerseits an der geringen Eianzahl, andererseits daran, dass viele Bruten scheitern. In Maders Untersuchungsreihe wurden in den zwei Beobachtungsjahren von den 23 beobachteten Paaren 42 Eier bebrütet; sie brachten 22 Junge zum Ausfliegen.[12] Das HBW gibt den Prozentsatz gescheiterter Bruten mit 52,9 % an.[4]
Lebenserwartung
Zur Lebenserwartung und zum Höchstalter liegen keine expliziten Informationen vor. Mader beringte 45 adulte Savannenbussarde; von diesen waren 35 im darauffolgenden Jahr und 28 zwei Jahre später noch am Leben, bzw. konnten im Untersuchungsgebiet nachgewiesen werden. Da angenommen werden muss, dass einige das Gebiet verlassen hatten, scheinen diese Zahlen auf eine recht hohe jährliche Überlebensrate adulter Savannenbussarde hinzuweisen. Auch die vergleichsweise hohe Ortstreue wird durch diese Zahlen untermauert.[12]
Systematik
1787 beschrieb John Latham diese Art als Rufous Headed Falcon; als Typuslokalität gibt er Cayenne an. Ein wissenschaftliches Binomen vergibt er nicht.[15] 1790 verweist er in dem auf Latein verfassten Index Ornithologicus auf diese englische Erstbeschreibung und nennt die Art Falco meridionalis.[16] Danach wurde die Art unterschiedlichen Gattungen (Morphnus, Buteo, Urubitinga und anderen, aber auch schon Buteogallus) zugeordnet, bis sich gegen Ende des Jahrhunderts die Einordnung in die 1874 von Richard Bowdler Sharpe neu definierte Gattung Heterospizias durchsetzte. 1982 schlug Dean Amadon eine grundlegende Neuordnung der Buteoninae vor, die unter anderem die Einordnung von Heterospizias in Buteogallus beinhaltete.[17] Diese Arbeit, die noch ausschließlich morphologische und verhaltensbiologische Erkenntnisse auswertete, war mit die Grundlage der heutigen Systematik dieser Vogelgruppe. Schließlich bestätigten die molekulargenetische Untersuchungen von J. M. Riesing et al.[18] sowie die von Fabio Raposo do Amaral et al.[19] einige der bereits vollzogenen Änderungen und führten zu weiteren grundlegenden Neubewertungen. Mit Stand Anfang 2021 gilt die taxonomische Position von Buteogallus meridionalis als weitgehend anerkannt. Die Art ist monotypisch. In die nächste Verwandtschaft ist Buteogallus lacernulatus zu stellen.[20]
In der Vergangenheit wurden neben dem nominotypischen Taxon zwei Unterarten angeführt. B. m. rufulus (SE Brasilien, Paraguay) ist sicher als klinale Farbvariation anzusehen. Die durchschnittlich größeren, dunkleren Vögel mit intensiverer Rostrotfärbung, die vor allem im südlichsten Abschnitt des Verbreitungsgebietes auftreten und als B. m. australis bezeichnet wurden, verdienen jedoch nähere wissenschaftliche Beachtung.[3]
Bestand und Bedrohung
BirdLife geht von einem Gesamtverbreitungsgebiet von fast 20 Mio. km² aus und beziffert den Gesamtbestand mit 5 – 50 Mio. Individuen. Der Bestandsverlauf wird als stabil bewertet. Demzufolge scheint der Savannenbussard in keiner Gefährdungsstufe auf und wird mit LC = least concern bewertet.[1] Legt man die Einschätzung Ferguson-Lees zugrunde, ergibt sich ein Gesamtbestand von knapp 100.000 Brutpaaren.[3] Das HBW gibt keine Zahlen an, bezeichnet den Bestand aber ebenfalls als stabil und sieht aufgrund von anhaltender Entwaldung weiter Gebiete sogar Chancen für die Art, ihr Brutgebiet zu erweitern, ein Prozess, der zurzeit in Costa Rica stattzufinden scheint.[4]
Adulte Savannenbussarde haben kaum natürliche Feinde. Allerdings verunglücken viele im Straßenverkehr oder werden durch Windkraftanlagen getötet. Nestlinge fallen jedoch einer Reihe von Prädatoren wie unterschiedlichen Greifvögel, Affen, Waschbären und baumkletternden Schlangen zum Opfer. Potenziell ist jedoch Habitatsverlust, insbesondere die Umwandlung seines Lebensraumes in Ackerland, die größte Gefahr für eine substantielle Bestandsminderung.
Literatur
- R. O. Bierregaard und G. M. Kirwan (2020): Savanna Hawk (Buteogallus meridionalis). Version 1.0. In Birds of the World (J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, and E. de Juana, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.savhaw1.01
- James Ferguson-Lees, David A. Christie: Raptors of the World. Houghton Mifflin, Boston 2001, ISBN 0-618-12762-3, S. 990; S. 635 – 636.
Einzelnachweise
- BirdLife International (2021) Species factsheet: Buteogallus meridionalis. Heruntergeladen von am 7. Januar 2021
- James A. Jobling: The Helm Dictionary of scientific Bird Names. Christopher Helm, London 2010. ISBN 978-1-4081-2501-4
- James Ferguson-Lees, David A. Christie: Raptors of the World. Houghton Mifflin, Boston 2001, ISBN 0-618-12762-3, S. 990; S. 635 – 636.
- R. O. Bierregaard und G. M. Kirwan (2020): Savanna Hawk (Buteogallus meridionalis). Version 1.0. In Birds of the World (J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie, and E. de Juana, Editors). Cornell Lab of Ornithology, Ithaca, NY, USA. https://doi.org/10.2173/bow.savhaw1.01
- xeno-canto
- xeno-canto
- Oscar Ramírez-Alán: Lista Oficial de las Aves de Costa Rica. Actualización 2014 In: Zeledonia 18:2 (2014) pdf span.
- Peru Aves
- Birds of Bolivia Datenblatt mit Verbreitungskarte engl./span.
- L. C. Baumgarten: Ecologia dos Falconiformes de Áeras abertas do Parque National das Emas (Mineiros-GO). Diss. 1999. S. 36
- F. Zilio, Laura Verastro und Márcio Borges-Martins: Temporal Fluctuations in Raptor Abundances in Grassland in southeastern South America In: Raptor Research 48(2)(2014); S. 151–161; doi: 10.3356/JRR-13-00060.1 pdf engl.
- W. J. Mader: Ecology and Breeding Habits of the Savanna Hawk in the Llanos of Venezuela In: Condor 84 (1982); S. 261–271
- F. Haverschmidt: Notes on the feeding Habits and Food of some Hawks of Suriname. In: The Condor 64 (1961) S. 154–158 pdf engl.
- John Latham: Supplement to the General Synopsis of Birds. London 1787 S. 33
- John Latham: Index Ornithologicus. London 1790. S. 36
- Dean Amadon: A revision of the sub-buteonine hawks (Accipitridae, Aves). In: American Museum novitates; Nr.: 2741 (1982) pdf engl.
- J. M. Riesing, Luise Kruckenhauser, A. Gamauf und E. Haring: Molecular phylogeny of the genus Buteo (Aves: Accipitridae). In: Molecular Phylogenetics and Evolution 27 (2003); S. 328–342;
- F. Raposo do Amaral et al.: Patterns and Processes of Diversification in a Widespread and Ecologically Diverse Avian Group, the Buteonine Hawks (Aves, Accipitridae). In: Molecular Biology and Evolution 53, 2009; S. 703–715; doi: 10.1016/j.ympev.2009.07.020
- Raposo et al. S. 707